
- •Магсумов тимур ильнурович
- •Зависимости термодинамических функций сольватации неполярных соединений от состава водно-органических смесей
- •Содержание
- •Введение
- •1. Литературный обзор
- •1.1. Термодинамические функции растворения и сольватации
- •1.1.1. Энергия Гиббса растворения и сольватации
- •1.1.2. Энтальпия растворения и сольватации
- •1.2. Соотношения между энергией Гиббса и энтальпией сольватации. Сольвофобные эффекты
- •1.3. Литературные данные по энергиям Гиббса растворения/сольватации в водно-органических смесях
- •1.4. Литературные данные по энтальпиям растворения в водно-органических смесях
- •1.5. Методы расчета термодинамических функций растворения в смешанных растворителях
- •1.5.1. Методы расчета термодинамических функций сольватации в водно-органических смесях
- •1.5.2. Расчет термодинамических функций сольватации методами компьютерного моделирования
- •Постановка задачи
- •2. Экспериментальная часть
- •2.1 Реактивы
- •2.2. Измерение коэффициентов активности при предельном разбавлении
- •2.3. Измерение энтальпий растворения
- •3. Результаты и обсуждение
- •3.2. Сольватация бензола в водно-органических смесях
- •3.3. Молекулярно-динамическое моделирование сольватации в водно-органических смесях
- •Основные результаты и выводы
- •Список использованной литературы
3. Результаты и обсуждение
Экспериментальные значения коэффициентов активности, рассчитанные по уравнению 34 величины энергий Гиббса сольватации и энтальпии сольватации углеводородов в водно-органических смесях приведены в таблицах 2-5 (здесь и далее в работе x2 – мольная доля воды). Данные по энергиям Гиббса и энтальпиям сольватации в воде взяты из литературы.
Таблица 2. Экспериментальные значения предельных коэффициентов активности и свободных энергий Гиббса сольватации октана и толуола в водно-органических смесях
x2 |
|
(кДж/моль) |
|
/ (кДж/моль) |
|
/ (кДж/моль) |
|
Ацетонитрил |
Ацетон |
Тетрагидрофуран |
|||
Октан |
|
|||||
0.0 |
52.3 |
0.0 |
8.63 |
–4.5 |
2.00 |
–8.1 |
0.1 |
87.1 |
1.3 |
15.2 |
–3.1 |
2.96 |
–7.2 |
0.2 |
130 |
2.3 |
24.9 |
–1.9 |
4.20 |
–6.3 |
0.3 |
214 |
3.5 |
41.3 |
–0.6 |
6.46 |
–5.2 |
0.4 |
343 |
4.6 |
70.5 |
0.7 |
9.30 |
–4.3 |
0.5 |
616 |
6.1 |
133 |
2.3 |
18.5 |
–2.9 |
0.6 |
1160 |
7.7 |
338 |
4.6 |
33.1 |
–1.2 |
0.7 |
2774 |
9.8 |
1092 |
7.5 |
77.1 |
0.9 |
0.75 |
4727 |
11.1 |
2700 |
9.7 |
– |
– |
0.8 |
9781 |
12.9 |
6930 |
12.1 |
318 |
4.4 |
0.85 |
|
1037 |
7.4 |
|||
1 |
|
29.9 [72] |
||||
|
||||||
Толуол |
|
|||||
0.0 |
3.95 |
–4.5 |
2.01 |
–6.4 |
0.72 |
–8.9 |
0.1 |
4.87 |
–4.2 |
2.37 |
–6.0 |
0.86 |
–8.5 |
0.2 |
6.48 |
–3.5 |
3.06 |
–5.3 |
1.07 |
–8.0 |
0.3 |
9.60 |
–2.5 |
4.29 |
–4.5 |
1.59 |
–7.0 |
0.4 |
13.1 |
–1.7 |
6.30 |
–3.5 |
2.22 |
–6.1 |
0.5 |
21.6 |
–0.5 |
10.7 |
–2.2 |
3.24 |
–5.2 |
0.6 |
35.6 |
0.8 |
19.8 |
–0.7 |
5.29 |
–4.0 |
0.7 |
73.5 |
2.6 |
45.4 |
1.3 |
9.9 |
–2.4 |
0.75 |
123 |
3.8 |
91.1 |
3.1 |
12.8 |
–1.8 |
x2 |
|
/ (кДж/моль) |
|
/ (кДж/моль) |
|
/ (кДж/моль) |
0.8 |
211 |
5.2 |
163 |
4.5 |
32.5 |
0.5 |
0.85 |
509 |
7.3 |
407 |
6.8 |
70.5 |
2.4 |
0.9 |
1192 |
9.5 |
934 |
8.8 |
193 |
4.9 |
0.95 |
2958 |
11.7 |
2679 |
11.5 |
1945 |
10.7 |
1 |
|
14.4 [73] |
||||
Таблица 3. Экспериментальные значения предельных коэффициентов активности и энергий Гиббса сольватации бензола в водно-органических смесях
x2 |
|
/ (кДж/моль) |
x2 |
|
/ (кДж/моль) |
Диметилсульфоксид |
Ацетон |
||||
0 |
3.10 |
–2.32 |
0.0 |
1.58 |
–3.99 |
0.1 |
3.75 |
–1.85 |
0.12 |
2.00 |
–3.41 |
0.3 |
8.56 |
0.20 |
0.3 |
3.37 |
–2.11 |
0.5 |
24.6 |
2.82 |
0.5 |
7.76 |
–0.05 |
0.7 |
91.9 |
6.08 |
0.7 |
28.8 |
3.20 |
0.75 |
160 |
7.45 |
0.8 |
82.6 |
5.82 |
0.8 |
203 |
8.05 |
0.85 |
168 |
7.57 |
0.85 |
334 |
9.28 |
0.9 |
380 |
9.60 |
0.9 |
547 |
10.50 |
|
||
0.95 |
974 |
11.93 |
|||
1,4–Диоксан |
трет-Бутанол |
||||
0 |
1.05 |
–5.02 |
0 |
3.58 |
-1.96 |
0.1 |
1.31 |
–4.46 |
0.1 |
3.99 |
–1.69 |
0.25 |
1.83 |
–3.63 |
0.25 |
5.05 |
–1.11 |
0.4 |
2.97 |
–2.42 |
0.35 |
6.29 |
–0.57 |
0.5 |
4.22 |
–1.56 |
0.5 |
9.48 |
0.45 |
0.6 |
8.08 |
0.05 |
0.7 |
21.4 |
2.46 |
0.68 |
14.0 |
1.42 |
0.8 |
42.9 |
4.19 |
0.75 |
26.3 |
2.98 |
0.85 |
77.2 |
5.65 |
0.8 |
46.5 |
4.39 |
0.9 |
173 |
7.65 |
0.85 |
103 |
6.37 |
0.925 |
371 |
9.54 |
0.9 |
243 |
8.49 |
0.95 |
940 |
11.84 |
0.92 |
508 |
10.32 |
|
||
0.95 |
795 |
11.43 |
|||
0.97 |
1144 |
12.33 |
|||
0.99 |
2052 |
13.78 |
|||
x2 |
|
/ (кДж/моль) |
|||
N-метилформамид |
|||||
0 |
4.8 |
-1.2 |
|||
0.1 |
5.71 |
–0.8 |
|||
0.2 |
7.44 |
–0.2 |
|||
0.3 |
10.3 |
0.7 |
|||
0.4 |
15.4 |
1.7 |
|||
0.5 |
24.9 |
2.9 |
|||
0.6 |
43.4 |
4.2 |
|||
0.7 |
91.1 |
6.1 |
|||
1 |
2560 |
14.32 [74] |
|||
Таблица 4. Экспериментальные значения энтальпий сольватации октана и толуола в водно-органических смесях
x2 |
(кДж/моль) |
/ (кДж/моль) |
/ (кДж/моль) |
|
Ацетонитрил |
Ацетон |
Тетрагидрофуран |
Октан |
|
||
0.0 |
–28.1 |
–32.1 |
–37.5 |
0.1 |
–27.6 |
–31.3 |
–37.0 |
0.2 |
–27.4 |
–30.5 |
–36.7 |
0.25 |
–27.4 |
– |
– |
0.3 |
–27.5 |
–29.6 |
–36.0 |
0.33 |
–27.5 |
–29.0 |
– |
0.4 |
–28.7 |
–28.7 |
–35.6 |
0.5 |
–29.6 |
–27.1 |
–34.9 |
0.6 |
–30.8 |
–25.0 |
–32.6 |
0.67 |
–32.2 |
–22.7 |
– |
0.7 |
–31.0 |
–21.2 |
–28.3 |
0.75 |
–30.5 |
–18.7 |
–25.5 |
0.8 |
–29.4 |
–19.6 |
–20.4 |
0.85 |
|
|
–16.9 |
1 |
|
|
–38.4 [75] |
|
|||
Толуол |
|
|
|
0 |
–34.9 |
–37.0 |
–39.0 |
0.1 |
–34.3 |
–36.3 |
–39.0 |
0.2 |
–34.0 |
–35.8 |
–38.7 |
0.3 |
–33.8 |
–34.7 |
–38.4 |
0.4 |
–33.8 |
–34.4 |
–38.0 |
0.5 |
–34.0 |
–33.2 |
–37.1 |
0.6 |
–34.3 |
–31.8 |
–35.9 |
0.7 |
–34.0 |
–29.4 |
–33.5 |
0.75 |
|
–27.7 |
|
0.8 |
–31.8 |
–26.1 |
–28.0 |
0.85 |
–29.1 |
– |
|
0.9 |
–26.3 |
–23.8 |
–19.0 |
0.95 |
|
|
–20.6 |
1 |
|
|
–36.3 [75] |
Таблица 5. Экспериментальные значения энтальпий сольватации бензола в смеси N-метилформамид-вода
x2 |
/(кДж/моль) |
0.0 |
–32.7 |
0.1 |
–32.4 |
0.2 |
–32.1 |
0.3 |
–31.8 |
0.4 |
–31.2 |
0.5 |
–30.7 |
0.6 |
–29.2 |
0.7 |
–28.2 |
1.0 |
–31.7 [75] |
На рисунках 8–10 показаны полученные нами зависимости термодинамических функций сольватации октана и толуола от состава водно-органических смесей.
И для октана, и для толуола наблюдается
возрастание энергии Гиббса сольватации
при увеличении концентрации воды в
смешанном растворителе (рис. 8). Наблюдается
практически линейная зависимость
энергии Гиббса сольватации для смесей
с малым содержанием воды (до 0.4 мольных
долей), а при концентрациях около 0.8-1.0
происходит ее резкий рост, что
сопровождается падением растворимости
углеводородов. Отклонение от 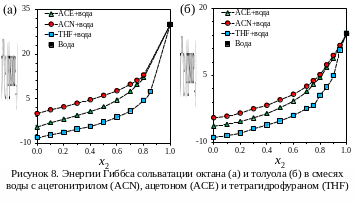 прямой,
соединяющей значения энергии Гиббса в
чистых растворителях, максимально для
смеси тетрагидрофуран-вода и достигает
18 кДж/моль при доле тетрагидрофурана
0.2. Такое поведение может быть объяснено
с точки зрения предпочтительной
сольватации. Случайное распределение
двух сорастворителей в сольватной
оболочке, окружающей молекулу растворенного
вещества должно привести к близкой к
линейной зависимости термодинамической
функции сольватации от мольной доли
одного из сорастворителей [76]. Однако
если сольватационная оболочка обогащена
органическим компонентом, значения
энергии Гиббса будут лежать ниже линии,
соединяющей точки для чистых
сорастворителей. Наличие предпочтительной
сольватации в водно-органических смесях
было подтверждено, например, путем
непосредственного анализа сольватной
оболочки с помощью масс-спектрометрии
[77].
прямой,
соединяющей значения энергии Гиббса в
чистых растворителях, максимально для
смеси тетрагидрофуран-вода и достигает
18 кДж/моль при доле тетрагидрофурана
0.2. Такое поведение может быть объяснено
с точки зрения предпочтительной
сольватации. Случайное распределение
двух сорастворителей в сольватной
оболочке, окружающей молекулу растворенного
вещества должно привести к близкой к
линейной зависимости термодинамической
функции сольватации от мольной доли
одного из сорастворителей [76]. Однако
если сольватационная оболочка обогащена
органическим компонентом, значения
энергии Гиббса будут лежать ниже линии,
соединяющей точки для чистых
сорастворителей. Наличие предпочтительной
сольватации в водно-органических смесях
было подтверждено, например, путем
непосредственного анализа сольватной
оболочки с помощью масс-спектрометрии
[77].
Энтальпии сольватации в смесях с разными
растворителями ведут себя по-разному
(рис. 9). В смеси с ацетоном и тетрагидрофураном
они возрастают с увеличением содержания
воды, достигая максимума при 75–95% воды,
а затем наблюдается резкое снижение
при приближении к чистой воде. Как для
октана, так и для толуола максимальное
значение энтальпии в этой области
наблюдается в смеси воды с тетрагидрофураном.
Поведение смесей ацетонитрил–вода
иное: энтальпия сольватации сначала
немного увеличивается, затем уменьшается
в диапазоне 30–60% воды, а затем снова
начинает расти, доходя до максимума, а
затем идет вниз. Для октана максимум
выражен слабо. Область более низких
концентраций органического сорастворителя
недоступна для исследования из-за крайне
низкой  растворимости
углеводородов, что не позволяет проводить
эксперименты с помощью нашего оборудования.
растворимости
углеводородов, что не позволяет проводить
эксперименты с помощью нашего оборудования.
На рисунке 10 показаны зависимости от
состава для энтропий сольватации. Для
октана в смесях ацетон-вода значения
остаются относительно постоянными в
широком диапазоне концентраций воды
ниже 75-80%, а при большем ее содержании
происходит падение энтропии до значения,
соответствующего чистой воде. В случае
смесей воды с тетрагидрофураном поведение
энтропии при низких концентрациях воды
(до 60-70%) аналогичное, но при большом
содержании воды наблюдается максимум.
В смесях ацетонитрил–вода энтропия
сольватации уменьшается в диапазоне
0-80% воды, в случае толуола при высоких
содержаниях воды имеется максимум. Этот
максимум не наблюдался для октана из-за
экспериментальных сложностей. Известно,
что к сильному снижению энтропии
сольватации в чистой воде приводит
гидрофобный эффект. Из  графика
10 можно сделать вывод, что гидрофобный
(сольвофобный) эффект наблюдается только
при очень высоком содержании воды, а
при добавлении бо́льших количеств
органического растворителя он подавляется.
графика
10 можно сделать вывод, что гидрофобный
(сольвофобный) эффект наблюдается только
при очень высоком содержании воды, а
при добавлении бо́льших количеств
органического растворителя он подавляется.
Поведение энтальпии и энтропии сольватации не может быть объяснено только обогащением состава окружения неполярных веществ органическим сорастворителем. Следует предположить, что процесс реорганизации структуры жидкого бинарного растворителя при введении растворенных молекул имеет собственные энтальпию и энтропию, которые могут иметь большие положительные значения при определенных составах смесей.
Графики энергии Гиббса против энтальпии
сольватации для рассматриваемых систем
показаны на рисунке 11. Как уже было
сказано, в апротонных органических
растворителях энергия Гиббса и энтальпия
сольватации коррелируют и лежат более
или менее близко к линии, описываемой
уравнением
![]() (21) [9], а отклонения от этого соотношения
в сторону больших значений энергий
Гиббса, наблюдаемые для жидкостей с
водородными связями, интерпретируются
как результат сольвофобного эффекта.
В случае водно-органических смесей
точки, соответствующие различными
составам смесей, в
(21) [9], а отклонения от этого соотношения
в сторону больших значений энергий
Гиббса, наблюдаемые для жидкостей с
водородными связями, интерпретируются
как результат сольвофобного эффекта.
В случае водно-органических смесей
точки, соответствующие различными
составам смесей, в 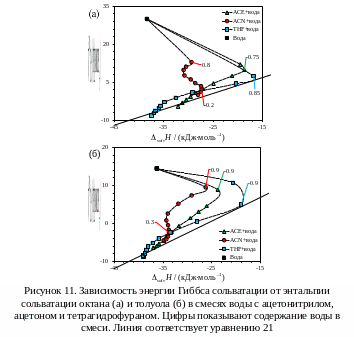 координатах
G–H образуют кривую. Интересно, что
отклонения от прямой (21) для смесей с
ацетоном не превышает 6 кДж/моль даже
при 75% воды, а для смеси ТГФ-вода зависимость
близка к линейной до концентрации воды
85 и 90% для октана и толуола, соответственно.
Для сравнения, в метанольном растворе
сольвофобный эффект приводит к отклонениям
в 5.4 кДж/моль для октана. Одной из возможных
интерпретаций этого факта, опять же,
является предпочтительная сольватация
углеводородов органическим сорастворителем.
В противоположность другим смесям, при
добавлении ацетонитрила сила гидрофобного
эффекта падает медленнее и его подавление
наблюдается лишь при концентрациях
ацетонитрила около 30-40%. Такое отличие
может быть связано с более слабым
водородным связыванием ацетонитрила
с водой [78].
координатах
G–H образуют кривую. Интересно, что
отклонения от прямой (21) для смесей с
ацетоном не превышает 6 кДж/моль даже
при 75% воды, а для смеси ТГФ-вода зависимость
близка к линейной до концентрации воды
85 и 90% для октана и толуола, соответственно.
Для сравнения, в метанольном растворе
сольвофобный эффект приводит к отклонениям
в 5.4 кДж/моль для октана. Одной из возможных
интерпретаций этого факта, опять же,
является предпочтительная сольватация
углеводородов органическим сорастворителем.
В противоположность другим смесям, при
добавлении ацетонитрила сила гидрофобного
эффекта падает медленнее и его подавление
наблюдается лишь при концентрациях
ацетонитрила около 30-40%. Такое отличие
может быть связано с более слабым
водородным связыванием ацетонитрила
с водой [78].
