
Кислотно-основные пары.
Пример: Соотнесите кислоту из левой колонки с основанием из правой колонки так, чтобы они образовали сопряженную кислотно-основную пару:

…
Как с этим бороться:
Очень легкий вопрос! Кислотно-основные пары – это два одинаковых вещества, которые отличаются на один H+, например NH3 и NH4+. Нет, тут нет наёбки. Да, тут всё так просто. Важно, чтобы они отличались именно на один H+.
Например,
HPO42- и H2PO4- – это кислотно-основная пара. HPO42- и H3PO4- – это не кислотно-основная пара.
ОТВЕТ:
Догадайтесь сами
Протолитические равновесия.
Пример:

Нууууу, уже так…
Как с этим бороться:
Протолитическое равновесие – это реакция, в которой отдается или присоединяется H+
Грубо можно сказать, что если в реакции есть кислотно-основная пара (см. пред. вопрос), то это «элементарный акт» реакции протолитического равновесия, как об этом написано в вопросе. Важно, чтобы отличие было именно в один Н+! В два и более, это уже не элементарный акт протолитического равновесия. Например, Н3РО4 ↔ Н2РО4- + Н+ считается протолитическим. равновесием, Н3РО4 ↔ РО43- + 3 Н+ не считается. Внимательно осмотрите реакции. Вещество может присоединять/отдавать Н+ из среды, например, Н3РО4 ↔ Н2РО4- + Н+, но это бывает редко. Чаще вещества передают Н+ друг другу. Очень часто в этом участвует вода, например, HBr + H2O ↔ H3O+ + Br-. Тут кислота передаёт воде Н+, вода переходит в гидроксониий. Кислотно-основная пара, как положено, налицо, значит равновесие.
Подбор формул.
Пример:

Тоже изи…
Как с этим бороться:
Для подбора формул используем таблицу из методички стр. 33. Хотя это и так у всех есть, для краткости поисков приведём её тут.
Сильная кислота |
|
Сильное основание |
|
Слабая кислота |
|
Слабое основание |
|
Соль сильного основания и сильной кислоты |
|
Соль сильного основания и слабой кислоты |
|
Соль слабого основания и сильной кислоты |
|
Кислая соль |
|
Заметим, что есть несколько подводных граблей.
Сильные кислоты и основания бывают двухосновными, например H2SO4 или Ba(OH)2. Для них в формуле концентрация умножается на 2, то есть

Связано с тем, что при диссоциации на 1 молекулу кислоты образуется 2 Н+, с основанием аналогично. Кстати, в примере как раз об этом, ответ
Слабые двухосновные кислоты, может быть дано две константы диссоциации рКа1 и рКа2. Спраедливо может возникнуть вопрос
какого хуя тут творится?!?!какую константу следует использовать. Ответ — только первую, вторая нахуй не нужна для этого вопроса. Объяснение, если оно кому-то интересно: слабые кислоты диссоциируют по первой ступени, выделяющийся ион Н+ смещает равновесие по второй ступени практически полностью в сторону подавления диссоциации.Соли слабых двухосновных кислот с сильными основаниями, та же херня, тоже две константы. Тут нужна вторая, только рКа2. Для фосфорной кислоты брать рКа3. Короче, берётся большая константа.
Гидрофосфаты и дигидрофосфаты, кислые соли фосфорной кислоты. Т.к. фосфорная кислота трёхосновная, то дано будет три (АААА!!!! Что творится, ёб твою мать) константы диссоциации: рКа1, рКа2, рКа3. Для солей НРО42- рН считается по 2-ой и 3-ей константам, а для Н2РО4- по 1-ой и 2-ой:

а вот объяснений не приводим.


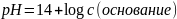

 (да, тут нет расчетов)
(да, тут нет расчетов)