
- •Практическая работа №4. Закономерности протекания химических процессов.
- •Решите задачи
- •Практическая работа №5. Основы кинетики.
- •Практические работы №№ 6 -7. Растворы. Концентрация растворов. Свойства растворов.
- •Расчетные задачи по темам Способы выражения концентрации растворов
- •Свойства растворов неэлектролитов
- •Свойства растворов электролитов
- •Практические работы №№ 8-9. Окислительно-восстановительные реакции. Основы электрохимических превращений
- •Решите задачи.
Федеральное государственное автономное образовательное учреждение
высшего профессионального образования
«Национальный исследовательский технологический университет «МИСиС»
Новотроицкий филиал
Кафедра математики и естествознания
Методические указания
для подготовки к практическим занятиям
Дисциплина: Общая и неорганическая химия
Направление: 240100
Форма обучения: очная
Практическая работа №1. Повторение основных понятий и законов химии
При изучении (повторении) темы рекомендуется использовать учебно-методические пособия по общей химии Яньшиной Т.Н. «Основные классы неорганических соединений» и Серженко Л.Ф. и Яньшиной Т.Н. «Расчеты по химическим формулам»
Сформулируйте определения основных понятий химии: атом, молекула, ион, химический элемент, простое вещество, сложное вещество, моль, молярная масса, молекулярная масса.
Сформулируйте основные стехиометрические законы химии: закон сохранения массы и энергии, постоянства состава вещества, закон кратных отношений, закон Авогадро и следствия из него, закон эквивалентов.
Классификация неорганических соединений.
Определение, классификация, номенклатура, химические свойства основных классов неорганических соединений: оксидов, кислот, оснований, солей.
Амфотерность. Охарактеризовать химические свойства амфотерных оксидов и гидроксидов.
Расчеты молярных масс эквивалентов элемента, оксида, кислоты, основания, соли.
Задания в вышеуказанных методических пособиях
Практическая работа №2. Строение атома. Периодический закон и периодическая система химических элементов Д.И.Менделеева.
История развития теории строения атома от древнейших времен до модели строения атома Резерфорда-Бора.
Состав ядра (радиус, заряд ядра, масса; характеристика частиц, входящих в состав ядра).
Что называется изотопами? Приведите примеры изотопов. Что называется радиоактивностью? Закончите уравнения радиоактивных превращений: 1)
 →
4α + 2β + Х;
2)
→
4α + 2β + Х;
2) 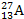 l
+
l
+  → α + Х;
3)
→ α + Х;
3)  + α →
+ α →  + Х.
+ Х.Процентное содержание изотопа
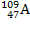 g
равно 44%, а изотопа
g
равно 44%, а изотопа  g
- 56%.
g
- 56%.
Определите среднюю относительную атомную массу серебра.
Дайте характеристику корпускулярно-волновой двойственности электрона (масса, заряд, длина волны).
Дайте характеристику квантовым числам (обозначение, какие значения могут иметь, что характеризуют).
Сколько и какие значения может принимать магнитное квантовое число ml, если l = 3?
Сформулируйте правила заполнения электронных уровней атома электронами.
В чем заключается принцип Паули? Может ли быть на каком-нибудь подуровне атома р7 или d12 электронов? Почему? Составьте формулу атома элемента с порядковым номером 22 и укажите его высшую степень окисления.
Сформулируйте правило Клечковского и поясните, какие подуровни атома заполняются раньше: 4s или 3d; 5s или 4р?
Что называется энергией ионизации атома? Какие свойства атома характеризует энергия ионизации атома? Как изменяются энергия ионизации и свойства, которые она характеризует в периоде и группе?
Что называется сродством к электрону? Какие свойства атома характеризует сродство к электрону? Как изменяется в периоде и группе сродство к электрону?
Что называется электроотрицательностью атома? Как вычисляется электроотрицательность атома? Как изменяется электроотрицательность атомов в периоде и группе?
Приведите современную формулировку Периодического закона химических элементов. Структура периодической системы (порядковый номер, период, группа) с точки зрения строения атома.
Чем объясняется с точки зрения строения атома периодическое изменение свойств химических элементов?
Составьте химические формулы оксидов и гидроксидов элементов третьего периода периодической системы, отвечающих их высшей степени окисления. Как изменяются кислотно-основные свойства оксидов и гидроксидов при увеличении порядкового номера элемента?
Составьте электронные формулы атомов химических элементов с порядковыми номерами 12 и 34. Определите, у какого из атомов этих элементов сильнее выражены металлические свойства. Почему?
Составьте электронные формулы атомов химических элементов с порядковыми номерами 14 и 40. Какие электроны этих атомов являются валентными?
Какой из атомов элементов четвертого периода ванадий или мышьяк – обладает более выраженными металлическими свойствами? Почему?
Определите высшую и низшую степени окисления атомов химических элементов с порядковыми номерами 14 и 33. Приведите примеры химических соединений этих элементов с данными степенями окисления.
Напишите электронные формулы атомов химических элементов с порядковыми номерами 16 и 33. Какую высшую и низшую степени окисления имеют атомы данных химических элементов? Составьте химическую формулу соединения, содержащего химический элемент №16 в низшей степени окисления.
Напишите электронные формулы атомов химических элементов с порядковыми номерами 17 и 21. Какую высшую и низшую степени окисления имеют атомы данных химических элементов? Составьте химические формулы оксидов данных элементов в их высшей степени окисления.
Определите, в каком периоде, группе, подгруппе находятся элементы, строение внешних энергетических уровней которых в нормальном состоянии имеет вид: а) … 3s23р4; б) …4d55s1. Определите порядковый номер этих элементов, дайте им название.
Какую низшую степень окисления проявляют хлор, сера, азот, углерод? Почему? Составьте формулы соединений алюминия с данными элементами в этой степени окисления.
Практическая работа №3. Химическая связь.
Что называется ионной связью? Приведите пример вещества, содержащего ионную связь. Поясните механизм образования ионной связи.
Какая химическая связь называется ковалентной? Рассмотрите механизм образования химической связи на примере образования молекулы водорода.
Поясните способы образования ковалентной связи по методу валентных связей (ВС).
Поясните свойства ковалентной связи: насыщаемость и направленность.
Поясните типы гибридизации электронных облаков при образовании химической связи (sр- sр2-, sр3-).
Какая химическая связь называется неполярной и полярной? Приведите примеры. Чем характеризуется полярность связи и полярность молекулы?
Покажите процесс образования химической связи в молекуле кислорода в соответствии с методом валентных связей (ВС).
Поясните процесс образования химической связи по методу молекулярных орбиталей (МО) в молекуле Н2 и ионе
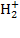 .
.
Какие реакции называются окислительно-восстановительными? Что называют окислением, что называют восстановлением? Какие распространенные окислители и восстановители Вы знаете?
Практическая работа №4. Закономерности протекания химических процессов.
Дайте определение термодинамической системы. Приведите классификацию систем.
Что называют энтальпией системы? Как может изменяться энтальпия химических реакций? Какие уравнения реакций называют термохимическими?
Сформулируйте закон Гесса и следствия из него.
Назовите критерии самопроизвольного протекания химических процессов.
Решите задачи
Напишите термохимическое уравнение реакции горения этилена С2Н4 с образованием углекислого газа и паров воды. Какой объем кислорода вступил в реакцию, если выделилось 6226 кДж теплоты?
Напишите термохимическое уравнение реакции горения бензола. Сколько теплоты выделится при сгорании бензола массой 20 г?
При сгорании кальция массой 8 г количество выделившейся теплоты составило 127 кДж. Вычислите тепловой эффект и напишите термохимическое уравнение реакции горения кальция в кислороде.
Термохимическое уравнение реакции горения этилена C2H4 + 3O2 = 2CO2 + 2H2O; ΔH = – 1400кДж. (г) (г) (г) (г) Рассчитайте количество выделившейся теплоты, если в реакцию вступило 5,6 л этилена (н.у.).
При какой температуре наступит равновесие системы CH4 (г) + CO2 (г) = 2CO (г) + 2H2 (г); ∆Н = +247,37 кДж?
Прямая или обратная реакция будет протекать при стандартных условиях в системе 2NO (г) + O2 (г) D 2NO2 (г) Ответ мотивируйте, вычислив ∆G298 прямой реакции.
Практическая работа №5. Основы кинетики.
Что понимают под скоростью химической реакции? Назовите факторы, влияющие на скорость химических реакций, и кратко их охарактеризуйте.
Объясните влияние температуры на скорость химических реакций. Сформулируйте правило Вант-Гоффа.
Объясните влияние концентрации реагирующих на скорость химических реакций. Сформулируйте закон действующих масс и приведите его математическое выражение.
Дайте понятие катализатора. Объясните механизм влияния катализатора на скорость химических реакций.
Дайте определение химического равновесия. Сформулируйте принцип Ле-Шателье. Как влияют на смещение химического равновесия изменения концентрации, температуры и давления?
Определите температурный коэффициент скорости реакции, если при изменении температуры на 400 С скорость реакции возрастает в 16 раз.
Как изменится скорость реакции 2 NO +О2 = 2NO2, если: а) увеличить давление в системе в 3 раза, б) уменьшить объем системы в 3 раза, в) увеличить концентрацию кислорода в 3 раза?
Гетерогенной химической реакции соответствует уравнение 4Fe(к) + 3O2(г) = 2Fe2O3(к) Как и во сколько раз изменится количество оксида железа (III), если концентрацию кислорода уменьшить в 10 раз?
При определенных условиях реакция хлороводорода с кислородом является обратимой: 4HCl (г) + O2 (г) D 2Cl2 (г) + 2H2O (г); ∆H = -116,4 кДж. Какое влияние на равновесное состояние системы окажут: а) увеличение давления, б) повышение температуры, в) введение катализатора.
Напишите выражение для константы равновесия гетерогенной системы СO2 + C D 2CO. Как изменится скорость прямой реакции, если увеличить концентрацию СО2 в 4 раза? Как следует изменить давление в системе, чтобы сместить равновесие вправо?
Как изменится количество меди, получаемой в результате гетерогенной химической реакции
CuO(к) + Н2(г) D Cu + H2O(г) при увеличении общего давления в системе в два раза?
22. Какие внешние условия необходимо изменить, чтобы сместить равновесие гомогенной системы 4HCl(г) + O2(г) D 2H2O(г) + 2Cl2(г) ; ∆H = -116,4 кДж. в сторону образования хлора?
Напишите термохимическое уравнение реакции окисления оксида азота (II) кислородом. В какую сторону сместится равновесие этой гомогенной системы а) при понижении давления, б) при повышении температуры?
