
- •Министерство здравоохранения рф смоленская государственная медицинская академия кафедра клинической иммунологии и аллергологии
- •Р. Я. Мешкова
- •Руководство по иммунопрофилактике для врачей
- •Смоленск 1998
- •Isbn 5-87349-042-2
- •Содержание
- •Р. Я. Мешкова руководство по иммунопрофилактике для врачей
- •1. Введение
- •1.1. Барьеры, возникающие при иммунизации детей
- •2.1. Виды инфекционных агентов и их локализация в организме
- •2.2. Виды иммунного ответа на первичную инфекцию
- •2.2.1. Фазы иммунного ответа
- •2.3. Течение острой инфекции
- •2.3.1. Механизмы разрушения тканей патогенами
- •Прямое разрушение тканей патогенами
- •Непрямое разрушение тканей патогенами
- •2.4. Врожденный иммунитет (неадаптивная защита)
- •2.4.1. Основные клетки врожденного иммунитета
- •2.5. Адаптивный иммунитет
- •2.5.1. Рециркуляция нативных (примитивных) т-лимфоцитов
- •2.5.2. Адгезивные молекулы
- •А. Суперсемейство иммуноглобулинов
- •Б. Суперсемейство интегринов
- •В. Суперсемейство селектинов
- •Г. Кадгерины
- •Регуляция экспрессии адгезивных молекул
- •2.5.3. Клеточно-опосредованный иммунный ответ
- •Антигенпрезентирующие клетки (apc)
- •Роль эффекторных т-клеток
- •Механизмы t-клеточно-опосредованной цитоксичности
- •Механизмы эффекторного действия воспалительных cd4 t-клеток (Th1)
- •2.5.4. Гуморальный иммунный ответ
- •Антитела
- •Различия иммуноглобулинов
- •2.5.5. Первичный иммунный ответ
- •2.6. Особенности функционирования иммунной системы у детей
- •2.7. Иммунологические механизмы действия вакцин
- •Традиционные вакцины
- •Новое поколение вакцин
- •3.1. Компоненты вакцин
- •Консерванты, стабилизаторы, антибиотики
- •Растворители вакцин
- •Адъюванты
- •3.2. Критерии эффективных вакцин
- •3.3. Условия эффективной вакцинации
- •3.4. Состав отечественных и зарубежных вакцин, используемых для проведения рутинной иммунизации
- •3.4.1. Состав вакцин, входящих в прививочный календарь Отечественные вакцины
- •Импортные вакцины
- •3.4.2. Хранение и транспортировка вакцин
- •3.4.3. Техника вакцинации
- •Пути и техника введения вакцин
- •Общие инструкции
- •Внутримышечные инъекции
- •Внутрикожные инъекции
- •3.5. Вакцинные препараты
- •3.6. Разработка новых видов вакцин
- •Основные этапы создания вакцин
- •Задачи отдельных этапов реализации рпи
- •Итоги рпи-1 и рпи-2
- •4.1. Пересмотр стратегии вакцинации в 90-х годах XX века
- •4.2. Календарь профилактических прививок в России и графики иммунизации за рубежом
- •4.2.1. Возрастные показания и схемы календарного применения вакцин Отечественные вакцины
- •Импортные вакцины
- •4.2.2. Иммунопрофилактика гепатита b
- •Другие схемы вакцинации детей
- •Вакцинация взрослых
- •4.2.3. Иммунопрофилактика гепатита a
- •4.3. Графики иммунизации за рубежом
- •4.3.1. Графики иммунизации детей, стартующих позднее сверстников
- •4.3.2. Иммунизация подростков
- •Иммунопрофилактика гепатита b
- •Иммунопрофилактика кори, паротита, краснухи (mmr-вакцина). 2-я доза
- •Иммунопрофилактика дифтерии и столбняка (адс-вакцина)
- •Иммунопрофилактика полиомиелита
- •Иммунопрофилактика гриппа
- •Иммунопрофилактика пневмококковых заболеваний (пневмококковая полисахаридная вакцина)
- •Иммунопрофилактика гепатита a
- •4.3.3. Вакцинация недоношенных новорожденных
- •4.3.4. Вакцинация беременных женщин
- •4.3.5. Кормление грудью и вакцинация
- •4.3.6. Вакцинация пациентов, не имеющих документов о ранее проведенной вакцинации
- •4.4. Интервалы между вводимыми вакцинами
- •4.4.1. Одновременное введение вакцин
- •Календарные вакцины для детей
- •4.5. Интервалы между введением вакцин и препаратов иммуноглобулинов
- •Живые вакцины
- •Убитые вакцины
- •5.1. Вакцинация пациентов с аллергопатологией
- •5.1.1. Предварительные замечания
- •5.1.2. Рекомендуемые вакцины для детей с аллергопатологией
- •5.1.3. Вакцинация больных, получающих сит
- •5.2. Вакцинация пациентов с имунодефицитами (врожденными и приобретенными)
- •5.2.1. Предварительные замечания
- •5.2.2. Вакцинация пациентов со вторичными иммунодефицитами
- •5.2.3. Вакцинация пациентов с врожденными иммунодефицитами
- •5.2.4. Вакцинация вич-инфицированных пациентов
- •5.3. Вакцинация пациентов с патологией печени.
- •5.4. Вакцинация пациентов с эндокринной патологией.
- •5.5. Вакцинация пациентов с патологией почек
- •5.6. Вакцинация пациентов с патологией цнс
- •5.7. Вакцинация детей с патологией крови
- •5.8. Системные заболевания соединительной ткани
- •5.9. Вакцинация детей при некоторых других заболеваниях и состояниях
- •6.1. Аллергопатология
- •6.2. Иммунодефициты
- •6.3. Патология цнс
- •6.4. Патология почек, печени, поджелудочной железы
- •7. Некоторые аспекты иммунизации взрослых
- •8. Прививочные реакции и осложнения
- •8.1. Вероятные механизмы нежелательных реакций иммунизации
- •8.2. Гиперчувствительность к компонентам вакцин
- •8.3. Нежелательные реакции (осложнения) на отдельные вакцины Вакцина бцж
- •Вакцина против полиомиелита
- •Ипв (инактивированная полиомиелитная вакцина)
- •Акдс-вакцина
- •Адс и ас-анатоксины
- •Вакцина против кори
- •Аллергические реакции
- •Беременность
- •Вакцина против паротита
- •Вакцина против краснухи
- •Вакцина mmr-II (корь, паротит, краснуха)
- •Вакцина против гепатита b
- •Вакцина против пневмококковой инфекции
- •Вакцина против гриппа
- •Вакцина против гемофильной инфекции
- •8.4. Заключения о возможной связи отклонений в состоянии здоровья с вакцинацией
- •9. Противопоказания к вакцинации
- •Словарь терминов
- •Приложение 1 министерство здравоохранения рф приказ №375 от 18.12.97 о календаре профилактических прививок
- •Приказываю:
- •Календарь профилактических прививок
- •Календарь профилактических прививок против вирусного гепатитав
- •Календарь профилактических прививок против инфекционных заболеваний, проведение которых необходимо на эндемичных или энзоотичных территориях и по эпидемическим показаниям
- •Перечень медицинских противопоказаний к проведению профилактических прививок
- •Ложные противопоказания к проведению профилактических прививок
- •Основные положения об организации и проведении профилактических прививок
- •Приложение 2
- •Статья 2. Законодательство Российской Федерации в области иммунопрофилактики
- •Статья 3. Сфера действия настоящего Федерального закона
- •Глава II. Государственная политика в области иммунопрофилактики. Права и обязанности граждан при осуществлении иммунопрофилактики Статья 4. Государственная политика в области иммунопрофилактики
- •Статья 5. Права и обязанности граждан при осуществлении иммунопрофилактики
- •Глава III. Финансирование иммунопрофилактики Статья 6. Финансирование иммунопрофилактики
- •Статья 7. Поставки медицинских иммунобиологических препаратов
- •Глава IV. Организационные основы деятельности в области иммунопрофилактики Статья 8. Организационные основы деятельности в области иммунопрофилактики
- •Статья 9. Национальный календарь профилактических прививок
- •Статья 10. Профилактические прививки по эпидемическим показаниям
- •Статья 11. Требования к проведению профилактических прививок
- •Статья 12. Требования к медицинским иммунобиологическим препаратам
- •Статья 13. Хранение и транспортировка медицинских иммунобиологических препаратов
- •Глава V. Социальная защита граждан при возникновении поствакцинальных осложнений Статья 18. Право граждан на социальную защиту при возникновении поствакцинальных осложнений
- •Статья 19. Государственные единовременные пособия
- •Статья 20. Ежемесячные денежные компенсации
- •Статья 21. Пособия по временной нетрудоспособности
- •Глава VI. Заключительные положения Статья 22. Ответственность за нарушение настоящего Федерального закона
- •Статья 23. Вступление в силу настоящего Федерального закона
2.4. Врожденный иммунитет (неадаптивная защита)
Первая фаза защиты человека от инфекции, называемая врожденный иммунитет, включает[89]:
|
1. |
Механический барьер в виде эпителиальной поверхности, защищающей человека от проникновения микроорганизмов. Бактерии, которые прошли через этот барьер, встречаются с двумя следующими линиями защиты. |
|
2. |
Комплемент. Бактерии активируют альтернативным путем комплемент, который находится в плазме и может опсонизировать или разрушать бактерии. |
|
3. |
Нейтрофилы. Макрофаги. Бактерии поглощаются макрофагами, имеющими на поверхности рецепторы, общие для всех бактерий (например, к липополисахариду – СД14). После связывания бактерий с рецепторами макрофагов, происходит инициирование синтеза цитокинов макрофагами, а бактерии поглощаются макрофагами и перевариваются ими. |
|
4. |
NK-клетки. Вирусинфицированные клетки разрушаются NK-лимфоцитами (естественными киллерами). |
Активация комплемента альтернативным путем и захват микроорганизмов тканевыми макрофагами имеют место в ранние часы после инфицирования. Далее включаются механизмы адаптивной защиты – гуморальный и клеточно-опосредованнный иммунный ответ.
Ранний неадаптивный ответ важен по 2-м причинам. Во-первых, дает возможность контро-лировать инфекцию до развития адаптивного ответа, он развивается быстро, так как не требует клональной селекции лимфоцитов и, следовательно, не требует латентного периода, как это происходит при пролиферации лимфоцитов и дифференцировке их в эффекторные клетки. Во-вторых, ранний ответ в дальнейшем влияет на адаптивный ответ за счет выработки цитокинов макрофагами.
Таким образом, основные отличия врожденного иммунитета от адаптивного следующие:
– начинает действовать немедленно после инфицирования; – нет иммунологической памяти; – отсутствует специфичность.
2.4.1. Основные клетки врожденного иммунитета
К основным клеткам, реализующим механизмы врожденного иммунитета, относятся макрофаги, нейтрофилы, естественные киллеры.
Макрофагипроисходят из циркулирующих в крови моноцитов. В большом количестве они находятся в соединительной ткани, селезенке, печени. Это большие фагоцитирующие клетки, которые играют ключевую роль во всех фазах защиты человека от инфекции. В отличие от моноцитов на макрофагах имеются рецепторы к маннозе, а также СД14-рецептор, который предназначен для связывания с бактериальными липополисахаридами. После связывания бактерий с рецепторами макрофагов происходит инициирование синтеза цитокинов макрофагами, а поглощенные бактерии перевариваются.
В свою очередь, медиаторы воспаления рекрутируют новые фагоцитарные клетки в места локализации инфекции. В частности, макрофаги, активированные с помощью ЛПС (липополисахариды) бактерий, после распознавания, захвата и дегрануляции Гр(–) бактерий синтезируют интерлейкины – ИЛ-1, ИЛ-6, ИЛ-8, ИЛ-12 и TNF-. Другие медиаторы, выделяемые макрофагами в ответ на инфекционные агенты, – это простагландины, оксид азота (NO), лейкотриены (в частности, LB4), PAF-фактор, активирующий пластины. В свою очередь, эти продукты активируют комплемент – С5а, С3а и в меньшей степени С4а. Один из компонентов комплемента, а именно С5а, – активирует тучные клетки, что приводит к выделению гистамина, серотонина и влиянию на эндотелиальные клетки в зоне воспаления. Все указанные факторы участвуют в воспалении.
Рассмотрим более подробно локальные и системные эффекты монокинов – цитокинов, выделяемых макрофагами (рис. 1).
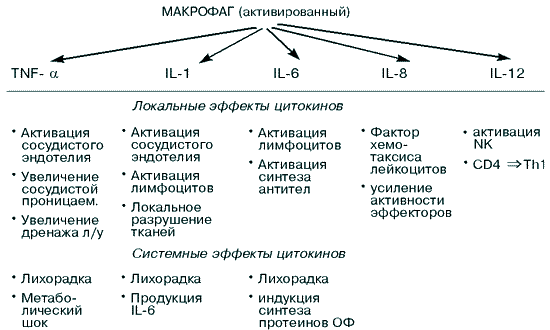
Рис. 1. Эффекты монокинов [89]
Как уже отмечалось, макрофаги поглощают и разрушают в основном Гр(–) бактерии, при этом активируются с помощью ЛПС бактерий и вследствие этого начинают секретировать монокины – интерлейкины 1, 6, 8, 12 и TNF-.
Монокины, выделяемые макрофагами в ответ на бактериальную инфекцию, вызывают следующие эффекты:
– индуцируют продукцию протеинов острой фазы печенью; – усиливают адаптивный иммунный ответ; – повышают температуру тела человека; – индуцируют воспаление, при котором изменяется проницаемость сосудистой стенки, рекрутируются фагоциты, иммунные клетки и молекулы в зону воспаления.
Помимо макрофагов, в реализации механизмов врожденного иммунитета большую роль играют нейтрофилы. Эти клетки преобладают в раннем клеточном инфильтрате в месте воспаления. Они находятся в крови и практически отсутствуют в нормальных тканях. Нейтрофилы – это коротко живущие клетки. В среднем срок их жизни равен 3-4-м дням. При реализации врожденного иммунного ответа продуцируются разные факторы, часть из которых является хемоаттрактантами для нейтрофилов и они быстро эмигрируют из крови и входят в очаг инфекции. В очаге нейтрофилы способны элиминировать многие патогены путем фагоцитоза.
Нейтрофилы способны фагоцитировать как опсонизированные бактерии, т.е. в соединении с антителами (опсонинами), так и в отсутствии антител. Таким образом, нейтрофилы осуществляют первую линию защиты. Компоненты бактериальной клетки могут быть связаны напрямую с нейтрофилами или опосредовано через липополисахариды – LPS, которые вначале связываются с протеинами сыворотки, образуя липополисахаридсвязанный протеин – LBP. Комплексы LPS и LBP затем соединяются с СД 14 на поверхности нейтрофила. Нейтрофилы могут также фагоцитировать комплексы бактерий, соединенные с С3b компонентом комплемента. Это соединение в свою очередь инициирует альтернативный путь активации комплемента.
Нейтрофилы способны элиминировать Гр(–) и Гр(+) бактерии, грибы и даже некоторые оболочечные вирусы. В то же время многие нейтрофилы погибают в очагах воспаления. Часть микроорганизмов фагоцитируется нейтрофилами, но не убивается ими. Но даже такая секвестрация микроорганизмов важна для хозяйской защиты, так как позволяет контролировать инфекцию в ранний период, а секвестрированные частицы вновь рефагоцитируются другими нейтрофилами или макрофагами, которые аккумулируются в зоне воспаления. Из сказанного следует, что нейтрофилы – это важная составная часть врожденного иммунного ответа хозяина на инфекцию.
Естественные киллеры (NK-клетки) служат в качестве самой ранней защиты против интрацеллюлярных микроорганизмов. NK-клетки были идентифицированы по их способности убивать определенные опухолевые клетки in vitro без предварительной активации. Однако известна их роль в ранней фазе защиты от инфицирования интрацеллюлярными патогенами, особенно Herpes virus и Listeria monocytogenes.
Активность естественных киллеров увеличивается в 20-100 раз, когда на них воздействуют цитокины, в частности, IFN-, IFN- или IL-12. Последний называется также NK-активирующим монокином, который продуцируется в раннюю фазу инфекции. ИЛ-12 в сочетании с TNF-a могут вызвать усиление продукции IFN- естественными киллерами.
Поскольку NK-клетки опосредуют в основном защиту человека против вирусов, они должны иметь некие механизмы для дифференцировки инфицированной и неинфицированной клетки. Окончательно этот вопрос не решен, однако установлено, что NK-клетки избирательно убивают клетки-мишени, имеющие низкий уровень молекул MHC класса 1 на своей поверхности. Это предполагает следующий механизм действия NK-клеток [89]: молекулы МНС класса 1 на нормальных клетках распознаются NK-клетками с помощью рецептора Ly49. В результате такого распознавания посылается отрицательный сигнал и происходит ингибиция активации NK-клетки. Иными словами, если рецептор Ly49 на естественных киллерах распознает молекулы МНС класса 1 на поверхности хозяйской клетки, то происходит ингибиция активации NK-клеток и последующего киллинга клетки-мишени не происходит.
Если клетки-мишени не экспрессируют молекулы МНС класса 1, то происходит киллинг их и клетка-мишень погибает. IFN- и IFN- усиливают экспрессию молекул МНС класса 1 на поверхности нормальных неинфицированных клеток, тем самым предотвращая атаку на них NK-клеток. Вирус-инфицированные клетки экспрессируют значительно меньшее количество молекул МНС класса 1, либо на их поверхности отсутствуют эти молекулы. В ряде случаев молекулы МНС класса 1 становятся измененными. В этих случаях рецептор Ly49 не распознает молекулы МНС класса 1 (НLA-B аллели) и нет подачи негативного сигнала. В результате NK-клетка активируется и убивает клетку-мишень.
Активация NK-клетки происходит через поверхностный рецептор NK R-P1 – это лектин-подобный рецептор, распознающий карбогидратные молекулы, являющийся триггером киллинга NK-клеток.
Таким образом, вирусинфицированные клетки могут быть подвергнуты киллингу с помощью NK-клеток двумя путями:
– если вирусы ингибируют весь синтез протеинов хозяина, и тогда а NK-клетки убивают клетку-мишень, т.к. нет подачи негативного сигнала через рецептор Ly49; – если вирусы могут селективно нарушать экспрессию молекул МНС-класса I на поверхность клеток, что делает их чувствительными к киллингу NK-клетками.
С другой стороны, известно, что вирус-инфицированная клетка распознается NK-клеткой даже, когда МНС экспрессия не нарушена вирусом. Люди с дефицитом NK-клеток очень чувствительны к ранней фазе герпес-инфекции [89].
Подводя итоги, следует сказать, что ранний неадаптивный ответ (врожденный иммунитет) на инфекцию вовлекает широкий круг эффекторных механизмов, направленных на разные классы патогенов. Все ответы становятся возможными благодаря рецепторам, которые являются в основном неспецифичными.
