
- •Занятие № 3. Элементы химической кинетики. Катализ.
- •I. Вопросы к занятию
- •II. Задачи и алгоритмы решения к занятию
- •Занятие №4. Коллигативные свойства растворов. Основные типы равновесий и процессов в жизнедеятельности.
- •I. Вопросы к занятию
- •II. Задачи и алгоритмы решения к занятию
- •Лабораторная работа №3. Изучение простых и совмещенных протолитических равновесий.
- •Занятие № 5. Буферные системы. Гетерогенные равновесия.
- •I. Вопросы к занятию
- •II. Задачи к занятию
- •Лабораторная работа №4. Изучение условий растворения и образования осадков.
Занятие № 3. Элементы химической кинетики. Катализ.
I. Вопросы к занятию
пп.2.1-2.3 теоретические вопросы программы.
II. Задачи и алгоритмы решения к занятию
1. Как изменится скорость реакции окисления оксида углерода (II) при увеличении его концентрации в 4 раза? 2СO + O2 ↔ 2СO2.
2. Вычислите скорость реакции, протекающей по уравнению: А + 2В = Д, если [A] =4 моль/л, [B]= 5 моль/л, k = 0,025 л2/моль2мин.
3. При повышении температуры от 20 до 60 ᵒС скорость реакции увеличилась в 8 раз. Вычислите температурный коэффициент скорости реакции.
4. При лечении онкологических заболеваний в опухоль вводят препарат, содержащий радионуклид иридий -192, период полураспада которого равен 74,05 суток Какая часть введенного радионуклида останется в опухоли через 15 суток?
5. Константа скорости инактивации пеницилина при 310 К равна 0,02 ч-1. Рассчитайте период полупревращения этой реакции.
Алгоритмы решения задач:
Задача № 4. Одним из продуктов радиоактивного распада при взрыве атомных станций является радиоактивный изотоп иод-131. В исследуемом образце его находилось 0,02 г. а) Какая часть изотопа останется в образце через месяц (в г и в %). б) Через какое время разложится 99% иода-131? τ0,5 (131I) = 8 сут?
Решение.
Дано: τ = 30 суток, а) С0 = 0,02
б)
τ0,5 (131I) = 8 сут, а) С – ? б) τ - ? |
Реакции радиоактивного распада относятся к реакциям 1 порядка:
К – константа скорости радиоактивного распада, С0 – исходная концентрация радиоактивного вещества, С - концентрация радиоактивного вещества через время τ. |
а) Из (1) находим К:

Из (2) находим С.
= 0,02·е-8,66·30 = 0,001486 (г) или
 =
7,43%
=
7,43%
Ответ: через 30 суток в образце останется 1,486 · 10-3 г изотопа иода -131, или 7%.
б) , отсюда С= 0,02 - 0,99х0,02 = 2·· 10-4 г.
(2)
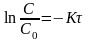 ;
;
 ;
;

Ответ: через 53,15 суток разложится 99% иода-131.
Задача № 5. При лечении онкологических заболеваний в опухоль вводят препарат, содержащий радионуклид иридий -192. Какая часть введенного радионуклида останется в опухоли через 10 суток, если τ0,5 (192Ir) = 74,05 сут?
Решение.
Дано: τ = 10 суток, τ0,5 (192Ir) = 74,05 сут, С – ? |
Реакции радиоактивного распада относятся к реакциям 1 порядка: (1) (2), где К – константа скорости радиоактивного распада, С0 – исходная концентрация радиоактивного вещества, |
С - концентрация радиоактивного вещества через время τ.
Из (1) находим К:

Из (2) находим С.
Если С0 = 1, то = 1·е0,00935·10 = 0,91 или 91%.
Ответ: через 10 суток в опухоли останется 91% радионуклида иридий -192.
Занятие №4. Коллигативные свойства растворов. Основные типы равновесий и процессов в жизнедеятельности.
I. Вопросы к занятию
пп.3-5 теоретические вопросы программы.
II. Задачи и алгоритмы решения к занятию
1. Вычислите осмотическое давление 3% водного раствора мочевины СO(NН2)2 ( = 1,05 г/мл) при 30°С.
2. Найдите осмотическое давление 6,0% раствора KNO3. (=1,036 г/мл) при 20°С, если изотонический коэффициент равен 1,6.
3. Вычислить температуру замерзания раствора рибозы с массовой долей 2% (плотность 1 г/мл).
4. Вычислите молярную массу неэлектролита, если его водный раствор с массовой долей 1,96 % замерзает при -0,248◦С.
5. Что произойдет с эритроцитами при 310 К в 10% растворе глюкозы (=1,0378 г/мл)?
6. Рассчитайте осмотическое давление раствора KCl. c концентрацией 0,1 моль/л, при 27°С, если изотонический коэффициент равен 1,96. Каким будет этот раствор по отношению к плазме крови?
7. Рассчитайте рН раствора соляной кислоты с молярной концентрацией 0,002 моль/л.
8. Рассчитайте рН раствора NaOH с молярной концентрацией 0,003 моль/л.
9. Вычислить ионную силу раствора, содержащего в 500 мл 7,5 г магния хлорида. (Алгоритм решения в лекции №3).
10. Напишите уравнения реакций гидролиза солей: цианида натрия, карбоната калия, фосфата натрия, хлорида аммония, нитрата меди (II), цианида аммония, сульфида аммония, сульфида хрома (III). Для солей, подвергающихся многоступенчатому гидролизу, написать уравнения реакций гидролиза по первой ступени.
Алгоритм решения задачи № 1-2
Запишите данные задачи, переведите необходимые значения в единицы СИ.
Запишите математическую формулу для вычисления осмотического давления.
Вычислите молярную концентрацию раствора по формуле:
С(Х) =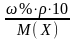
Рассчитайте осмотическое давление по формуле:
πосм = СRT или (задача №2) πосм = iСRT
Алгоритм решения задачи № 3 (приведены два способа вычисления моляльной концентрации).
Запишите данные задачи, переведите необходимые значения в единицы СИ.
Запишите математическую формулу следствия закона Рауля для растворов неэлектролитов ΔТзам.= К·b(Х), К=1,86 кг К моль-1 и Тзам. = Т0зам. - ΔТзам.,
Вычислите моляльную концентрацию раствора (п. 4 - 9 или 4 - 8).
|
|
Алгоритм решения задачи № 4.
Запишите данные задачи, переведите необходимые значения в единицы СИ.
Запишите математическую формулу следствия закона Рауля для растворов неэлектролитов ΔТзам.= К·b(Х), К=1,86 кг К моль-1 и Тзам. = Т0зам. - ΔТзам.,
Преобразуем формулы:
Вычислите молярную массу:

Алгоритм решения задачи №7. Вычислите рН раствора, в котором концентрация ионов Н+ (моль/л) равна 5,6 · 10-7 моль/л.
[H+] = 5,6 · 10-7 моль/л.
рН-? |
Решение. pH = - lg [H+]; pH = - lg 5,6 · 10-7 = 6,25.
Ответ: рН = 6,25. |
Алгоритм решения задачи №8. Вычислите рН раствора, в котором концентрация ионов ОН- равна 6,3 · 10-6 моль/л.
[H+] = 6,3 · 10-6
рН -? |
Решение. 1 способ. pOH = - lg [OH-] = - lg 6,3 · 10-5 = 4,2; pH = 14 – pOH = 14 – 4,2 = 9,8.
|
2 способ.
Ответ: рН = 9,8 |
|
Задача 11. Рассчитайте рН раствора серной кислоты с молярной концентрацией 0,005 моль/л.
С(Н2SO4) = 0,005 моль/л рН = ? |
Решение: Н2SO4 2Н+ + SO42– С(Н+) = 2С(Н2SO4) = 2´ґ0,005 моль/л = 0,01 моль/л рН = – lgС(Н+) рН = – lg (0,01моль/л) = 2 |
Ответ: рН раствора серной кислоты 2.
Задача 12. Определите степень ионизации, концентрацию ионов водорода, рН в 1 М растворе уксусной кислоты, если константа диссоциации ее 1,754 . 10-5. (1 М раствор – раствор с молярной концентрацией 1 моль/л).
Дано: С (СН3СООН) = 1 моль/л Ка = 1,754 . 10-5 ----------------------------------- α-?; [H+]-?; pH - ? |
Решение.
а) степень ионизации: 4∙10-3=0,004 (0,4%). б) концентрация ионов водорода:
1 способ:
2 способ: [H+] = α Со = 0,004 1 = 0,004 моль/л. Для слабых электролитов α → 0, т.е. 1 – α → 1 в) pH = - lg [H+]; pH = - lg 0,004 = 2,4. Ответ: α = 0,4%; H+] = 0,004 моль/л; pH = 2,4. |



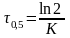 (1)
(1)
 (2), где
(2), где
 ,
моль/кг
,
моль/кг
 Дано:
Дано: Дано:
Дано: Дано:
Дано: