
- •Ковалентная связь
- •Ионная связь
- •Металлическая связь
- •Молекулярная связь
- •Водородная связь
- •9. Положение металлов в периодической системе элементов.
- •17. Термодинамические функции состояния: энергия Гиббса и энергия Гельмгольца. Критерия самопроизвольного протекания процессов. Способы расчета изменения энергии Гиббса в ходе химической реакции.
- •18. Химическое равновесие в гомогенных системах
- •20. Скорость гомогенной химической реакции.
- •21. Дифференциальные и интегральные уравнения скорости для необратимых реакций нулевого, первого, второго порядков. Период полупревращения. Методы определения порядков реакций.
- •Способы выражения концентрации растворов.
- •25. Идеальные растворы. Закон Рауля и следствия из него. Фазовые диаграммы воды водного раствора. Понятие об осмосе, уравнение Вант-Гоффа.
- •26. Растворы электролитов. Теория электролитической диссоциации Аррениуса. Степень диссоциации, константа диссоциации. Факторы, влияющие на них. Закон разбавления Оствальда для слабого электролита.
- •27. Закон Рауля для растворов электролита. Коэффициент диссоциации и его связь со степенью диссоциации.
- •28. Равновесия в водных растворах слабых электролитов. Диссоциация воды. Ионное произведения воды. Водородный и гидроксидный показатели.
- •30. Направление протеканий реакций с участием электролитов( образование осадка, газа, слабого электролита) Гидролиз солей. Типы реакций гидролиза. Степень и константа гидролиза.
- •31.Стандартный электродный потенциал. Понятие о стандартном водородном электроде. Уравнение Нернста для расчета электродного потенциала. Ряд напряжений металлов.
- •32. Классификация электродов (1,2 рода). Металлические электроды. Газовые электроды: водородный, кислородный. Зависимость потенциалов водородного и кислородного электродов от рН.
- •33. Гальванические элементы(гэ) и их классификация. Процессы, протекающие при работе гэ. Расчет эдс и работы гэ. Окислительно-восстановительные и концентрационные гэ. Определение рН раствора.
- •36. Химическая коррозия. Высокотемпературная газовая коррозия. Законы роста оксидных пленок. Фактор Пиллинга-Бэдвордса.
- •33. Гальванические элементы(гэ) и их классификация. Процесы, протекающие при работе гэ. Расчет эдс и работы гэ. Окислительно-восстановительные и концентрационные гэ. Определение рН раствора.
31.Стандартный электродный потенциал. Понятие о стандартном водородном электроде. Уравнение Нернста для расчета электродного потенциала. Ряд напряжений металлов.
При погружении металлической пластинки, с поверхности которой удалена оксидная пленка, в раствор электролита между металлом и раствором возникают ДЭС и скачок потенциала, называемый электродным потенциалом. Причина существования: движение ионов между поверхностью металла и раствором. Значения стандартных потенциалов для ряда электродных процессов в водной среде приведены в таблице в порядке убывания окислит. способности соответствующих систем. Стандартные потенциалы металлов и водорода, расположенные в порядке их возрастания, составляют электрохимический ряд напряжений.
Электродные процессы подразделяются на две категории:
Процессы, протекающие самопроизвольно ( ∆ G< 0), в ходе которых электрическая энергия внешнего источника тока преобразуется в химическую энергию продуктов реакции. Эти процессы называются процессами электролиза, а соответствующие им электрохимические системы называются электролизерами.
Процессы, протекающие под действием внешнего источника энергии ( ∆ G >0), в ходе которых электрическая энергия внешнего источника тока преобразуется в химическую энергию продуктов реакции. Эти процессы называются процессами электролиза, а соответствующие им электрохимические системы называются электролизерами.
В гальванических элементах окисление – процесс самопроизвольный, поэтому на аноде образуется избыток электронов и анод заряжен отрицательно, а на катоде электроны связываются и катод заряжен положительно. При электролизе электроны отрываются от анода внешним источником тока и анод заряжен положительно, а на катод они «нагнетаются» и катод заряжен отрицательно.
В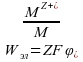 ывод
уравнения Нернста основан на применении
второго начала термодинамики к
электродному процессу. Электрод, на
котором происходит данная реакция,
представляет собой металлическую
пластину, опущенную в раствор соли этого
же металла.
ывод
уравнения Нернста основан на применении
второго начала термодинамики к
электродному процессу. Электрод, на
котором происходит данная реакция,
представляет собой металлическую
пластину, опущенную в раствор соли этого
же металла.
Р абота
электрического поля по переносу 1 моля
катионов металла к (или от) поверхности
металла (электрода) будет равна: где Z-
зарядовое число катиона, т.е число
электронов, участвующих в процессе, F –
постоянная фарадея.
абота
электрического поля по переносу 1 моля
катионов металла к (или от) поверхности
металла (электрода) будет равна: где Z-
зарядовое число катиона, т.е число
электронов, участвующих в процессе, F –
постоянная фарадея.
Согласно второму закону термодинамики, максимальная работа, совершаемая закрытой системой в изобарно-изотермическом процессе, равна убыли ее энергии Гиббса W = − ∆ rG Запишем изотерму Вант-Гоффа для нашего случая в форме:
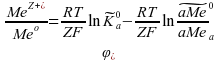 Здесь
мы используем выражение с безразмерными
относительными активностями и безразмерной
стандартной константой равновесия.
Приравнивая (1) и (2), отсюда получим, что
электродный потенциал равен:
Здесь
мы используем выражение с безразмерными
относительными активностями и безразмерной
стандартной константой равновесия.
Приравнивая (1) и (2), отсюда получим, что
электродный потенциал равен:
 У
У![]() читывая,
что относительная активность чистого
твердого металла равна единице
получим уравнение
Нернста для электродного потенциала:
читывая,
что относительная активность чистого
твердого металла равна единице
получим уравнение
Нернста для электродного потенциала: ![]()
Возьмём уравнение Нернста. Каков физический смысл величины ? Это разность потенциалов между металлом и раствором его соли. Определение же абсолютных значений потенциалов собственно поверхности металла и раствора является невозможным. Это, однако, не мешает практическому использованию уравнения Нернста, поскольку во всех процессах физически значимой является не величина потенциала отдельного электрода или элемента его структуры, а величина разности потенциалов электродов электрохимической системы. Вот почему в электрохимии принята система относительных электродных потенциалов, которая основана на приписывании стандартному электроду сравнения потенциала, равного нулю. Тогда по уравнению ЭДС = ϕк − ϕа , приняв значение потенциала одного из электродов за нуль отсчета, находят относительный электродный потенциал исследуемого электрода. В качестве электрода сравнения, потенциал которого принимается за нуль отсчета, по предложению В.Нернста принят стандартный водородный электрод. На этом электроде осуществляется равновесный окислительно- восстановительный процесс: 2Н+ + 2е ⇔ 2Надс. ⇔ Н2 Стандартный водородный электрод представляет собой сосуд, заполненный кислотой, в котором находится платиновая пластинка, служащая для адсорбции молекулярного водорода и его диссоциации на атомы, а также являющаяся проводником первого рода, поставляющим в систему свободные электроны. Концентрация кислоты соответствует 1, парциальное давление водорода в системе поддерживается 105 Па.
