
- •Ковалентная связь
- •Ионная связь
- •Металлическая связь
- •Молекулярная связь
- •Водородная связь
- •9. Положение металлов в периодической системе элементов.
- •17. Термодинамические функции состояния: энергия Гиббса и энергия Гельмгольца. Критерия самопроизвольного протекания процессов. Способы расчета изменения энергии Гиббса в ходе химической реакции.
- •18. Химическое равновесие в гомогенных системах
- •20. Скорость гомогенной химической реакции.
- •21. Дифференциальные и интегральные уравнения скорости для необратимых реакций нулевого, первого, второго порядков. Период полупревращения. Методы определения порядков реакций.
- •Способы выражения концентрации растворов.
- •25. Идеальные растворы. Закон Рауля и следствия из него. Фазовые диаграммы воды водного раствора. Понятие об осмосе, уравнение Вант-Гоффа.
- •26. Растворы электролитов. Теория электролитической диссоциации Аррениуса. Степень диссоциации, константа диссоциации. Факторы, влияющие на них. Закон разбавления Оствальда для слабого электролита.
- •27. Закон Рауля для растворов электролита. Коэффициент диссоциации и его связь со степенью диссоциации.
- •28. Равновесия в водных растворах слабых электролитов. Диссоциация воды. Ионное произведения воды. Водородный и гидроксидный показатели.
- •30. Направление протеканий реакций с участием электролитов( образование осадка, газа, слабого электролита) Гидролиз солей. Типы реакций гидролиза. Степень и константа гидролиза.
- •31.Стандартный электродный потенциал. Понятие о стандартном водородном электроде. Уравнение Нернста для расчета электродного потенциала. Ряд напряжений металлов.
- •32. Классификация электродов (1,2 рода). Металлические электроды. Газовые электроды: водородный, кислородный. Зависимость потенциалов водородного и кислородного электродов от рН.
- •33. Гальванические элементы(гэ) и их классификация. Процессы, протекающие при работе гэ. Расчет эдс и работы гэ. Окислительно-восстановительные и концентрационные гэ. Определение рН раствора.
- •36. Химическая коррозия. Высокотемпературная газовая коррозия. Законы роста оксидных пленок. Фактор Пиллинга-Бэдвордса.
- •33. Гальванические элементы(гэ) и их классификация. Процесы, протекающие при работе гэ. Расчет эдс и работы гэ. Окислительно-восстановительные и концентрационные гэ. Определение рН раствора.
1.Развитие представлений о строении атома. Модель атома Резерфорда. Положения теории строения атома водорода Н. Бора. Корпускулярная-волновая природа микрочастиц. Уравнение волны Л.Де Бройля. Принцип неопределенности Гейзенберга.
Первым основополагающим достижением в области изучения внутреннего строения вещества было создание модели атома английским физиком Резерфордом (1911г). По Резерфорду атом состоит из ядра, окруженного электронной оболочкой. Выдающийся датский физик Бор использовал представления Резерфорда и созданную немецким физиком Планком (1900г) квантовую теорию для разработки в 1913 г теории водородоподобного атома и первой квантовой модели атома.
В соответствии с квантовой моделью атома Бора электрон, имеющий определенное энергетическое состояние, движется в атоме по круговой орбите. Электроны с одинаковым запасом энергии находятся на равных расстояниях от ядра; каждому энергетическому уровню отвечает свой набор электронов, названный Бором электронным слоем. Таким образом, по Бору электроны одного слоя двигаются по шаровой поверхности, электроны следующего слоя – по своей шаровой поверхности; все сферы вписаны одна в другую с центром, отвечающим атомному ядру. Внешняя сфера образует внешнюю границу атома. Первый постулат Бора: атомная система может находиться только в особых стационарных или квантовых состояниях, каждому из которых соответствует определенная энергия. В стационарных состояниях атом не излучает. Второй постулат: При переходе атома из одного стационарного состояния в другое, излучается или поглощается квант с энергией, равной разности энергий этих состояний.
поведение микрочастиц (в том числе и электронов) определяется двойственностью их природы (корпускулярно-волновой дуализм);Корпускулярно-волновой дуализм характеризует способность любого объекта проявлять одновременно волновые и материальные свойства. Двойственная природа микромира была впервые установлена для излучения. С одной стороны, для излучения характерны такие явления, как интерференция и дифракция, которые характери-характеризуют его волновую природу. С другой стороны, излучение проявляет свойства частиц, о чем свидетельствует явление фотоэффекта. Эйнштейн предположил, что излучение испускается в виде частиц, названных фотонами или квантами. Каждый фотон обладает энергией, определяемой Е = mс2.
Де
Бройль предположил, что двойственной
природой обладает не только свет, но и
любой мат. объект. Длина волны любого
движущегося объекта:
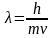 .
В случае наблюдения за объектами
микромира: воздействие на них фотона
(для определения координаты), ее скорость
меняется.
.
В случае наблюдения за объектами
микромира: воздействие на них фотона
(для определения координаты), ее скорость
меняется.
Принцип
Гейзенберга:
Невозможно одновременно точно определить
координаты частицы и ее импульс.
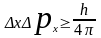 (аналогично y,
z).
Где дельты – погрешность определения
координат, погрешность определения
проекций импульса на оси координат. Для
волн Де Бройля:
(аналогично y,
z).
Где дельты – погрешность определения
координат, погрешность определения
проекций импульса на оси координат. Для
волн Де Бройля:
 ,
где вторая пси-амплитуда волн Де Бройля
(координатная волновая функция).
,
где вторая пси-амплитуда волн Де Бройля
(координатная волновая функция).
2.Квантовомеханическая теория строения атома. Уравнение Шредингера. Волновая функция. Радиальная и угловая составляющие. Квантовые числа. Атомные уровни, подуровни и орбитали. Формы s -, р -, d - атомных орбиталей.
В квантовой механике каждая АО характеризуется 3-мя квантовыми числами. Главное квантовое число n может принимать целочисленные значения от 1 до бесконечности. Оно определяет номер энергетического уровня, интервал энергий электронов, находящихся на данном уровне, размеры орбиталей, число подуровней данного энергетического уровня, в ПСЭ max значению n соответствует номер периода.(1-K, 2-L, 3-M, 4-N, 5-O)
Орбитальное квантовое число l определяет орбитальный момент количества движения (импульс) электрона, точное значение его энергии и форму орбиталей. Может принимать целочисленные значении от 0…n-1. Каждому численному значению l соответствует определенная геометрическая форма орбиталей и приписывается буквенное обозначение (s, p, d, f).(0-s, 1-p, 2-d, 3-f, 4-g)
Магнитное квантовое число m определяет возможные значения проекции орбитального момента количества движения электрона на фиксированное направление в пространстве. Принимает отрицательные и положительные значения l, включая 0. Общее число значений = 2l+1. От значения m зависит взаимодействие магнитного поля, создаваемого электроном, с внешним магнитным полем. В общем случае m характеризует ориентацию АО в пространстве относительно внешней силы. Общее число возможных значений m соотв. числу способов расположения орбиталей данного подуровня в пространстве, т.е. общему числу орбиталей на данном подуровне.
Законы движения частиц в квантовой механике выражаются уравнением Шредингера. Уравнение Шредингера представляет собой дифференциальное уравнение в частных производных. Э. Шредингер в 1926 г. предложил использовать волновое уравнение в качестве модели для описания поведения электрона в атоме – уравнение, связывающее энергию системы с ее волновым движением. Стационарное уравнение Шредингера для одной частицы можно записать в следующей форме:
- h2__ (2 + 2 + 2) + U = E
82m (x2 y2 z2 )
где U – потенциальная энергия частицы; E – ее полная энергия; x, y, z – декартовы координаты; переменная величина называется волновой функцией. Эта функция описывает все свойства системы в стационарном состоянии – состоянии, которое изменяется во времени. Функция зависит от координат частиц и может зависеть от времени. Каждая частица (или набор частиц) характеризуется квантово-механической волновой функцией, которая описывает состояние данной системы. Функцию можно рассматривать как амплитуду волнового процесса, следовательно, она может быть больше и меньше нуля, а также мнимой величиной. В соответствии с физическим смыслом волновая функция конечная, непрерывная и однозначная, а также обращается в ноль там, где частица не может находиться. Уравнение Шредингера можно решить точно только для очень простых систем (атом водорода).
Решая уравнение Шредингера в сферических координатах, получают nlml = R®rnlΘ(θ)lmlФ(φ)ml где R® - радиальная составляющая волновой функции; Θ(θ) и Ф(φ) – угловые составляющие волновой функции. Следовательно, волновые функции зависят от трех целочисленных параметров n, l, ml - , которые называют квантовыми числами. Волновую функцию описывающую состояние электрона, называют атомной орбиталью.
S-орбитали имеют форму сферы(характеризуются l=0, m=0), P-орбитали – гантели(объемные восьмерки) – l=1, m=-1,0,1. (3 АО, расположенных вдоль осей координат). d-подуровень – l=2, m=-2,-1,0,1,2. 5АО, dxy,dxz,dyz,dx*2-y*2, dz*2.( 4 из 5 орбиталей имеют форму четырехлепестковых розеток, каждая из кот образована двумя гантелями, 5 ао предстваляет собой гантель с тором в экваториальной плоскости).
Собственный момент импульса электрона – спин. Может принимать только значение = ½. Проекция вектора спина на опред. направление внешнего поля наз. спиновым квантовым числом, ms=+-1/2. Спин – проявление релятивистских эффектов на микроскопическом уровне.
Совокупность состояний электрона в атоме с одним и тем же значением n называют энергетическим уровнем. Число уровней, на которых находятся электроны в основном состоянии атома, совпадает с номером периода, в котором располагается элемент. Энергетический подуровень - совокупность энергетических состояний электрона в атоме, характеризующихся одними и теми же значениями квантовых чисел n и l. Подуровни обозначают буквами: s, p, d, f... Совокупность главного, орбитального и магнитного квантовых чисел - атомную орбиталь.
3. Строение многоэлектронных атомов. Принцип наименьшей энергии. Принцип Паули. Правило Хунда. Правило Клечковского. Электронные и электронно-графические формулы атомов в основном и возбужденном состояниях. Строение многоэлектронных атомов: число электронов, которые могут находиться на одном энергетическом уровне, равно 2*n^2, где n-номер уровня. В многоэлектронных атомах энергия электронов одного уровня неодинакова, электроны заполняют атомные орбитали разных видов и имеют разную энергию. Каждый энергетический уровень расщепляется на такое число энергетических подуровней, сколько видов орбиталей включает этот уровень:2 уровень-2 подуровня(2s и 2p), 3 уровень-3 подуровня(3s, 3p, 3d) и т.д. Принцип наименьшей энергии: многоэлектронная система заполняется электронами так, чтобы её энергия была минимальной(определяет порядок заполнения электронами атомных орбиталей). Принцип Паули: в любой многоэлектронной системе не может быть двух электронов, для которых были бы одинаковы все значения 4-х квантовых чисел. Следствия из принципа Паули: максимальное число электронов на атомной орбитали равно 2; максимальное число электронов на подуровне равно 2(2l+1). Правило Хунда: в данном подуровне(l=const.) электроны стремятся расположиться так, чтобы суммарное спиновое квантовое число было максимальным( max число неспаренных электронов). Правило Клечковского: атомная орбиталь заполняется электронами в порядке увеличения суммы (n+l); если для 2-х атомов эта сумма оказывается одинаковой, то сначала электронами заполняется та атомная орбиталь, для которой n меньше: 1s2s2p3s3p4s3d4p5s...

4. Периодический закон Менделеева. Основные энергетические характеристики атома: энергия ионизации, сродство к электрону. Электроотрицательность. Закономерности их изменения по периодам и группам периодической таблицы. Периодический закон Менделеева: св-ва химических элементов, а также форма и св-ва образуемых ими соединений находятся в периодической зависимости от величины заряда ядер их атомов.
В периодической таблице элементы располагаются в порядке возрастания заряда ядра их атомов. Всего 7 периодов, 8 главных и 8 побочных подгрупп. С увеличением заряда ядра атомов наблюдается постепенное изменение свойств от металлических к неметаллическим, что связано с увеличением числа электронов на внешнем уровне.
Энергия ионизации- энергия, необходимая для полного удаления электрона из атома, не придавая ему кинетической энергии(чем она меньше, тем больше восстановительная способность атома) единица измерения-кдж/моль.
Сродство к электрону- энергия, которая выделяется или поглощается при присоединении электрона к нейтральному атому с образованием отрицательно заряженного иона. Единица измерения-кдж/моль.
Электроотрицательность - условная величина, характеризующая способность атома в молекуле или сложном ионе притягивать к себе электроны, участвующие в образовании химической связи(полезна для объяснения типа химической связи и св-ва соединения) Закономерности изменения энергетических характеристик атома: увеличиваются в периодах, уменьшаются в подгруппах.
5. Химическая связь – совокупность взаимодействий атомов, приводящая к образованию устойчивых систем (молекул, комплексов, кристаллов и др.). Химическая связь возникает в том случае, если в результате перекрывания электронных облаков происходит уменьшение полной энергии системы.
Основные характеристики химической связи.
Длина связи – это расстояние между центрами (ядрами) химически связанных атомов. Чем больше длина связи, тем частица менее прочная. [l]=[нм] или [ангстрем(10^(-10)м)]
Энергия связи – энергия, затрачивающаяся на разрыв химической связи. Эта величина служит мерой прочности химической связи. [Есв.]=[кДж/моль]
Энергия и длина связей зависят от характера распределения электронной плотности между атомами.
Кратность связи – число электронных пар, обобществленных двумя соседними атомами молекулы в результате ковалентной химической связи. Если Ксв<=0, то такой частицы не существует. Чем выше кратность связи, тем частица более устойчива. Кратность связи равна полуразнице числа электронов на связывающих орбиталях и на разрыхляющих.
Валентный угол – угол между воображаемыми линиями, которые можно провести через центры связанных атомов.
Виды химических связей: ковалентная, ионная, металлическая.
Ионная связь – предельный случай ковалентной полярной химической связи (модуль разности электроотрицательности элементов >1.9). Вследствие поляризации связи такие соединения в кристаллическом состоянии представляют собой упорядоченное расположение отрицательно и положительно заряженных ионов. Чисто ионных соединений нет. Полное разделение заряда не может осуществиться из-за волновых свойств электрона (вероятность нахождения электрона возле ядра может быть мала, но отлична от нуля).
Металлическая связь – это связь между положительными ионами в кристаллах металлов. Она осуществляется за счет притяжения электронов, свободно перемещающихся по кристаллу. Атомы металлов имеют небольшое число валентных электронов. Они достаточно слабо связаны со своими ядрами и легко от них отрываются. В результате в кристаллической решетке появляются положительно заряженные ионы и свободные электроны. В кристаллической решетке металлов существует большая свобода перемещений электронов: одни атомы теряют свои электроны, а образующиеся ионы могут принимать их из “электронного газа”. В этом состоит отличие металлических связей от ковалентных, которые строго ориентированы в пространстве. Ее энергия ниже энергии ковалентной связи.
Межмолекулярные взаимодействия.
Между молекулами, валентно насыщенными в обычном понимании, на расстоянии, превышающем размеры частиц, могут проявляться электростатические силы межмолекулярного притяжения (силы Ван-дер-Ваальса) – это дальнодействующие силы.
На близких расстояниях между молекулами заметны близкодействующие силы отталкивания.
Существует ориентационное взаимодействие, которое проявляется между полярными молекулами, которые при приближение поворачиваются друг к другу разноименными полюсами, чтобы Еп стала минимальной.
Индукционное взаимодействие. Если неполярную молекулу поместить в электрическое поле, то электрический центр тяжести смещается. Происходит деформация неполярной молекулы и индуцируется диполь. Взаимодействие понижает потенциальную энергию системы.
Дисперсионное взаимодействие возникает у любых молекул. Из-за мгновенного несовпадения центров тяжести зарядов электронных облаков и ядер образуется мгновенный диполь, которые индуцирует мгновенные диполи в других частицах. В результате соседние частицы испытывают мгновенное притяжение и Еп системы понижается.
Водородная связь имеет промежуточный характер между валентным и межмолекулярным взаимодействием. Характерна для жидкостей, в состав молекул которых входит положительно поляризованный атом водорода. Малые размеры и отсутствие внутренних электронов позволяют атому водорода вступать в дополнительное взаимодействие с ковалентно с ним не связанным отрицательно поляризованным атомом другой (или той же) молекулы. Пример связи: лед, HF.
6. Ковалентная связь. Механизм ее образования: обменный и донорно-акцепторный. Метод валентных связей. Гибридизация атомных орбиталей, виды гибритизации. Геометрическая конфигурация молекул. Свойства ковалентной связи: напрвленность, насыщаемость, полярность. Электрический момент связи и молекулы.
Ковалентаная связь-тип хим связи, характеризующийся образованием электронной пары для связывающихся атомов.
Обменный механизм. К нему относят те случаи образования химической связи, когда каждый из двух связываемых атомов выделяет для обобществления по одному электрону, как бы обмениваясь ими. Для связывания ядер двух атомов нужно, чтобы электроны находились в пространстве между ядрами. Эта область в молекуле называется областью связывания. Донорно-акцепторный механизм связан с передачей неподеленной пары электронов от одного атома на вакантную атомную орбиталь другого атома.
МВС- 1 каждая пара атомов в молекуле удерживается вместе при помощи одной или нескольких общих электронных пар; 2 одинарная ковалентная связь образуется двумя электронами с антипараллельными спинами, расположенными на валентных орбиталях связывающихся атомов; 3 при образовании связи происходит перекрывание волновых функций электронов, ведущее к увеличению электронной плотности между атомами и уменьшению общей энергии системы; 4 связь образуется в том направлении, при котором возможно максимальное перекрывание волновых функций; 5 угол между связями в молекуле соответствует углу между образующими связи электронными облаками; 6 из двух орбиталей атома более прочную связь образует та, которая сильнее перекрывается орбиталью другого атома.
Гибритизация- выравнивание по форме и размеру атомных орбиталей. Основные положения: в результате образования гибридные орбитали направлены в сторону образующейся связи; го ориентированы на то, чтобы обеспечить макс взаимное удаление друг от друга; го учавствует в образовании только сигма связи.
Геометрическая форма молекул: sp,dp-прямая sp2,dp2,sd2-треугольник pd2- тригональная пирамида sp3,sd3- тетраэдр sp3d2- октаэдр.
Полярность КС. В молекулах, содержащих ядра атомов одного и того же элемента, одна или несколько пар электронов в равной мере принадлежат обоим атомам, каждое ядро атома с одинаковой силой притягивает пару связывающих электронов. Такая связь называется неполярной ковалентной связью.Если пара электронов, образующих химическую связь, смещена к одному из ядер атомов, то связь называют полярной ковалентной связью.
Насыщаемость КС — это способность атома участвовать только в определенном числе КС, насыщаемость характеризует валентностью атома. Количественные меры валентности явл. число не спаренных электронов у атома в основном и в возбужденном состоянии.
Направленность КС. Наиболее прочные КС образуются в направлении максимального перекрывания атомных орбиталей, т.е. мерой направленности служит валентный угол.
Дипольный момент связи (m) - векторная величина, характеризующая полярность связи. Длина вектора равна произведению длины связи l на эффективный заряд q, который приобретают атомы при смещении электронной плотности: | m | = lЧ q. Вектор дипольного момента направлен от положительного заряда к отрицательному. При векторном сложении дипольных моментов всех связей получают дипольный момент молекулы.
7. Ковалентная связь. Метод молекулярных орбиталей. Связывающие и разрыхляющие молекулярные орбитали. Энергетические диаграммы гомоядерных двухатомных молекул. Порядок (кратность) связи. Магнитные свойства молекул (рассмотреть на примерах).
Ковалентаная связь-тип хим связи, характеризующийся образованием электронной пары для связывающихся атомов.
Метод основан на следующих принципах:1 молекула рассматривается как единое целое, каждый электрон принадлежит молекуле в целом и движется в поле всех ее ядер и электронов; 2 состояние i-го электрона описывается одноэлектронной волновой функцией Ψi, характеризуемой определенным набором квантовых чисел; 3 функция Ψi. называемая молекулярной орбиталью, в отличие от атомной орбитали является многоцентровой и делокализованной; 4 квадрат модуля волновой функции ׀Ψ׀i2 , как и для электрона в атоме, определяет плотность электронного облака; 5 полное описание состояния электрона характеризует молекулярная спин-орбиталь, выражаемая произведением МО и спиновой функции ΨS; 6 каждой МО соответствует определенная энергия, которая слагается из кинетической энергии электрона, потенциальной энергии притяжения электрона ко всем ядрам и усредненной потенциальной энергии отталкивания данного электрона от всех остальных электронов; 7 совокупность МО, называемая электронной конфигурацией молекулы, строится на основе фундаментальных положений квантовой механики: принципа наименьше энергии, принципа Паули, правила Хунда; 8 движение электронов взаимно независимое, и общая волновая функция основного состояния молекулы задается как произведение одноэлектронных волновых функций Ψ=П Ψ; 9 образование МО упрощенно рассматривается как линейная комбинация атомных орбиталей.
При сложении волновых функций двух валентных электронов атомные орбитали разных атомов (А и В), имеющих близкие значения энергии, электронная плотность между ядрами атомов увеличивается (под действием сил притяжения положительно заряженных атомных ядер). Это ведет к образованию связывающей молекулярной орбитали, имеющей более низкое значение энергии, чем исходные атомные орбитали: Ψ = а ΨА+ b ΨВ, где Ψ –симметричная волновая функция связывающей молекулярной орбитали; ΨА и ΨВ–волновые функции атомных орбиталей атомов А и В соответственно; а и b – коэффициенты, учитывающие вклад соответствующих атомных орбиталей в образование МО, при этом а= b, если А и В – атомы одного элемента, и bа, если электроотрицательность атома В выше.
При вычитании волновых функций (имеют разные знаки) двух валентных атомных орбиталей разных атомов, имеющих близкие значения энергии, электронная плотность между ядрами атомов уменьшается , что ведет к образованию разрыхляющей молекулярной орбитали (химическая связь не образуется), имеющей более высокое значение энергии, чем исходных атомных орбиталей: Ψ* = а ΨА- b ΨВ, здесь Ψ* - антисимметричная волновая функция разрыхляющей молекулярной орбитали.
Показателем прочности молекулы может служить порядок связи , который определяется разностью чисел электронов, находящихся на связывающей молекулярной орбитали и электронов, находящихся на разрыхляющей молекулярной орбитали: ПС =(nе(СМО) – nе(РМО))⁄2, где nе(СМО) – число электронов на связывающих МО; nе(РМО) - число электронов на разрыхляющих МО. По существу. Порядок связи – другая форма понятия валентности. (энергетическая диаграмма для Н2)
Характер распределения электронов по молекулярным орбиталям позволяет объяснить магнитные свойства частиц. Молекулы, суммарный спин которых равен нулю, проявляют диамагнитные свойства, т.е. во внешнем магнитном поле их собственные магнитные моменты ориентируются против направления поля. Молекулы, суммарный спин которых отличен от нуля, проявляют парамагнитные свойства, т.е. во внешнем магнитном поле их собственные магнитные моменты ориентируются в направлении поля. Таким образом молекула Н2 диамагнитна.
Вопрос №8
Кристаллы. Элементарные кубические ячейки и их характеристики. Расчет эффективных радиусов атома для разных кубических решеток. Виды связи в кристаллах. Атомные, молекулярные, ионные и металлические кристаллы.
Ответ:
Кристаллическая решетка – трехмерное упорядоченное геометрическое распределение в пространстве точек, называемых узлами.
Элементарная кубическая ячейка – это мысленно выделенная часть кристаллической решетки, включающая все элементы симметрии данного кристалла, параллельная трансляция которой во всех направлениях создает тело кристалла.
Ее характеристики:
Кратчайшее расстояние между частицами, образующими данный тип элементарной ячейки;
Координационное число К – число одинаковых частиц, расположенных на кратчайшем расстоянии от данной частицы(число ближайших соседей);
Число частиц n, необходимое для построения элементарной ячейки;
Тип кристаллической решетки
Эффективный радиус
Для его расчета следует определить L (кратчайшее расстояние между частицами )
Эффективный радиус =L/2
Виды связи в кристаллах
Ковалентная связь
Нейтральные атомы размещены в узлах кристаллической решётки. Связь образуется направленными валентными электронными облаками.
Ионная связь
В узлах кристаллической решётки помещаются положительно и отрицательно заряженные ионы. Силы взаимодействия между узлами являются в основном электростатическими.
Металлическая связь
Особый тип связи, характерный для металлов и металлидов. Во всех узлах кристаллической решётки расположены положительные ионы металла. Между ними беспорядочно, подобно молекулам газа, движутся валентные электроны, отщепившиеся от атомов при образовании ионов. Эти электроны играют роль цемента, удерживая вместе положительные ионы; в противном случае решётка распалась бы под действием сил отталкивания между ионами. Вместе с тем и электроны удерживаются ионами в пределах кристаллической решётки и не могут её покинуть.
Молекулярная связь
В узлах кристаллической решётки помещаются определённым образом ориентированные молекулы. Силы связи между молекулами в кристалле равны силе межмолекулярного (и межатомного) взаимодействия с энергией 10—20 кДж/моль.
Водородная связь
Особая разновидность молекулярной связи — водородная связь. При определённых условиях атом водорода может быть связан довольно прочно с двумя другими атомами. Имея лишь одну стабильную орбиталь, атом водорода способен образовывать только одну ковалентную связь. Эта связь может, однако, резонировать между двумя положениями. Наибольшее значение имеют те водородные связи, которые образуются между двумя сильно электроотрицательными атомами, в особенности между атомами азота, кислорода и фтора.
Атомные кристаллы
В узлах находятся атомы одинаковых или различных элементов, осуществляющих направленные ковалентные связи, количество которых определяется валентными возможностями атомов. Высокая температура плавления, высокая твердость, электро- и теплопроводность невелика.
Молекулярные кристаллы
В узлах расположены молекулы, связанные между собой слабыми межмолекулярными силами. Характерны низкие температуры плавления, летучесть, невысокая твердость.
Ионные кристаллы
Построены из катионов и анионов, между которыми действует электростатические силы притяжения. Строение таких кристаллов определяется соотношением радиусов ионов и принципом электронейтральности кристалла. Высокая температура плавления, большая твердость, высокая хрупкость.
Металлические кристаллы
Атомы удерживаются металлической связью, которая определяет построение решетки по принципу плотной упаковки. Высокая тепло- и электропроводность, пластичность металлов.
9. Положение металлов в периодической системе элементов.
Большую часть известных химических элементов образуют именно металлы. К металлам относятся в элементы побочных (Б) подгрупп, а также элементы главных подгрупп, расположенные ниже диагонали “бериллий – астат”. Кроме того, металлы образуют группы лантаноидов и актиноидов.
Типы кристаллических решеток.
Различают 4 типа кристаллических решеток:
Атомно-ковалентная. В узлах решетки находятся нейтральные атомы, соединенные прочными ковалентными связями. Они инертные, обладают высокой температурой плавления и кипения, у них высокая плотность.
Молекулярная. В узлах решетки – молекулы, связанные слабыми межмолекулярными силами. Характеризуются высокими значениями координационных чисел. У них низкая температура плавления и кипения, низкая механическая прочность, высокая летучесть. Примеры таких соединений: кислород, озон, азот, углекислый газ, фенол.
Ионная. В узлах решетки – положительно и отрицательно заряженные ионы (анионы и катионы), между которыми действуют электростатические силы притяжения. У них высокая температура плавления и кипения, низкая летучесть и высокая твердость.
Металлические. В узлах атомы и катионы металлов, а внутри элементарной ячейки – валентные электроны проводимости. Характеризуются высокой тепло- и электропроводностью.
Природные соединения металлов.
Природные химические соединения металлов – это минералы. Вследствие высокой активности большинство металлов встречается в виде положительных ионов или положительных соединений с ковалентной полярной связью. Минерал, содержащие металл в количествах, пригодных для применения в промышленности, называется рудой.
Методы получения металлов.
Гидрометаллургический – вытеснение металла из раствора более активным металлом. СuSO4+Fe=Cu+FeSO4
Пирометаллургический – восстановление металла из его оксида при высокой температуре. Это осуществляется с помощью углерода, угарного газа или водорода. Сu2O+C=2Cu+CO
Металлотермический – вытеснение металла из его соединения более активным металлом. TiCl4+2Mg=2MgCl2+Ti
Электрометаллургический – восстановление металлов в процессе электролиза растворов и расплавов солей. 2NaCl=2Na+Cl2
Общие физические и химические свойства металлов.
Физические свойства: пластичность (Au, Ag, Cu); теплопроводность (Fe, Al); электропроводность (Ag, Cu); металлический блеск (Al, Ag, Pd); твердость, кроме ртути (Cr).
Химические свойства.
Взаимодействие с элементарными окислителями:
2Zn+O2=2ZnO; 4Li+O2=2Li2O; 2Fe+3Cl2=2FeCl3
Взаимодействие с водой:
Потенциал водорода равен -0,413В, поэтому с водой взаимодействуют те металлы, потенциал которых меньше -0,413В.
2Na+2H2O=2NaOH+H2; 3Fe+4H2O=Fe3O4+4H2; Cu+H2O (реакция не идет)
Взаимодействие с кислотами-неокислителями (HCl, H2SO4(р)):
Для взаимодействия потенциал металла должен быть меньше 0 В.
Fe+HCl-FeCl2+H2; Cu+H2SO4(p) (реакция не идет)
Взаимодействие с кислотами-окислителями.
Взаимодействие с кислотами окислителями приводит к образованию соли металла в его наивысшей степени окисления, водород при этом не образуется
Cu+H2SO4(к)=CuSO4+SO2+H2O; Zn+H2SO4(к)=ZnSO4+H2O+H2S
Взаимодействие со щелочами:
Взаимодействуют те металлы, гидроксиды которых проявляют амфотерные свойства (Al, Cr, Zn, Pb)
2Al+2KOH+6H2O=2K[Al(OH)4]+3H2
10.

11. Жесткость воды. Виды жесткости. Единицы измерения жесткости. Методы устранения жесткости воды.
• Жёсткость воды — совокупность химических и физических свойств воды, связанных с содержанием в ней растворённых солей щёлочноземельных металлов, главным образом, кальция и магния.
• Виды жесткости:
Различают жёсткость общую, карбонатную (временную, или устранимую) и некарбонатную (постоянную, или неустранимую).
Выделяют следующие типы жесткости воды: - временная – карбонатная жесткость, обусловлена присутствием на ряду с кальцием Ca2+ и магнием Mg2+ гидрокарбонатных анионов HCO3- - постоянная – некарбонатная жесткость, характеризуется присутствием сульфатных SO42, нитратных NO3- и хлоридных анионов Cl-, соли кальция и магния которых прекрасно растворяются в воде; - общая жесткость определяется как суммарная величина наличия солей магния и кальция в воде, то есть суммой карбонатной и некарбонатной жесткости.
• Единицы измерения жесткости:
Жесткость воды принято исчислять суммой миллимолей ионов кальция и магния на 1 литр воды (ммоль/л). 1 ммоль/л соответствует количеству любого вещества в мг/л, равному его молекулярной массе, разделенной на валентность. Величина 1 ммоль/л говорит о содержании в 1 литре воды 20,04 мг/л кальция либо 12,1 мг/л магния. Для удобства пользуются величиной мг-экв/л, которая соответствует моль/м3.
• Методы устранения жёсткости воды:
Временная жесткость устраняется:
а) нагреванием до температуры 70-80 °С, при этом катионы Са2+ и Mg2+ в виде карбонатов выпадают в осадок:
Ca(HCO3)2 → СаСО3↓ + Н2О + CO2
Mg(HCO3)2 → MgC03↓ + Н2О + CO2
В результате частичного гидролиза карбоната магния образуется гидроксокарбонат магния:
2MgCO3 + H2O → (MgOH)2C03↓ + CO2
б) известкованием — добавлением негашеной СаО или гашеной Са(ОН)2 извести:
Са(НСО3)2 + СаО → 2СаСО3↓ + Н2О
Са(НСО3)2 + Са(ОН)2 → 2СаСО3↓ + 2Н2О
Постоянную жесткость устраняют переводом сульфатов и галогенидов кальция и магния в практически нерастворимые карбонаты или фосфаты с их последующей фильтрацией:
CaSO4 + Na2CO3 → CaCO3↓ + Na2SO4
3CaSO4 + 2Nа3РO4 → Са3(РO4)2↓ + 3Na2SO4
Для одновременного устранения карбонатной и некарбонатной жесткости, т. е. общей жесткости, в промышленности применяют различные методы, из которых наибольшее распространение получили химический (добавление химических реагентов, например, обработка воды смесью СаО и Na2CO3 при нагревании) и физико-химический (пропускание воды через ионообменные смолы).
Наиболее совершенным методом очистки воды, при котором в ней вообще не остаётся минеральных солей, является катионный и анионный обмен на полимерных смолах.
№12
d-Металлы. Положение d-металлов в периодической таблице. Зависимость изменения физических свойств d-металлов от их электронного строения. Общие химические свойства d-металлов. Взаимодействие с кислородом, водой, кислотами и щелочами. Зависимость кислотно-основных и окислительно-восстановительных свойств соединений d-металлов от степени окисления d-металлов. Понятие о металлообразных соединениях, их применение.
d-металлы – группа атомов в периодической таблице элементов, в электронной оболочке которых валентные электроны с наивысшей энергией занимают d-орбиталь.
Данные элементы располагаются с 3 по 12 группу.
Свойства
1. d- элементы в кристаллическом состоянии обладают не чисто металлической связью, а ковалентно-металлической. Поэтому все они твердые(кроме Hg) и тугоплавкие (за исключением Zn, Cd) металлы.
2. Вследствие незаполненности d-оболочек и наличия близких по энергии незаполненных ns- и np-уровней, d-элементы склонны к комплексообразованию; их комплексные соединения, как правило, окрашены и парамагнитны.
3. d-Элементы чаще, чем элементы главных подгрупп, образуют соединения переменного состава (оксиды, гидриды, карбиды, силициды, нитриды, бориды). Кроме того, они образуют сплавы между собой и с другими металлами, а также интерметаллические соединения.
4. Для d-элементов характерен большой набор валентных состояний и, как следствие этого, изменение кислотно-основных и окислительно-восстановительных свойств в широких пределах.
5. Как известно, восстановительная способность металла определяется не только его энергией ионизации (М – ne – → М n +; +∆H иониз), но и энтальпией гидратации образовавшегося катиона (М n + + mH 2O → М n +·mH 2O; –∆H гидр). Энергии ионизации d-элементов в сравнении с другими металлами велики, но они компенсируются большими энтальпиями гидратации их ионов. Вследствие этого электродные потенциалы большинства d-элементов отрицательны.
6. На кислотно-основные свойства гидроксидов d-элементов влияют те же факторы (величина ионного радиуса и заряд иона), что и на гидроксиды p-элементов.
Гидроксиды низших степеней окисления d-элементов обычно проявляют основные свойства, а отвечающие высшим степеням окисления – кислотные. В промежуточных степенях окисления гидроксиды амфотерны.
В пределах одной подгруппы гидроксиды d-элементов одинаковой степени окисления характеризуются увеличением основных свойств при движении сверху вниз. Например, в IIIВ группе Sc(OH) 3 – слабое, а La(OH) 3 – сильное основание. Элементы IVВ группы Ti, Zn, Hf образуют амфотерные гидроксиды Э(OH) 4, но кислотные свойства их ослабевают при переходе от Ti к Hf.
Соединения низшей степени окисления образуют молекулы или кристаллы ионного типа с большой степенью ионности.
В химических реакциях соединения низшей степени окисления обычно проявляют восстановительные свойства, за исключением непрочных соединений «благородных» металлов, вызывающих реакции окисления, что используется, например, в серебряно-цинковых аккумуляторах.
Их называют металлообразными соединениями.
Металлообразные соединения растворяются в металлах, образуя главным образом жидкие растворы, распадающиеся в процессе кристаллизации.
13. Элементы- бор,алюминий,галий,индий, талий. Свойства: Бор-металл,все остальные амфотерные. На свойства p-элемнтов влияет d-сжатие, так от галия к талию радиус атома увеличивается, плотность увеличивается, а температура плавления понижается. В чистом виде обычно не встречаются. Имеют высокую тепло и электро-проводность, за исключением бора. Бор. Получение: разложением бората в серной кислоте получают борную кислоту,после кислоту восстанавливают металлическим магнием и получают бор в виде порошка. Свойства:Химически Бор при обычных условиях довольно инертен (взаимодействует активно лишь с фтором), причем кристаллический Бор менее активен, чем аморфный. С повышением температуры активность Бора возрастает и он соединяется с кислородом, серой, галогенами. При нагревании на воздухе до 700°С Бор горит красноватым пламенем, образуя борный ангидрид B2O3 - бесцветную стекловидную массу. При нагревании выше 900 °С Бор с азотом образует нитрид бора BN, при нагревании с углем -карбид бора B4C3, с металлами - бориды. С водородом Бор заметно не реагирует; его гидриды (бороводороды) получают косвенным путем. При температуре красного каления Бор взаимодействует с водяным паром: 2B + 3Н2О = B2O3 + 3H2. В кислотах Бор при обычной температуре не растворяется, кроме концентрированной азотной кислоты, которая окисляет его до борной кислоты H3BO3. Медленно растворяется в концентрированных растворах щелочей с образованием боратов. Во фториде BF3 и других галогенидах Бор связан с галогенами тремя ковалентными связями. Поскольку для завершения устойчивой 8-электронной оболочки атому Бора в галогениде BX3 недостает пары электронов, молекулы галогенидов, особенно BF3, присоединяют молекулы других веществ, имеющие свободные электронные пары, например аммиака. В таких комплексных соединениях атом Бор окружен четырьмя атомами (или группами атомов), что соответствует характерному для Бора в его соединениях координационному числу 4. Важные комплексные соединения Бор - борогидриды, например Na[BH4], и фтороборная, или борофтористоводородная, кислота H [BF4], образующаяся из BF3 и HF; большинство солей этой кислоты (фтороборатов) растворимы в воде (за исключением солей К, Rb, Cs). Общая особенность самого Бора и его соединений - их сходство с кремнием и его соединениями. Так, борная кислота, подобно кремниевой, обладает слабыми кислотными свойствами и растворяется в HF с образованием газообразного BF3 (кремниевая дает SiF4). Бороводороды напоминают кремневодороды, а карбид Бора - карбид кремния, и т. д. Представляет интерес особое сходство модификаций нитрида BN с графитом или алмазом. Это связано с тем, что атомы В и N по электронной конфигурации совместно имитируют 2 атома С (у В - 3 валентных электрона, у N - 5, у двух атомов С - по 4). Эта аналогия характерна и для других соединений, содержащих одновременно Бор и азот. Так, боразан ВН3-NH3 подобен этану СН3-СН3, а боразен BH2=NH2 и простейший боразин BH≡NH подобны соответственно этилену СН2=СН2 и ацетилену СН≡СН. Если тримеризация ацетилена С2Н2 дает бензол С6Н6, то аналогичный процесс приводит от боразина BHNH к боразолу B3N3H6.
Алюминий. Получение В промышленности Алюминий получают электролизом глинозема Аl2О3, растворенного в расплавленном криолите NasAlF6 при температуре около 950° С Свойства Алюминий - самый рас пространенный металл на Земле (3-е место среди всех элемен тов; 8% состава земной коры). В виде свободного металла в при роде не встречается; входит в состав глиноземов (Аl2О3), бокситов (Аl2О3 • xН2О). Кроме того, алюминий обнаруживается в виде силикатов в таких породах, как глины, слюды и полевые шпаты.Внешняя электронная оболочка атома Алюминия состоит из 3 электронов и имеет строение 3s23р1. В обычных условиях Алюминий в соединениях 3-валентен, но при высоких температурах может быть одновалентным, образуя так называемых субсоединения. Субгалогениды Алюминия, AlF и АlСl, устойчивые лишь в газообразном состоянии, в вакууме или в инертной атмосфере, при понижении температуры распадаются (диспропорционируют) на чистый Аl и AlF3 или АlСl3 и поэтому могут быть использованы для получения сверхчистого Алюминия. При накаливании мелкоизмельченный или порошкообразный Алюминий энергично сгорает на воздухе. Сжиганием Алюминия в токе кислорода достигается температура выше 3000°С. Свойством Алюминия активно взаимодействовать с кислородом пользуются для восстановления металлов из их оксидов (Алюминотермия). При темно-красном калении фтор энергично взаимодействует с Алюминием, образуя AlF3. Хлор и жидкий бром реагируют с Алюминием при комнатной температуре, иод - при нагревании. При высокой температуре Алюминий соединяется с азотом, углеродом и серой, образуя соответственно нитрид AlN, карбид Al4C3 и сульфид Al2S3. С водородом Алюминий не взаимодействует; гидрид Алюминия (AlН3)X получен косвенным путем. Большой интерес представляют двойные гидриды Алюминия и элементов I и II групп периодической системы состава МеНn·nAlH3, так называемые алюмогидриды. Алюминий легко растворяется в щелочах, выделяя водород и образуя алюминаты. Большинство солей Алюминия хорошо растворимо в воде. Растворы солей Алюминия вследствие гидролиза показывают кислую реакцию. Применение В электротехнике Алюминий успешно заменяет медь, особенно в производстве массивных проводников, например, в воздушных линиях, высоковольтных кабелях, шинах распределительных устройств. В металлургии Алюминий (помимо сплавов на его основе)- одна из самых распространенных легирующих добавок в сплавах на основе Сu, Mg, Ti, Ni, Zn и Fe. Применяют Алюминий также для раскисления стали перед заливкой ее в форму, а также в процессах получения некоторых металлов методом алюминотермии. Бор в небольших количествах (доли%) вводят в сталь и некоторые сплавы для улучшения их механических свойств; уже присадка к стали 0,001-0,003% Бор повышает ее прочность.Бор в виде газообразного BF3 используют в счетчиках нейтронов.
 14.
а) Углерод
(С), кремний (Si), германий (Ge), олово (Sn),
свинец (РЬ) — элементы 4 группы главной
подгруппы ПСЭ. На внешнем электронном
слое атомы этих элементов имеют 4
электрона: ns2np2.
В подгруппе с ростом порядкового номера
элемента увеличивается атомный радиус,
неметаллические свойства ослабевают,
а металлические усиливаются: углерод
и кремний - неметаллы, германий, олово,
свинец — металлы. б) Элементы этой
подгруппы проявляют как положительную,
так и отрицательную степени окисления:
—4, +2, +4. в) Высшие оксиды углерода и
кремния (С02,
Si02)
обладают кислотными свойствами, оксиды
остальных элементов подгруппы - амфотерны
(Ge02,
Sn02,
Pb02).
г) Угольная и кремниевая кислоты (Н2СО3,
H2SiO3)
— слабые кислоты. Гидроксиды германия,
олова и свинца амфотерны, проявляют
слабые кислотные и основные свойства:
H2GeO3=
Ge(OH)4,
H2SnO3 =
Sn(ОН)4,
Н2РЬО3 =
Pb(OH)4.
д) Водородные соединения: СН4;
SiH4,
GeH4.
SnH4,
PbH4.
Метан — CH4 —
прочное соединение, силан SiH4 -
менее прочное соединение. Схемы
строения атомов углерода и кремния,
общие и отличительные свойства. С
lS22S22p2;
Si 1S22S22P63S23p2.
Углерод и кремний - это неметаллы,
так как на внешнем электронном слое 4
электрона. Но так как кремний имеет
больший радиус атома, то для него более
характерна способность отдавать
электроны, чем для углерода. Углерод —
восстановитель:
14.
а) Углерод
(С), кремний (Si), германий (Ge), олово (Sn),
свинец (РЬ) — элементы 4 группы главной
подгруппы ПСЭ. На внешнем электронном
слое атомы этих элементов имеют 4
электрона: ns2np2.
В подгруппе с ростом порядкового номера
элемента увеличивается атомный радиус,
неметаллические свойства ослабевают,
а металлические усиливаются: углерод
и кремний - неметаллы, германий, олово,
свинец — металлы. б) Элементы этой
подгруппы проявляют как положительную,
так и отрицательную степени окисления:
—4, +2, +4. в) Высшие оксиды углерода и
кремния (С02,
Si02)
обладают кислотными свойствами, оксиды
остальных элементов подгруппы - амфотерны
(Ge02,
Sn02,
Pb02).
г) Угольная и кремниевая кислоты (Н2СО3,
H2SiO3)
— слабые кислоты. Гидроксиды германия,
олова и свинца амфотерны, проявляют
слабые кислотные и основные свойства:
H2GeO3=
Ge(OH)4,
H2SnO3 =
Sn(ОН)4,
Н2РЬО3 =
Pb(OH)4.
д) Водородные соединения: СН4;
SiH4,
GeH4.
SnH4,
PbH4.
Метан — CH4 —
прочное соединение, силан SiH4 -
менее прочное соединение. Схемы
строения атомов углерода и кремния,
общие и отличительные свойства. С
lS22S22p2;
Si 1S22S22P63S23p2.
Углерод и кремний - это неметаллы,
так как на внешнем электронном слое 4
электрона. Но так как кремний имеет
больший радиус атома, то для него более
характерна способность отдавать
электроны, чем для углерода. Углерод —
восстановитель:
Олово Sn - серебристо-белый, блестящий металл, медленно тускнеющий на воздухе. Образующаяся пленка устойчива и длительное время сохраняет свои характеристики. Олово полиморфно. Обычная β-модифи-кация (белое олово) устойчива выше 13,2 °С. Ниже этой температуры β-модификация переходит в α-модификацию (серое олово). Этот процесс ускоряется при дальнейшем понижении температуры или «заражении» белого олова частицами серого олова (оловянная чума). Олово - весьма мягкий и пластичный металл, стойкий к большинству внешних воздействий. Олово - легкоплавкий металл (т. пл. 231,9 °С), который входит в состав различных припоев. Для улучшения технологических свойств, в том числе и повышения твердости, в олово вводят свинец, висмут, сурьму. Из таких сплавов изготовлены многие изделия.
Свинец Pb — мягкий, ковкий и пластичный металл серого цвета с синеватым оттенком на свежем разрезе, который на воздухе быстро тускнеет. Свинец - самый мягкий среди обычных тяжелых металлов, значительно более мягкий чем олово. Высокая мягкость (царапается ногтем) требует осторожности при реставрации экспонатов из свинца. В разбавленных кислотах свинец практически нерастворим. В некоторых случаях в кислотах на поверхности свинца образуется нерастворимое покрытие, защищающее металл от дальнейшего действия кислоты. Так серной кислоте образуется нерастворимый сульфат, в соляной кислоте — труднорастворимый хлорид. Хорошо растворяется свинец в азотной кислоте, обладающей окислительным действием. Сравнительно легко свинец растворяется в уксусной кислоте (при наличии в ней растворенного воздуха) или в ее парах. По этой причине в витринах, где выставлены экспонаты из свинца, не допускается присутствия поливинилацетатных клеев, покрытий, так как при фотоокислительной деструкции ПВА возможно образование ацетат-ионов, вызывающих коррозию свинца.
Свинец и олово — металлы, давно используемые в технике для производства различных сплавов и защитных покрытий. Кроме того, олово применяется дляизготовления посуды и приборов. Свинец находит широкое использование в аккумуляторах и для изготовления защитных экранов от ионизирующих излучений.
15. Термодинамические системы и их классификация. Параметры системы. Первый закон термодинамики. Понятие о термодинамических функциях состояния. Внутренняя энергия и энтальпия. Применение первого закона термодинамики к изохорному, изобарному, изотермическому и адиабатному процессах. Стандартные условия. Стандартная энтальпия образования вещества. Закон Гесса и следствия из него. Тепловой эффект химической реакции. Термохимические расчеты.
Термодинамическая система (далее система) — часть пространства, выделенная для рассмотрения и отделенная от окружающей среды реальной (межфазовой) или условной границей (так называемой контрольной поверхностью). Системы могут быть изолированными, закрытыми (замкнутыми) и открытыми. Изолированная система характеризуется постоянством массы т, объема V и энергии U (m= const, V = const, U = const), она не обменивается с окружающей средой ни веществом, ни энергией. Закрытая система обменивается с окружающей средой только энергией и не обменивается веществом (m = const, V =/ const, U =/ const). В открытой системе осуществляются оба указанных вида обмена с окружающей средой (m=/ const, V =/ const, U =/ const).
Параметры состояния — свойства системы, выбранные в качестве независимых переменных. Функция состояния — величина, определяемая этими параметрами, однозначно характеризует систему и не зависит от пути ее перехода из одного состояния в другое. Различают экстенсивные и интенсивные параметры состояния. Экстенсивными называют параметры состояния, пропорциональные количеству вещества системы (объем, масса, заряд, внутренняя энергия, энтальпия, энтропия и т.д.). Интенсивными — параметры состояния, не зависящие от количества вещества (температура, давление, электрический потенциал и др.).
Первый закон термодинамики вытекает из более общего закона сохранения энергии. Для термодинамической системы он формулируется следующим образом: количество теплоты Q, сообщенное системе, расходуется на увеличение ее внутренней энергии At/и на совершение работы ^системой, т.е. Q=AU+W.Для элементарных процессов с бесконечно малыми изменениями параметров принимает вид:
bQ = dU + bW= dU+pdV+ bW\ rnepdV— работа расширения системы; bW— сумма других видов работ (электрической, сил поверхностного натяжения и др.).
Функции состояния системы называются термодинамическими. Термодинамических функций существует бесчисленное множество, поскольку если известна одна из них, то какая-либо функция от этой функции также является термодинамической функцией состояния. Наиболее широко применяются следующие термодинамические функции состояния: внутренняя энергия U, энтальпияН, свободная энергия (функция Гельмгольца)F, функция ГиббсаG, химический потенциалμi.
Изотермический процесс (Т = const). bQT=bW=pdV, Qt=W.
Изохорный процесс (V= const).

Изобарный
процесс (р = const).

16. Второй закон термодинамики. Функции состояния энтропия. Расчет изменения энтропии. Энтропия и термодинамическая вероятность(ф-ла Больцмана). Третий закон термодинамики. Абсолютная энтропия вещества. Расчет изменения энтропии в процессе хим реакции. Зависимость энтропии от температуры.
1.Оствальда: невозможно построить вечный двигатель 2 рода (машину, которая производила бы теплоту при постоянной температуре, за счет поглощения теплоты из окружающей среды).
2.Клаузиуса (1850г): теплота не может самопроизвольно переходить от менее нагретого тела к более нагретому.
3. Карно: теплота, полученная от источника не может быть полностью передана в работу.
Энтропия является функцией внутренней энергии и объема системы: S=f(U,V). Энтропия обладает свойством аддитивности (увеличения в n раз при увеличении числа моль в n раз)
Формула Больцмана: S=K*lnW, K-постоянная Больцмана, W-террмодинамическая вероятность-число способов,какими может быть осуществлено данное макросостояние
Адиабатический: dS=bQ/T; bQ=0; dS=0; Изотермический: dS=Qp/T=dH/T;
Изобарный: dS=nCp lnT2/T1; Изохорный: dS=nCx lnT2/T1;
Абсолютное значение внутренней энергии и энтальпии невозможно вычислить даже для простых систем. Абсолютные значения энтропии рассчитываются как для простых, так и для сложных веществ, поскольку у них имеется начальная точка в шкале отсчета, устанавливаемая третьим законом термодинамики.
Третий закон термодинамики: Постулат Планка: При Т=0[К] энтропия идеального кристалла любого простого или сложного вещества равна нулю lim(t-->0)S=0 или S(0)=0 . Нельзя построить тепловую машину, которая бы охлаждала бы систему до абсолютного нуля.
