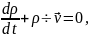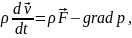- •6.2 Механические свойства горных пород 50
- •1 Предмет и методы механики сплошных сред. Некоторые сведения о векторном анализе
- •Основные гипотезы механики сплошных сред
- •Некоторые сведения о векторном анализе
- •Компоненты векторов в декартовой системе координат. Индексные обозначения
- •Градиент
- •Поток вектора
- •Дивергенция
- •Циркуляция
- •2 Два подхода к описанию движения сплошной среды
- •2.1 Пространственные и материальные координаты
- •2.2 Закон движения сплошной среды
- •2.3 Лагранжев и Эйлеров подходы к описанию движения сплошной среды
- •Переход от лагранжева описания к эйлерову
- •Переход от эйлерова описания к лагранжеву
- •2.4 Материальная (индивидуальная, полная) производная по времени
- •2.5 Линии тока и траектории
- •2.6 Установившееся и неустановившееся движение
- •Силы в сплошной среде. Тензор напряжения
- •3.1 Силы, действующие на сплошную среду. Вектор напряжения
- •4.2 Тензор напряжений
- •4 Элементы теории деформаций
- •4.1 Тензор деформаций
- •3.2 Механический смысл компонент тензора деформаций
- •3.3 Выражение тензора деформаций через вектор перемещений
- •3.4 Тензор скоростей деформаций. Вектор вихря
- •5 Законы сохранения и универсальные уравнения механики сплошных сред
- •5.1 Закон сохранения массы и уравнение неразрывности
- •Уравнение неразрывности для несжимаемой среды
- •5.2 Понятие математической модели среды. Универсальные уравнения и определяющие соотношения
- •5.3 Модель идеальной жидкости/газа
- •5.4 Полная система уравнений идеальной жидкости
- •Граничное условие на поверхности твердых тел для идеальной жидкости
- •5.4 Несжимаемая идеальная жидкость. Полная система уравнений
- •5.5 Модель вязкой жидкости
- •6 Механические свойства горных пород
- •6.1 Механические свойства твердых тел и их показатели
- •6.2 Механические свойства горных пород
- •6.3 Классификация горных пород по механическим свойствам
- •6.4 Естественное напряженное состояние горных пород и его изменение вблизи горных выработок
- •6.5 Деформация горных пород вблизи скважины Упругая деформация
- •Пластическая деформация
- •7 Взаимодействие горных пород и насыщающих их жидкостей
- •7.1 Основные представления о механическом взаимодействии горных пород и насыщающих их жидкостей
- •7.2 Деформация горных пород в результате механического взаимодействия горных пород и насыщающих их жидкостей
- •Упругая деформация
- •Пластическая деформация
- •7.3 Механическое взаимодействие горных пород и фильтрующейся жидкости при упругом режиме пластов
- •8.1 Вертикальные трещины Вертикальные трещины с линейным распределением давления
- •Вертикальные трещины с параболическим распределением давления
- •8.2 Осесимметричные горизонтальные трещины Горизонтальные трещины с линейным распределением давления
- •Горизонтальные трещины с параболическим распределением давления
- •8.3 Закачка нефильтрующейся жидкости Образование горизонтальной трещины в результате закачки нефильтрующейся жидкости
- •Образование вертикальной трещины в результате закачки нефильтрующейся жидкости
- •8.4 Закачка фильтрующейся жидкости
5.3 Модель идеальной жидкости/газа
При движении жидкостей и газов, в них возникают касательные напряжения. Это свойство жидкостей называется вязкостью, а сами касательные напряжения в жидкостях и газах называют вязким трением. Однако во многих случаях вязкие касательные напряжения, возникающие при движении, оказываются малыми по сравнению с силами, связанными с давлением. Модель, в которой вязкими касательными напряжениями пренебрегается, называется идеальной (невязкой) жидкостью.
Идеальные жидкости и газы – это жидкости и газы, в которых
а) не только при равновесии, но и при движении нет касательных напряжений, т.е. всегда на любой площадке
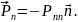
б) непрерывные механические процессы обратимы в термодинамическом смысле.
Из условия (а)
следует, что в идеальной жидкости и в
идеальном газе всегда, а не только в
покое
 ,
а компоненты тензора напряжений в
декартовой системе координат имеют вид
,
а компоненты тензора напряжений в
декартовой системе координат имеют вид
где - давление.
5.4 Полная система уравнений идеальной жидкости
Полная система уравнений идеальной жидкости включает, во-первых, универсальную систему, которая для идеальной жидкости имеет вид:
|
|
Уравнение неразрывности |
|
|
Уравнение движения идеальной жидкости (уравнение Эйлера) |
|
|
Уравнение притока тепла |
|
|
Второй закон термодинамики |
где – плотность внутренней энергии;
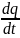 – приток тепла к
единице массы за единицу времени;
– приток тепла к
единице массы за единицу времени;
– температура;
 – энтропия.
– энтропия.
Уравнение движения
идеальной жидкости
 называется
уравнением
Эйлера.
называется
уравнением
Эйлера.
Обычно приток
тепла
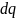 определяется законом Фурье, поэтому
неизвестных в этой системе 8:
определяется законом Фурье, поэтому
неизвестных в этой системе 8:
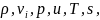
а уравнений – 6, следовательно, нужны еще 2 соотношения, которые определяют конкретную жидкость или газ. Эти два отношения называются уравнениями состояния. Обычно они представляют собой: 1) связь между давлением, плотностью и температурой, и 2) выражение плотности внутренней энергии как функции плотности и температуры, то есть следующие соотношения:
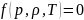 - уравнение
состояния,
- уравнение
состояния, – калорическое
уравнение состояния.
– калорическое
уравнение состояния.
Рассмотрим различные уравнения состояния для жидкостей и газов.
В области нефтяной
и газовой промышленности, преимущественно
уравнение состояния описывает связь
между плотностью флюида и давлением в
виде
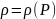 .
.
Для жидкостей при больших изменениях давления от начального значения P0 до текущего значения P плотность жидкости может быть определена по формуле:
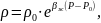
где
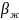 –
объемный коэффициент упругости жидкости,
–
объемный коэффициент упругости жидкости,
 – плотность
жидкости при давлении P0.
– плотность
жидкости при давлении P0.
Так как значение
выражения
 обычно много меньше единицы, то при
разложении экспоненты в ряд Тейлора,
ограничиваясь линейным приближением,
можно записать уравнение состояния в
виде
обычно много меньше единицы, то при
разложении экспоненты в ряд Тейлора,
ограничиваясь линейным приближением,
можно записать уравнение состояния в
виде

Данная форма записи обычно используется при определении плотности жидкости при малых изменениях давления P.
Для газов уравнение состояния играет очень важную роль в силу сильной сжимаемости. Самой простой моделью газа является совершенный газ.
Совершенным газом называется такой газ, в котором согласно молекулярно-кинетической теории выполнены следующие условия:
Потенциальной энергией взаимодействия частиц газа можно пренебречь по сравнению с их кинетической энергией;
Суммарный объем частиц газа пренебрежимо мал;
Отсутствуют силы взаимодействия между частицами, а соударения частиц между собой и со стенками сосуда являются абсолютно упругими;
Время взаимодействия между частицами пренебрежимо мало по сравнению со средним временем между столкновениями.
Совершенный газ описывается уравнением состояния Менделеева-Клапейрона:

где – давление;
– объем;
– масса;
– молярная масса;
 – универсальная
газовая постоянная;
– универсальная
газовая постоянная;
– температура.
При изотермическом переходе газа из одного состояния в другое, уравнение состояния Менделеева-Клапейрона удобнее записать в виде:
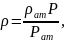
где
 – плотность
газа при атмосферном давлении
– плотность
газа при атмосферном давлении
 .
.
Примечание. В физике используется термин «идеальный газ». Однако в механике сплошных сред термины «идеальный газ» и «идеальная жидкость» заняты. Они означают, что касательные напряжения (вязкость) в этой модели не учитываются. Поэтому для газа, удовлетворяющего уравнению Менделеева-Клапейрона, вместо названия «идеальный газ», принятого в физике, используется название «совершенный газ» (perfect gas).
Использовать уравнение состояния совершенного газа целесообразно лишь при низких давлениях, так как в этом случае реальные газы согласуются с введенным определением совершенного газа. В случае высоких давлений и возможных фазовых переходах, использование уравнения состояния совершенного газа невозможно. В этом случае часто используют полуэмпирически выведенные уравнения состояния. Например, уравнения состояния Ван-дер-Ваальса, Дитеричи, Редлиха-Квонга, Пенга-Робинсона и другие.
Наиболее распространенной формой уравнения состояния для реальных газов является уравнение состояния Менделеева-Клапейрона с коэффициентом сверхсжимаемости z(P):

или в случае изотермического перехода
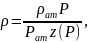
где z(P) характеризует степень отклонения реального газа от совершенного. Характерная зависимость коэффициента сжимаемости для углеводородной смеси в терминах приведенной температуры и давления представлена на рисунке 5.2.

Рисунок 5.2 – Зависимость коэффициента сверхсжимаемости z(P) от приведенного давления
С молекулярно-кинетической
точки зрения характер изменения
коэффициента z(P)
можно
объяснить следующим образом. При малых
значениях давления реальный и совершенный
газ близки между собой, поэтому
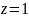 .
Увеличение давления в системе ведет к
увеличению плотности газа, а, следовательно,
уменьшению расстояния между молекулами,
что приводит к большей сжимаемости
реального газа за счет проявления сил
притяжения (которые отсутствуют в
совершенном газе), объясняющее уменьшение
значения z.
Точка минимума на графике z(P)
соответствует
максимальной интенсивности проявления
сил притяжение. Последующее увеличение
давления и увеличение коэффициента z
связано с сопротивлением газа сжатию,
из-за проявления сил межмолекулярного
отталкивания. Определение зависимости
коэффициента сверхсжимаемости z
от давления
P
является
важной задачей, так как позволяет
наиболее точно характеризовать газовую
смесь и определить возможный момент
конденсации газа в жидкое состояние.
.
Увеличение давления в системе ведет к
увеличению плотности газа, а, следовательно,
уменьшению расстояния между молекулами,
что приводит к большей сжимаемости
реального газа за счет проявления сил
притяжения (которые отсутствуют в
совершенном газе), объясняющее уменьшение
значения z.
Точка минимума на графике z(P)
соответствует
максимальной интенсивности проявления
сил притяжение. Последующее увеличение
давления и увеличение коэффициента z
связано с сопротивлением газа сжатию,
из-за проявления сил межмолекулярного
отталкивания. Определение зависимости
коэффициента сверхсжимаемости z
от давления
P
является
важной задачей, так как позволяет
наиболее точно характеризовать газовую
смесь и определить возможный момент
конденсации газа в жидкое состояние.