
- •Основные понятия фармакологии. Фамакокинетика, фармакодинамика и биодоступность.
- •Пути введения лекарства в организм.
- •Методология молекулярной модификации.
- •1. False positives, электрофилы, реагируют с белками. Выявляется не sar, а srr (structure-reactivity relationship).
- •1. Увеличение метаболической стабильности (холестериновый ингибитор абсорбции)
- •2. Кинезин связывающий белковый ингибитор (Уменьшение показателя pKa)
- •Количественный анализ “активность-структура” (qsar).
- •Биологическая мишень и строение лекарственного средства. Модель “идеального лекарства”.
- •Зависимость фармакотерапевтического эффекта от свойств лекарственного средства и условий применения: химическое строение, физико-химические свойства.
- •Ферменты. Ингибиторы и активаторы ферментов. Мутация ферментов патогенных микроорганизмов.
- •Строение и свойства биологических барьеров.
- •Рецепторы - классификация, строение, свойства.
- •14. Современные методы изучения строения биологической мишени.
- •Условия для ямр -эксперимента
- •15. Скрининг, молекулярная модификация, метаболизм лекарств, аналоги переходного состояния, суицидные ингибиторы ферментов, аффинные модификации активного центра.
- •Критерии отбора веществ - кандидатов для скрининга
- •Биотесты (скрининг) – 1 этап (in vitro)
- •Метаболизм (фаза 1)
- •Метаболизм (фаза 2)
- •16. Принцип антиметаболитов в умозрительном дизайне лп. Определение активной группы в семействе подобных лп – принцип фармакофора.
- •17. Современные методы изучения взаимодействия лекарство-рецептор (активный центр фермента).
- •18. Способы увеличения биодоступности. Пролекарства.
- •19. Пассивное и активное высвобождение.
- •20. Дисперсии: нанокристаллы, наносферы, нанокапсулы, эмульсии, мицеллы, липосомы и др.
- •21. Липосомы как лекарственная форма https://revolution.Allbest.Ru/medicine/01041051_0.Html
- •22. Пассивное и активное нацеливание.
- •23. Днк, олигонуклеотиды и их аналоги как лекарственные вещества (генная терапия, ас-терапия)
- •1. Твердо-фазный органический синтез
- •2. Жидкофазный органический синтез
- •3. Polymer assisted solution phase synthesis – pasp (Полимер-связанные реагенты и поглотители)
- •1. Параллельный синтез
- •2. Синтез Pool/Split
1. Твердо-фазный органический синтез
-> Библиотека соединений, синтезированных на твердых подложках, таких как resin bead, pins, or chips.
Продукт связан с твердой подложкой
+ Легкое очищение -> Легко удалить избыточные реагенты при помощи фильтрации
- Низкий выход, связь в точке присоединения, сложно применять стандартные методы определения характеристик на интермедиатах (для повышения выхода были разработаны подложки на основе дендримеров и полиэтиленгликоля)
2. Жидкофазный органический синтез
-> Библиотека соединений, синтезированных в растворителе в реакционной колбе. Реакция проводится в растворе
+ Легкость характеризации как интермедиатов, так и конечных продуктов. Нет ограничения по местам связывания -> Сокращение времени проверки по сравнению с твердофазным синтезом (для характеристики продуктов могут быть использованы стандартные аналитические методики после каждой стадии реакции)
- Трудно управлять реакцией для смещения равновесия в сторону продукта, необходима глубокая очистка
3. Polymer assisted solution phase synthesis – pasp (Полимер-связанные реагенты и поглотители)
Являются гибридными методами синтеза между твердо- и жидко-фазными способами Реагенты и поглотители вводятся в реакцию на твердых подложках.
СОЗДАНИЕ ИЗГОТОВЛЕНИЕ БИБЛИОТЕК
1. Параллельный синтез
-
Каждое соединение готовится в отдельной емкости (на pin или Tea-bags)
-
Массив реакционных сосудов (пластины с 96 ячейками -> в каждую ячейку другое соединение)
-
Автоматизированный контроль реакций -> легко отслеживать каждое соединение
-
Высокие выходы
-
Применяются при изменении небольшого числа позиций -> небольшие библиотеки
2. Синтез Pool/Split
-
Удобно для разработки больших библиотек
-
Для отслеживания каждого соединения требуется маркировка
-
Beads разделены в разные емкости
-
После протекания реакции, все перемешивается и разделяется снова.
ОТСЛЕЖИВАНИЕ ПРОТЕКАНИЯ РЕАКЦИИ
Радиочастотная метка Radio Frequency (RF)
Метка передатчика упаковывается в пористый стеклянный шарик с вместимостью 30-300 мг
Нано метки
Одно из недавних достижений в нанесении меток на шарики является изобретение нано-реакторов -> помеченных 2D-штрих-кодом, что позволяет отслеживать библиотеки с количеством соединений до 100000.
МЕТОДЫ ЭКСТРАКЦИИ ДЛЯ ОЧИСТКИ
-> Liquid-Liquid extraction
-
Широко применяется в жидко-фазном синтезе.
-
Автоматизация с использованием лиофильной сушки.
Плохо;
-
Формирование эмульсий
-
Примеси могут иметь аналогичную растворимость.
-> Fluorous phase technique
-
Присоединение перфторированного фрагмента.
-
Переход молекулы в фторированный растворитель
-> Solid-phase extraction
СВОЙСТВА
leadlikeness
drulikennes

Избыток реагента или побочные продукты могут быть удалены путем фильтрации.
ПЛЮСЫ И МИНУСЫ. PASP Твердофазный синтез. Жидкофазный синтез.

HTS - Возможность быстрого поиска среди миллионов соединений, обладающих определенным типом биологической активности
Для скрининга / проверки всех типов биологически активных соединений (библиотек): Природных веществ Комбинаторных библиотек (пептидов, хим.соединений…) Биологических библиотек скрининг при помощи микрочипов: ДНК чипы РНК чипы белковые чипы
Скрининг микроорганизмов -> для новых ферментов
-> при помощи генетических зондов -> культивируемые –
> метагеномный скрининг -> не культивируемые
1.Метод генетического зонда
-> метод гибридизации
-> определение наличия и местоположения специфических генов в организме
-> оценка распределения гена среди различных образцов
-> таксономические маркеры
-> поиск новых ферментов в микробиологической культуре
Ограничение : микробиологические штаммы можно использовать в скрининговом исследовании, только если культивирование возможно!!!
СКРИНИНГ МИКРООРГАНИЗМОВ -> ДЛЯ НОВЫХ ФЕРМЕНТОВ
2. Метагеном -> скрининг некультивируемых микроорганизмов генетический материал, получаемый напрямую из образцов среды. Так же эта область знаний называется «геномика окружающей среды» или «экогеномика». Традиционное секвенирование геномов полагается на культивируемые клоны культур, в то время как Метагеномика работает с набором всех ДНК находящихся в среде. Основным отличием при использовании метагеномного подхода является учет некультивируемых (англ. VBNC) микроорганизмов наряду с культивируемыми.
-> Флуоресцентная гибридизация in situ (FISH)
-> 16S rРНК библиотека клонов
-> метагеном
->16S rRNA библиотека клонов
-> используется для определения некультивируемых микроорганизмов
-> составляет карту их филогенетических связей (таксономии)
Fluorescence in situ hybridization (FISH) -> может использоваться для определения наличия/отсутсвия и локализации специфических ДНК последовательностей в хромосомах. Кроме того, FISH может использоваться для сравнения геномов двух биологических образцов, для нахождения эволюционных связей.
-> Метагеном -> экстракция ДНК из всех микроорганизмов, представленных в изоляте -> генерирование библиотеки или использование в ПЦР Библиотека -> BAC vector based (20-500 kbp insert) Векторные системы, основанные на искусственных хромосомах бактерий - BAC (bacterial artificial chromosome) .


Что означает «ведущая» “lead” структура?
-> показывает желаемую биологическую активность
-> но до сих пор не дает комбинацию всех желаемых свойств, необходимых для терапевтического применения
Анализ технологий HTS
A -> Cell growth tests (cell-based assays) -> Phenotypic assays
-> проблема различить активные и токсичные соединения
-> время отклика у клеток может быть долгим (мин, часы, дни)
-> Источник неспецифических хитов (соединения влияющие на метаболизм-> сложность !!!)
B -> Ответ ткани -> targeted functional cell-based assay
-> Чувствительность и специфичность к рецептору имеет решающее значение
-> Рекомбинантные клеточные линии позволяют контролировать функциональную активность
-> время отклика
-> проводится различие между агонистами и ингибиторами
C -> Enzyme test -> biochemical test
-> лучшая чувствительность
-> можно проводить при высокой концентрации соединения
-> Позволяет провести различие между ингибиторами и стимуляторами
-> большая экспериментальная свобода
-> хорошо подходит для автоматического скриннинга
-> “fragment screening” (структурные фрагменты с малым сродством
-> дизайн -> увеличение аффиности)
Создание библиотек
Свободные (случайные) библиотеки
Обычно общее химическое ядро (начальный scaffold)
Большое количество билдинг блоков (весьма разнообразных)
Множество целей
Создание «ведущей» структуры
> 5.000 соединений
Твердофазный синтез (по возможности скрининг one bead)
Направленные библиотеки
Опять общее химическое ядро
Ограниченное количество билдинг блоков (структурно подобных)
Направлены на достижение конкретной цели
Используется для оптимизации «ведущей» структуры
<< 5.000 соединений
Твердофазный синтез, синтез в растворе
ProtoArray![]() Human
Protein Microarray
Life
Technologies
ProtoArray
Human
Protein Microarray
Life
Technologies
ProtoArray![]() Human
Protein Microarray - белковая матрица, позволяющая
осуществлять эффективную детекцию
белковых взаимодействий с использованием
изучаемых белков и небольших молекул.
Технология представляет собой
иммуноферментный анализ в микроформате
с высокой степенью мультиплексности
(до 9400 мишеней для одного аналита).
Быстрый,
простой, чувствительный метод для
идентификации взаимодействий белков
с молекулами-мишенями.
Скрининг
взаимодействия целевого белка или малой
молекулы с тысячами белков человека
различных классов таких как: киназы,
белки, ассоциированные с мембранами,
белки сигнальной трансдукции, антитела,
а так же протеины, вовлеченные в различные
метаболические пути.
Наличие
контролей, иммобилизованных на той же
мембране, обеспечивает жесткий контроль
фонового сигнала и обеспечивает высокую
точность детекции.
Готовые
протоколы для анализа киназ,
убиквитин-лигазной активности, связывания
антител и малых молекул на одной
универсальной матрице.
Совместимость
с широким выбором сканеров с флуоресцентным,
хемилюминесцентным или радиоактивным
типами детекции.
Human
Protein Microarray - белковая матрица, позволяющая
осуществлять эффективную детекцию
белковых взаимодействий с использованием
изучаемых белков и небольших молекул.
Технология представляет собой
иммуноферментный анализ в микроформате
с высокой степенью мультиплексности
(до 9400 мишеней для одного аналита).
Быстрый,
простой, чувствительный метод для
идентификации взаимодействий белков
с молекулами-мишенями.
Скрининг
взаимодействия целевого белка или малой
молекулы с тысячами белков человека
различных классов таких как: киназы,
белки, ассоциированные с мембранами,
белки сигнальной трансдукции, антитела,
а так же протеины, вовлеченные в различные
метаболические пути.
Наличие
контролей, иммобилизованных на той же
мембране, обеспечивает жесткий контроль
фонового сигнала и обеспечивает высокую
точность детекции.
Готовые
протоколы для анализа киназ,
убиквитин-лигазной активности, связывания
антител и малых молекул на одной
универсальной матрице.
Совместимость
с широким выбором сканеров с флуоресцентным,
хемилюминесцентным или радиоактивным
типами детекции.
Скрининг библиотек: Что такое библиотека? Объединение большого количества связных / подобных веществ (химических веществ, белков,…..) -> не встречающихся в природе-> искусственно полученных!!! Какие библиотеки можно сделать и для чего их используют? -> Комбинаторные библиотеки (химический синтез) все виды химических соединений (включая пептиды), которые могут быть синтезированы; используются для поиска возможных лигандов, открытия лекарств, анализа взаимодействий, …. -> Биологические библиотеки (библиотеки ДНК, РНК, библиотеки кодировки генов, протеиновые библиотеки) Микроанализы, методы на микрочипах, скрининг и разработка ферментов, антибиотиков, вирусов, возможных лигандов, анализа взаимодействий, …
СКРИНИНГ БИБЛИОТЕК: ДИЗАЙН БИБЛИОТЕК: ! Размер и разнообразие -> прямое влияние на успешность скрининга! -> Targeted libraries-> составляются из информации, полученной из биомедицинских программ (поиск новых lead structures) -> Focused libraries -> предварительно выбранный набор соединений, основанный на виртуальном скрининге Targeted libraries -> Discovery libraries-> сгенерированные случайным образом (поиск новых ) 3 аспекта дизайна библиотек:
-> комбинаторный синтез -> статистическое рассмотрение -> модели молекулярного распознавания
Скрининг библиотек:
Дизайн библиотек:
! Размер и разнообразие -> прямое влияние на успешность скрининга!
Лимитирующие факторы для размера библиотеки:
-> стоимость
-> технические возможности (хранение, логистика)
Assay Technology in HTS
A -> Cell growth tests (cell-based assays) -> Phenotypic assays
Почему?
-> Механизм действия + отношение к болезни -> комплексные цели
-> анализ в физиологических условиях
-> Мишень сложно или дорого выделить и очистить
-> Быстрый и наименее дорогой подход
задачи по реализации:
-> рост и адгезия клеток
-> чувствительность к растворителям
-> цитотоксичность
-> стабильность клеточной линии
Possible Future -> cell-based screenings on chips !!!
Требования к скринингу
-
Высокая чувствительность (определение единичных молекул)
-
Высокая скорость (автоматизация)
-
Уменьшение объемов тест-системы (анализ на микроплашках)
-
Ясный результат (лучше: Да/НЕТ)
-
Низкая сложность (специфичное взаимодействие)
-
Воспроизводимость
-
Быстрая обработка данных результатов
-
Приемлемые цены !!!
Скрининг новых соединений. Hit to lead (H2L)

Скрининг ингибиторов Сериновой протеазы -> Завершено за 2 недели 9 роботов тестировали 170 000 соед в день A -> соединения с 20% и выше ингибированием B -> активность после контрольного тестирования
В HTS -> небольшое колличество lead candidates
-> большое колличество невоспроизводимых хитов(false positives)
-> соединения действующие не-специфично
Анализ результатов скрининга -> биологическая активность+ хемоинформатика ДАЛЕЕ
оценка + интерпретация полученных результатов
Объединение активных соединений в структурные классы (clusters) -> новые возможности направленного поиска хитов
Хемоинформатика в HTS:
-> Исключение не-специфичных соединений из хитов (hit sets) -> определение ложноотрицательных результатов
+ пограничная активность
Методы детекции в HTS:

Спектроскопия в HTS:

-
Комбинаторные библиотеки.
Комбинаторная химия — метод поиска биологически активных веществ путём массового синтеза серий аналогичных соединений с различными заместителями и их массового скрининга.
Комбинаторная библиотека — набор большого числа всевозможных химических соединений, белков, генов или олигонуклеотидов, позволяющий осуществлять в нем быстрый поиск целевых генов или белков-мишеней. Напр., набор, состоящий из миллионов различных химических веществ, или совокупность рекомбинантных молекул ДНК, полученная встраиванием в вектор кДНК легкой и тяжелой цепей различных антител, и др.

-
Комбинаторный синтез. Метод split-and-pool.
Метод включает прикрепление исходных соединений к полимерным шарикам. Затем шарики разделяют на 50 групп и реагируют со вторым набором реагентов. После этой реакции все шарики объединяют, смешивают и снова разделяют на 50 групп. Если смешивание эффективно, каждая группа должна содержать приблизительно одинаковое количество гранул, представляющих каждый из 1000 продуктов первого поколения.
Группы шариков затем реагируют со следующим набором реагентов. Если шарики помечают каким-либо образом после каждой реакции (например, с помощью другой флуоресцентной метки для идентификации каждого реагента), комбинация меток будет точно характеризовать каждый из 50 000 продуктов второго поколения. Готовые шарики могут быть проверены на их способность связывать определенный целевой белок в организме. Состав с лучшими характеристиками может быть идентифицирован и испытан в дальнейшем. Дополнительные раунды объединения и разделения позволяют создавать библиотеки с миллионами соединений и подвергать их высокопроизводительному скринингу (HTS).

-
Комбинаторный синтез. Метод tea-bag.

-
Комбинаторная химия. Твердофазный синтез.


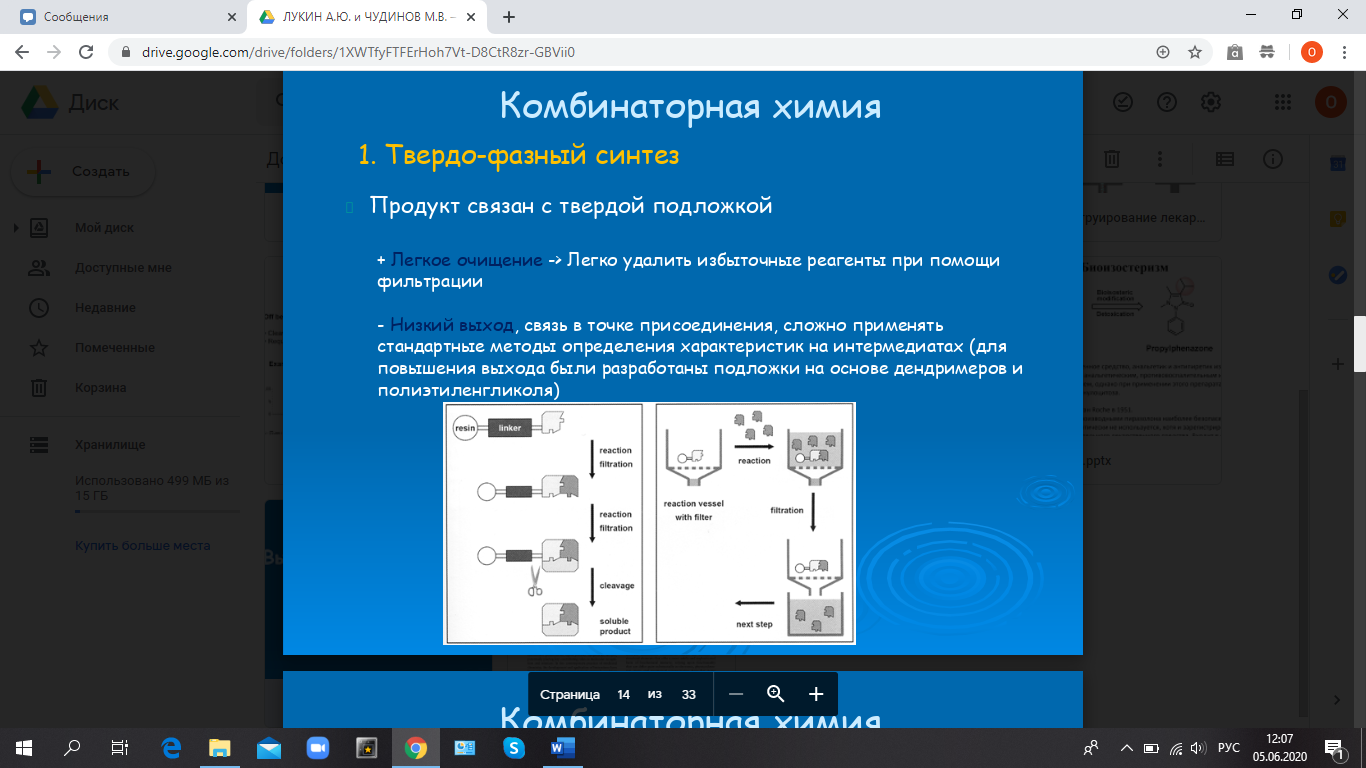
-
Комбинаторная химия. Жидкофазный синтез.


-
Комбинаторная химия. Полимер-связанные реагенты и поглотители.


-
Дизайн комбинаторных библиотек. Свободные и направленные библиотеки.

-
Высокопроизводительный скрининг. Источники химического разнообразия. (лк 10) Экстракты


Сырой, частично очищенный и очищенный экстракты


-
Высокопроизводительный скрининг. Поиск соединений «хитов», причины ошибок.
Соединение-хит (hit compound) — термин, означающий своего рода первичное «попадание в цель» при скрининге веществ на физиологическую активность, т.е. удачный выбор соединения, проявляющего физиологическую активность. Затем проводится тестирование круга соединений с похожей структурой, из которых потом выбирают соединение-лидер.
Процесс скрининга библиотеки обычно состоит из двух этапов. Первичный скрининг - это скрининг всех соединений библиотеки, содержащей от тысячи до миллиона соединений, в одной, достаточно высокой концентрации и в одном тесте для минимизации издержек и сокращения затрачиваемого времени на поиск соединений - “хитов”, проявляющих повышенную активность к той или иной биомишени. На этом этапе получается большое количество ложноположительных результатов, что обусловлено взаимодействием веществ друг с другом и их взаимным влиянием на молекулу мишени (синергизм действия), их различной растворимостью, устойчивостью, наличием примесей и т.д.
Поэтому, после нахождения “хитов” на стадии первичного скрининга, проводится их вторичный скрининг: в двух-трех тестах с меньшими концентрациями индивидуально скринируются все “хиты” из первичного скрининга для подтверждения того, что действительно найдены настоящие “хиты”.
-
H2L (Hit to lead) стратегия при создании ЛС.
Соединение-лидер (ведущее соединение) (lead compound) — химическое соединение, обладающее желаемой, интересной, но не оптимизированной биологической активностью; с помощью последующей оптимизации структуры соединение-лидер может быть преобразовано в клинически пригодное лекарство. Иными словами, соединение-лидер — это структурный прототип будущего лекарства.


-
Твердофазный синтез. Методы постадийного анализа.
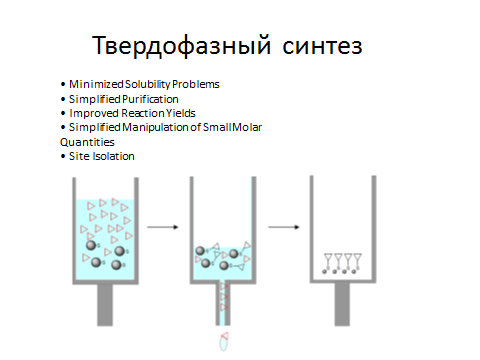

-
Высокопроизводительный скрининг. Специфичные и неспецифичные «хиты».
В ходе тотального скрининга обнаруживают неспецифичные хиты. Существует база таких соединений. Эти хиты могут: флуоресцировать на длине волны, на которой считывает ридер => загрязнение; проявлять биологическую активность.
-
Структурный дизайн (Structure-Based Drug Design) ЛС.
Должны быть известны структуры лиганда и биомишени.
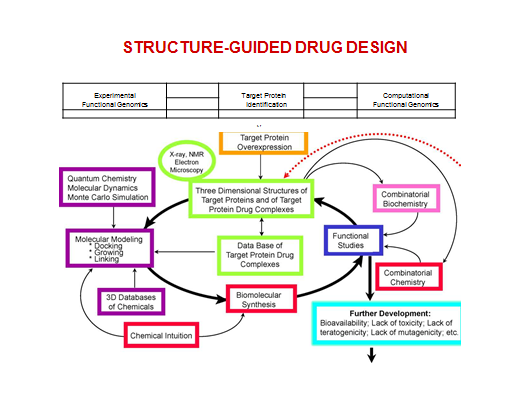

-
Твердофазный синтез. Смолы. (лк 12)







-
Твердофазный синтез. Типы полимер-связанных реагентов. (лк 13, 14)

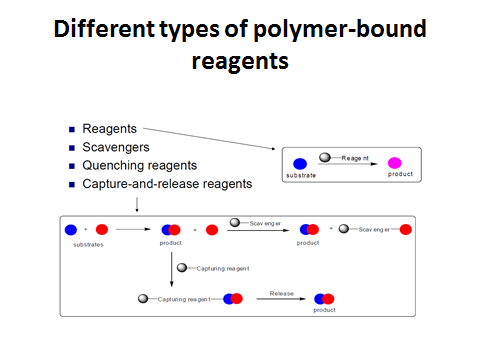


-
Комбинаторная химия. Дизайн библиотек, правило 5.
Правило Липински (Lipinski rule, rule of five) — эмпирическое правило, устанавливающее критерии подобия лекарствам для химического соединения. Согласно этому правилу молекула с большой вероятностью окажется непригодной для перорального применения в качестве лекарства по своим фармакокинетическим и другим свойствам, если для нее выполняются хотя бы два из следующих условий: молекулярная масса > 500, значение lgP > 5, наличие более пяти доноров водородных связей, присутствие более десяти акцепторов водородных связей.

log P > 5 – коэффицент распределения вещества в системе 1-октанол/вода
-
Комбинаторная химия. Виртуальный скрининг.
Виртуальный скрининг (virtual screening, in silico screening) — совокупность компьютерных методов, позволяющих осуществлять отбор перспективных соединений на основе прогноза фармакологически значимых свойств для структур, содержащихся в виртуальных химических библиотеках. Применение виртуального скрининга является неотъемлемой частью большинства современных программ разработки инновационных лекарственных средств.

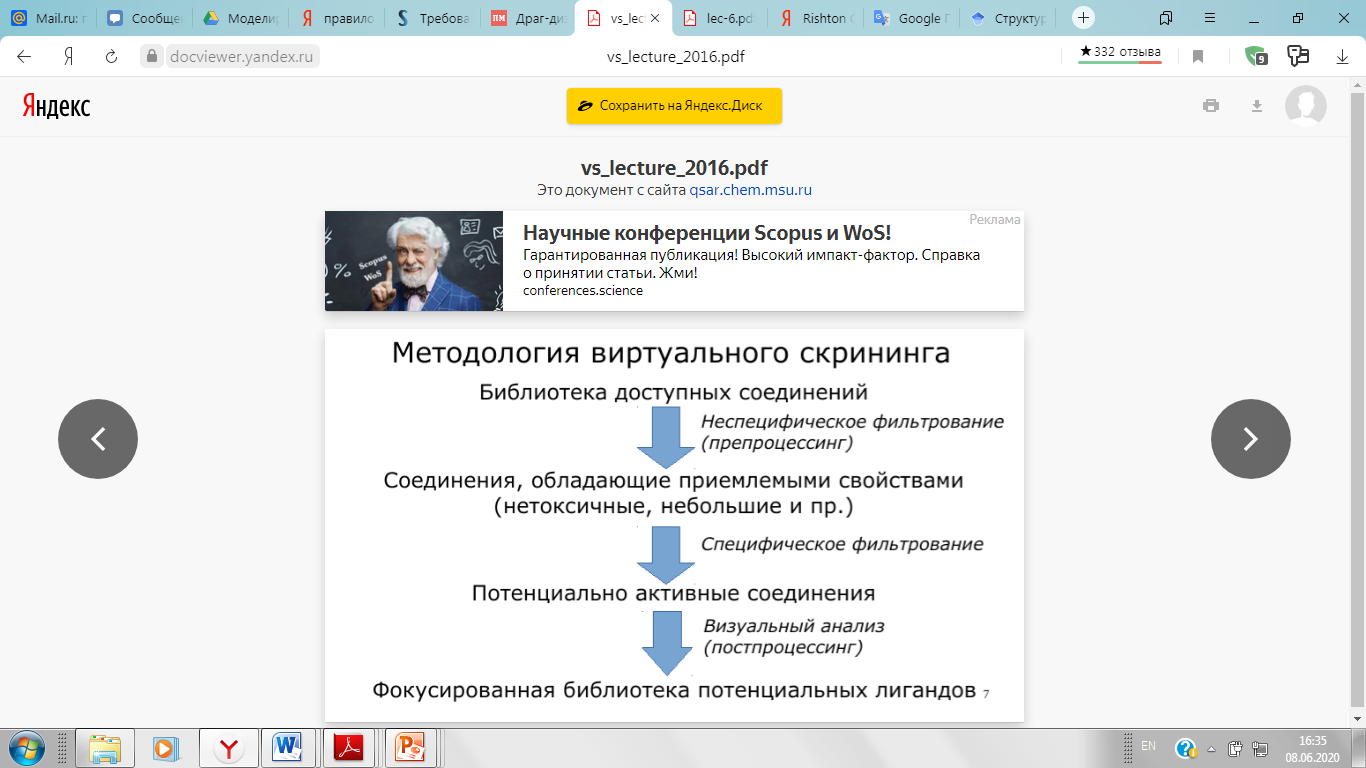



В основе виртуального скрининга лежит компьютерный алгоритм, на вход которого можно подать структуру химического соединения и получить на выходе ответ на вопрос, активно ли соединение по отношению к нашей терапевтической мишени. Сегодня суммарное предложение на рынке химических соединений превышает 20 миллионов. Все эти миллионы соединений могут быть пропущены через компьютерный алгоритм виртуального скрининга. Те соединения, на которые алгоритм укажет как на потенциально активные, могут быть куплены и тестированы в пробирке. Огромное достоинство виртуального скрининга в том, что с его помощью в поиск хита вовлекается количество соединений, немыслимое в рамках экспериментального скрининга даже в самых больших фармацевтических компаниях. Его главная слабость в том, что слишком многим пропущенным через алгоритм соединениям присваивается статус потенциально активных. Нередко случается, что среди 50–100 виртуальных хитов, закупленных для экспериментального подтверждения, не оказывается ни одной действительно активной молекулы.
Почему виртуальный скрининг так часто ошибается и можно ли повысить его эффективность? Для ответа на эти вопросы нужно, хотя бы очень кратко, пояснить, как именно работает компьютерный алгоритм виртуального скрининга. Таких алгоритмов много, но самый популярный из них, ставший практически синонимом скрининга, называется «докинг». В ходе докинга (англ. — «стыковка») трехмерная модель химического соединения (лиганд) подстыковывается алгоритмом в трехмерную же модель белка-мишени. Лиганд примеряется и так и этак к полостям на поверхности мишени, с тем чтобы прочно влипнуть в одну из них, тем самым заблокировать биологическую функцию мишени. Опыт показывает, что алгоритмы докинга неплохо справляются со своей задачей. Однако после собственно докинга необходимо рассчитать так называемое сродство лиганда к мишени, которое определяет, как долго лиганд может в ней просидеть. Строгий расчет сродства, исходя из законов физики, занял бы работой на годы самые мощные компьютеры на земле. Поэтому для предсказания сродства в процессе виртуального скрининга используют сильно упрощенные схемы, так называемые оценивающие функции. Именно несовершенство оценивающих функций приводит к недопустимо многочисленным ошибкам при поиске потенциальных хитов.
Методология молекулярной модификации.
Молекулярная модификация представляет собой химическое изменение известного и ранее охарактеризованного соединения-лидера с целью повышения его полезности в качестве лекарственного средства . Это может означать усиление его специфичности для конкретного сайта-мишени, повышение его потенции , улучшение скорости и степени абсорбции , изменение его преимущественного хода в организме, снижение его токсичности , изменение его физических или химических свойств (например, растворимости ) до предоставить желаемые функции.
Химическая модификация (алкилирование, ацетилирование, сульфирование и тд) – самая широко используемая, с ее помощью можно улучшить, например, растворимость в воде, биоактивность соединения.
Молекулярная модификация используется для повышения растворимости лекарственного средства в воде путем включения в его состав растворимых в воде групп. Обсуждение вопроса о введении солюбилизирующих воду групп в структуру соединения свинца удобно разбить на четыре основные области:
-
Тип вводимой группы;
-
Является ли введение обратимым или необратимым;
-
Положение о регистрации; а также
-
Химический путь введения.
Тип группы
Включение полярных функциональных групп , таких как спиртовая , аминная , амидная , карбоновая , сульфокислотная и фосфатная группы, которые либо ионизируют, либо способны к относительно сильным межмолекулярным силам притяжения с водой ( водородная связь), обычно приводит к аналогам с повышенной растворимостью в воде. Кислотные и основные группы особенно полезны, так как эти группы можно использовать для образования солей, которые дают более широкий диапазон лекарственных форм для конечного продукта. Однако образование цвиттерионов путем введения либо кислотной группы в структуру, содержащую основание, либо основную группу в структуру, содержащую кислотную группу, может снизить растворимость в воде. Введение слабополярных групп, таких как эфиры карбоновых кислот , арилгалогениды и алкилгалогениды , не приведет к значительному улучшению растворимости в воде и может привести к повышению растворимости липидов.
Включение кислотных остатков в структуру свинца с меньшей вероятностью изменит тип активности, но может привести к тому, что аналог проявит гемолитические свойства. Кроме того, введение группы ароматических кислот обычно приводит к противовоспалительной активности, тогда как карбоновые кислоты с альфа-функциональной группой могут действовать как хелатирующие агенты. Основные растворимые в воде группы имеют тенденцию изменять способ действия, поскольку основания часто влияют на нейротрансмиттеры и биологические процессы с участием аминов. Однако их включение действительно означает, что аналог может быть сформулирован в виде широкого спектра кислотных солей. Неионизируемые группы не имеют недостатков кислотных и основных групп.
Обратимо и необратимо прикрепленные группы
Тип выбранной группы также зависит от требуемой степени постоянства. Группы, которые непосредственно связаны с углеродным скелетом соединения свинца менее реакционноспособными связями C – C, C – O и C – N, вероятно, будут необратимо связаны со структурой свинца.
Группы, которые связаны со свинцом сложноэфирными, амидными, фосфатными, сульфатными и гликозидными связями, с большей вероятностью будут метаболизироваться из полученного аналога, чтобы преобразовать исходное соединение свинца, поскольку аналог переносится из точки его введения в сайт его действия. Соединения с этим типом солюбилизирующей группы действуют как пролекарства, и поэтому их активность, скорее всего, будет такой же, как у исходного соединения свинца. Однако скорость потери солюбилизирующей группы будет зависеть от характера пути переноса, и это может повлиять на активность лекарственного средства.
Положение группы солюбилизации воды
Чтобы сохранить тип активности, проявляемой соединением свинца , солюбилизирующая вода группа должна быть присоединена к части структуры, которая не участвует во взаимодействии лекарственное средство-рецептор. Следовательно, путь, используемый для введения новой солюбилизирующей воды группы, и ее положение в структуре свинца будет зависеть от относительной реактивности фармакофора и остальной части молекулы. Реагенты, используемые для введения новой группы, растворимой в воде, следует выбирать на основе того, что они не вступают в реакцию с фармакофором или не находятся в непосредственной близости от него. Это снизит вероятность того, что новая группа повлияет на соответствующие взаимодействия лекарственное средство-рецептор.
Методы введения
Растворимые в воде группы лучше всего вводить в начале синтеза лекарственного средства , хотя они могут быть введены на любой стадии. Введение в начале позволяет избежать проблемы более позднего введения, изменяющего тип и / или природу взаимодействия лекарственное средство-рецептор. Для введения солюбилизирующей группы в воде может быть использовано большое разнообразие путей; выбранный вариант будет зависеть от типа вводимой группы и химической природы целевой структуры. Многие из этих путей требуют использования защитных агентов для предотвращения нежелательных реакций либо солюбилизирующей воду группы, либо структуры свинца.
Кислотные и основные группы
Примеры растворимых в воде структур и путей, используемых для их введения в свинцовые структуры. Реакции О-алкилирования, N-алкилирования, О-ацилирования и N-ацилирования используются для введения как кислотных, так и основных групп. Методы ацетилирования используют как подходящий хлорангидрид, так и ангидрид .
Примеры растворимых в воде структур и путей, используемых для их введения в свинцовые структуры. Галогениды фосфатной кислоты были использованы для введения фосфатных групп в структуры свинца. Структуры, содержащие гидроксигруппы, были введены реакцией соответствующего монохлорированного гидрина и использованием подходящих эпоксидов среди других методов. Группы сульфоновой кислоты могут быть введены либо прямым сульфированием, либо добавлением бисульфита к реакционноспособным связям C = C, среди других методов.
Биологическая и физическая модификации - изменение молекулярного веса соединения.
Аффинная модификация – один из распространенных методов анализа структуры и функции ферментов [3, 4]. Поскольку не все структурные элементы узнаваемого лиганда в равной мере существенны для его специфического узнавания, то можно изменить структуру молекулы, не нарушая значительно процесс узнавания лиганда активным центром фермента. Это свойство допускает введение в аналог субстрата реакционноспособных групп, которые могут взаимодействовать с теми или иными остатками фермента. В этом случае за образованием специфического комплекса фермента с реакционноспособным аналогом может последовать химическая реакция между реакционноспособной группой аналога и акцепторной группой белка. Это приводит к химической модификации белка и образованию ковалентного аддукта реагента с ферментом. При этом модификация произойдет в результате сближения при связывании реакционноспособного аналога субстрата и модифицируемого фрагмента белка, т. е. за счет сродства (аффинности) фермента и аналога. Реакционноспособная группа ориентируется по отношению к аминокислотному остатку/остаткам фермента благодаря специфическому взаимодействию узнающих участков субстрата с активным центром. Поэтому такая модификация может быть названа аффинной модификацией. Благодаря рассматриваемому подходу можно адресовать химическую реакцию в область активного центра или, по крайней мере, осуществить реакцию ковалентного присоединения субстрата в непосредственной близости от него. Принципиальная схема аффинной модификации представлена на рис. 10.1.

Для идентификации модифицированного аминокислотного остатка белок после модификации аффинным реагентом подвергают гидролизу, например, с помощью трипсина или других протеаз. Полученную реакционную смесь разделяют хроматографически, очищая ковалентно связанный с реагентом пептид. Затем проводят идентификацию с помощью масс-спектрометрии. Главной особенностью аффинных реагентов по сравнению с другими реагентами, использующимися для химической модификации биополимеров, является наличие двух функционально значимых элементов структуры: один из них обеспечивает специфичное нековалентное комплексообразование аффинного реагента с биополимером, а второй, собственно реакционноспособная группа – ковалентное присоединение реагента к биополимеру. Выбор химической группировки обуславливается не только природой изучаемого белка, но и целью, с которой осуществляется аффинная модификация.
