- •Аминокислоты. Пептиды. Белки
- •Физические свойства
- •Химические свойства
- •Химические свойства
- •Стереоизомерия
- •Цикло-оксо-таутомерия
- •Конформационное строение
- •1.2. Химические свойства
- •Циклические формы моносахаридов
- •2. Дисахариды
- •2.1. Строение
- •2.2. Химические свойства
- •Нуклеиновые кислоты. Строение и структура нуклеиновых кислот.
- •Пуриновые нуклеозиды: Пиримидиновые нуклеозиды:
- •7. Днк (дезоксирибонуклеиновые кислоты)
- •8. Рнк (рибонуклеиновые кислоты)
77. Аминокислоты, пептиды и белки. Пептиды. Номенклатура пептидов. Основные принципы синтеза полипептидов; защита аминогруппы и активация карбоксильной группы. Твердофазный синтез пептидов. Общие принципы определения строения пептидов и белков. Первичная, вторичная и третичная структура белков. Понятие о ферментах и ферментативном катализе.
Аминокислоты. Пептиды. Белки
Аминокислотами называются карбоновые кислоты, в углеводородном радикале которых один или несколько атомов водорода замещены аминогруппами. В зависимости от взаимного расположения карбоксильной и аминогрупп различают -, -, - и т.д. аминокислоты. Например,
CH3– |
CH–COOH - аминопропионовая кислота I NH2 |
CH2– I NH2 |
CH2–COOH - аминопропионовая кислота |
Чаще всего термин "аминокислота" применяют для обозначения карбоновых кислот, аминогруппа которых находится в - положении, т.е. для - аминокислот. Общую формулу - аминокислот можно представить следующим образом:
H2N– |
CH–COOH I R |
В зависимости от природы радикала (R) – аминокислоты делятся на алифатические, ароматические и гетероциклические.
В таблице представлены важнейшие - аминокислоты, входящие в состав белков.
Таблица. Важнейшие - аминокислоты
Аминокислота |
Сокращенное (трехбуквенное) название аминокислотного остатка в макромолекулах пептидов и белков. |
Строение R |
|
|
Алифатические |
Глицин |
Gly |
H– |
Аланин |
Ala |
CH3– |
Валин* |
Val |
(CH3)2CH– |
Лейцин* |
Leu |
(CH3)2CH–CH2– |
Изолейцин* |
Ile |
CH3–CH2–CH– I CH3 |
|
|
Содержащие OH– группу |
Серин |
Ser |
HO–CH2– |
Треонин* |
Thr |
CH3–CH(OH)– |
|
|
Содержащие COOH– группу |
Аспарагиновая |
Asp |
HOOC–CH2– |
Глутаминовая |
Glu |
HOOC–CH2–CH2– |
|
|
Содержащие NH2CO– группу |
Аспарагин |
Asn |
NH2CO–CH2– |
Глутамин |
Gln |
NH2CO–CH2–CH2– |
|
|
Содержащие NH2– группу |
Лизин* |
Lys |
NH2–(CH2)3–CH2– |
Аргинин |
Arg |
NH2–C–NH–(CH2)2–CH2– II NH |
|
|
Серусодержащие |
Цистеин |
Cys |
HS–CH2– |
Метионин* |
Met |
CH3–S–CH2–CH2– |
|
|
Ароматические |
Фенилаланин* |
Phe |
|
Тирозин |
Tyr |
|
|
|
Гетероциклические |
Триптофан* |
Trp |
|
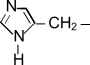
Гистидин |
His |
|
|
|
Иминокислота |
Пролин |
Pro |
|
*Незаменимые - аминокислоты
Изомерия
Наряду с изомерией, обусловленной строением углеродного скелета и положением функциональных групп, для - аминокислот характерна оптическая (зеркальная) изомерия. Все - аминокислоты, кроме глицина, оптически активны. Например, аланин имеет один асимметрический атом углерода (отмечен звездочкой),
H2N – |
H I C*–COOH I CH3 |
а значит, существует в виде оптически активных энантиомеров:
H─ |
COOH ┼─NH2 CH3 |
D- аланин
H2N─ |
COOH ┼─H CH3 |
L- аланин
Все природные - аминокислоты относятся к L– ряду.
Получение
1) Важнейший источник аминокислот – природные белки, при гидролизе которых образуются смеси - аминокислот. Разделение этой смеси – довольно сложная задача, однако по обыкновению одна или две аминокислоты образуются в значительно больших количествах, чем все другие, и их удается выделить достаточно просто.
2) Синтез аминокислот из галогенозамещенных кислот действием аммиака
Cl– |
CH–COOH + 2NH3 H2N– I R |
CH–COOH + NH4Cl I R |
3) Микробиологический синтез. Известны микроорганизмы, которые в процессе жизнедеятельности продуцируют - аминокислоты белков.