
- •Санкт-Петербургский университет
- •Исследование пожаровзрывоопасности горючих жидкостей (диоксан)
- •Общие сведения
- •Определение характеристик горения
- •Характеристика свечения пламени
- •Теоретический и практический расход воздуха на горение
- •3.Но так как условия отличаются от нормальных, следовательно, необходимо определить ,какой объем будет занимать 1 кмоль диоксан при заданных условиях
- •Объем и состав продуктов полного сгорания
- •Низшая теплота горения
- •Стехиометрическая концентрация в паровоздушной смеси
- •Расчет температуры горения
- •6.Методом интерполяции рассчитываем температуру горения:
- •Список используемых источников
3.Но так как условия отличаются от нормальных, следовательно, необходимо определить ,какой объем будет занимать 1 кмоль диоксан при заданных условиях

4.Корэффициент избытка воздуха по условию задачи
5.Практический расход воздуха равен:

Ответ: удельный теоретический расход воздуха при горении диоксана при заданных условиях составляет 6,3 , практический расход 28,98 .
Объем и состав продуктов полного сгорания
Состав продуктов горения зависит от химической природы горючего материала и условий его горения. Практически всегда органические вещества горят с образованием продуктов полного и неполного горения.
К продуктам полного сгорания относятся: углекислый газ, образующийся при горении углерода, разложении карбонатов; водяной пар, образующийся при горении водорода и испарении влаги в исходном веществе; оксид серы и азот – продукт горения соединений, содержащих серу и азот.
Продукты неполного сгорания – это оксид углерода – угарный газ, сажа, продукты термоокислительного разложения – смолы.
Выход продуктов горения количественно установить невозможно из-за чрезвычайной сложности их состава, поэтому материальный баланс процесса горения рассчитывается из предположения, что вещество сгорает полностью до конечных продуктов. При этом в состав продуктов горения включают также азот воздуха, израсходованного на горение, и избыток воздуха при α>1.
В случае, когда горючее – индивидуальное химическое соединение, объем расчета продуктов горения ведется по уравнению реакции горения:

 -
объем продуктов горения,
-
объем продуктов горения,
 -
общее число кмолей продуктов горения,
которые выделяются при сгорании одного
кмоля горючего вещества
-
общее число кмолей продуктов горения,
которые выделяются при сгорании одного
кмоля горючего вещества
 -
масса горючего вещества, кг
-
масса горючего вещества, кг
-
объем кмоля продуктов горения,

 -
молярная масса горючего вещества, кг/
-
молярная масса горючего вещества, кг/
Если горение протекает с избытком воздуха, то при расчете общего числа кмолей продуктов горения учитывается избыточное число кмолей кислорода и азота:
 - число кмолей кислорода в избытке
воздуха (остаточного кислорода);
- число кмолей кислорода в избытке
воздуха (остаточного кислорода);
 - число кмолей азота в избытке воздуха;
- число кмолей азота в избытке воздуха;
Процентный состав продуктов горения рассчитывается, исходя из общего числа кмолей продуктов горения. Если требуется рассчитать объем отдельного компонента продуктов горения, выделившегося при сгорании весового количества вещества, то такой расчет ведут по формуле:

Решение 2.3.1. Расчёт объёма и состава продуктов полного сгорания индивидуальных соединений
Определить объем и состав в объемных % продуктов горения, образовавшихся при сгорании 1 кг диоксана, если начальная температура окружающей среды 15 , давление 780 мм.рт.ст., коэффициент избытка воздуха 4,6.
Записываем уравнение реакции горения:
По уравнению реакции горения определяем количество каждого из продуктов сгорания:



Поскольку в рассматриваемом случае горение протекает с избытком воздуха α=4,6 , необходимо учесть остаточный кислород в продуктах сгорания и азот в избытке воздуха:


Таким образом, практический состав продуктов сгорания следующий:



Определяем общее количество продуктов сгорания при сжигании 1 киломоля горючего:
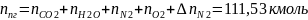
Определяем процентный состав продуктов горения:




Производим проверку : 3,6+3,6+77+15,8=100 %
Определяем общее количество продуктов сгорания при сжигании 1 кг горючего. При сжигании M=88 кг (1 кмоль) диоксана выделяется
 =
= продуктов сгорания, а также при сжигании
m кг диоксана выделяется N кмоль продуктов
сгорания, то:
продуктов сгорания, а также при сжигании
m кг диоксана выделяется N кмоль продуктов
сгорания, то:
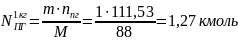
При определении общего объёма продуктов сгорания, примем, что нагретой до высокой температуры продукты сгорания отдают свою теплоту в окружающее пространство и строительным конструкциям, поэтому температура продуктов сгорания 15 .
Рассчитаем, какой объем занимает 1 кмоль газообразных веществ при заданных температуре и давлении:

Объем продуктов сгорания составит:

Ответ:
при сжигании 1 кг диоксан при заданных
условиях выделяется
 продуктов сгорания, из них:
продуктов сгорания, из них: -
- ,
,
 -
-
 -
- ,
,
 -
- .
.
Решение 2.3.2. Расчёт объёма и состава продуктов полного сгорания по элементному составу вещества
В этом случае решения данной задачи теоретический выход продуктов горения определяется как сумма продуктов горения каждого элемента, входящего в состав вещества.
После получения необходимых расчётов нужно обратиться к
Таблица 2- Теоретический выход продуктов горения элементов сложных веществ при нормальных условиях
Элемент |
Объём продуктов горения на 1 кг вещества |
|||||||||
|
|
|
|
|
||||||
кмоль |
|
кмоль |
|
кмоль |
|
кмоль |
|
кмоль |
|
|
Углерод |
0,83 |
1,86 |
|
|
|
|
|
|
0,313 |
7,0 |
Водород |
|
|
0,5 |
11,2 |
|
|
|
|
0,94 |
21,0 |
Сера |
|
|
|
|
0,031 |
0,7 |
|
|
0,118 |
2,63 |
Фосфор |
|
|
|
|
|
|
0,016 |
0,36 |
0,152 |
3,4 |
Азот в горючем |
|
|
|
|
|
|
|
|
0,036 |
0,8 |
Азот за счёт кислорода в горючем |
|
|
|
|
|
|
|
|
-0,118 |
-2,63 |
Влага в горючем |
|
|
0,056 |
1,24 |
|
|
|
|
|
|
Представить диоксан ,как вещество сложного элементного состава. Определить объем и состав в объемных % продуктов горения, образовавшихся при сгорании 1 кг диоксана, если начальная температура окружающей среды 15 , давление 780 мм.рт.ст., коэффициент избытка воздуха 4,6.
Вычислим массовые доли элементов в веществе
Mr (С4H8O2) =88 кг/кмоль
%
Найдем теоретический объём воздуха


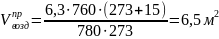
Найдем практический объём воздуха с учётом коэффициента избытка воздуха по условию задачи

Вычислим объём каждого компонента продуктов горения



‘



Определяем общий объём продуктов сгорания:

Суммарный объём продуктов горения при заданных условиях составит:

Процентный состав продуктов горения:




Проверка:

Ответ: Объём продуктов горения изопентана
при заданных условиях составляет 43,5
;
объёмные доли продуктов горения
составляют:






