
- •2. Молекулярная физика. Первое начало термодинамики. Работа, совершаемая газом.
- •6 Вопрос
- •2) Рассмотрим изохорный процесс.
- •3) Рассмотрим изотермический процесс:
- •14)Явления переноса.Диффузия.Коэффициент диффузии.Закон фика.
- •15 Вопрос
- •1.Реальные газы
- •2. Внутренняя энергия реального газа
- •3. Уравнение Ван-дер-Ваальса
- •4. Изотермы Ван-дер-Ваальса
- •30.Реальные газы. Закон Джоуля Томпсона.
Билет 1
1. Молекулярная физика. Термодинамическая система. Равновесное и неравновесное состояние. Релаксация. Процессы. Цикл. Молярная масса. Внутренняя энергия.
Термодинамическая система - совокупность тел, составляющих макроскопическую систему.
Система может находиться в различных состояниях. Величины, характеризующие состояние системы, называются параметрами состояния: давление P, температура T, объём V и так далее. Связь между P, T, V специфична для каждого тела и называется уравнением состояния.
Состояние термодинамической системы называется равновесным, если параметры системы имеют определённые значения, не изменяющиеся с течением времени и в системе нет никаких стационарных потоков, вызванных действием каких-либо внешних тел (источников).
Состояние, в котором хотя бы один из параметров не имеет определенного значения, называется неравновесным.
Термодинамические системы, которые не обмениваются с внешними телами ни энергией, ни веществом, называются замкнутыми.
Процесс – переход из одного равновесного состояния в другое. Релаксация – возвращение системы в равновесное состояние.
Время перехода – время релаксации.
Молярная масса – масса одного моля (µ). 1 моль – количество грамм вещества, равное его молекулярной массе.
![]()
Наряду с механической энергией любое тело (или система) обладает внутренней энергией.
Внутренняя энергия – энергия покоя.
Она складывается из
- теплового хаотического движения молекул,
- потенциальной энергии их взаимного расположения,
- кинетической и потенциальной энергии электронов в атомах, нуклонов в ядрах и так далее.
В термодинамике важно знать не абсолютное значение внутренней энергии, а её изменение.
В термодинамических процессах изменяется только кинетическая энергия движущихся молекул (тепловой энергии недостаточно, чтобы изменить строение атома, а тем более ядра). Следовательно, фактически под внутренней энергией в термодинамике подразумевают энергию теплового хаотического движения молекул.
Внутренняя
энергия U
одного моля идеального газа равна:
![]()
![]() Таким образом,
внутренняя энергия зависит только
от температуры.
Внутренняя энергия U
является функцией
состояния системы
независимо от предыстории
Таким образом,
внутренняя энергия зависит только
от температуры.
Внутренняя энергия U
является функцией
состояния системы
независимо от предыстории
2. Молекулярная физика. Первое начало термодинамики. Работа, совершаемая газом.
Основные понятия и исходные положения термодинамики Термодинамической системой называют совокупность макроскопических тел, которые могут обмениваться энергией между собой и с внешними телами. Физические величины (температура, давление, объём, плотность и т. д.), характеризующие состояние системы, называются параметры состояния системы.
Состояние термодинамической системы называется равновесным, если параметры системы имеют определённые значения, не изменяющиеся с течением времени и в системе нет никаких стационарных потоков, вызванных действием каких-либо внешних тел (источников). Состояние, в котором хотя бы один из параметров не имеет определенного значения, называется неравновесным. Термодинамические системы, которые не обмениваются с внешними телами ни энергией, ни веществом, называются замкнутыми.
Термодинамическим процессом называется переход системы из одного состояния в другое. Термодинамический процесс называется равновесным или квазистатическим, если все параметры системы изменяются физически бесконечно медленно, так что система всё время находится в равновесных состояниях. Равновесный процесс обладает свойством обратимости, так как при изменении направления протекания равновесного процесса он будет проходить через те же равновесные состояния, что и при в прямом направлении.
Основной постулат термодинамики: у замкнутой термодинамической системы существует состояние термодинамического равновесия, в которое она приходит с течением времени и из которого самопроизвольно выйти не может. Опр. Термодинамика – раздел физики, изучающий общие свойства макроскопических систем, находящихся в состоянии термодинамического равновесия, и процессы перехода между этими состояниями. Термодинамика не рассматривает микропроцессы, которые лежат в основе этих переходов.

Количество теплоты, сообщаемой телу, идёт на увеличение внутренней энергии и на совершение телом работы:Q= U+A– это и есть первое начало термодинамики или закон сохранения энергии в термодинамике.
Правило знаков: Q>A если тепло передаётся от окружающей среды данной системе, U>0 и A>0 если система производит работу над окружающими телами, при этом . Учитывая правило знаков, первое начало термодинамики можно записать в виде: U=Q-A– изменение внутренней энергии тела равно разности сообщаемой телу теплоты и произведённой телом работы.
Применим первый закон термодинамики к изопроцессам в газах.
В изохорном процессе (V = const) газ работы не совершает, A = 0. Следовательно,
|
Здесь U (T1) и U (T2) – внутренние энергии газа в начальном и конечном состояниях. Внутренняя энергия идеального газа зависит только от температуры (закон Джоуля). При изохорном нагревании тепло поглощается газом (Q > 0), и его внутренняя энергия увеличивается. При охлаждении тепло отдается внешним телам (Q < 0).
В изобарном процессе (p = const) работа, совершаемая газом, выражается соотношением
|
Первый закон термодинамики для изобарного процесса дает:
|
При изобарном расширении Q > 0 – тепло поглощается газом, и газ совершает положительную работу. При изобарном сжатии Q < 0 – тепло отдается внешним телам. В этом случае A < 0. Температура газа при изобарном сжатии уменьшается, T2 < T1; внутренняя энергия убывает, ΔU < 0.
В изотермическом процессе температура газа не изменяется, следовательно, не изменяется и внутренняя энергия газа, ΔU = 0.
Первый закон термодинамики для изотермического процесса выражается соотношением
|
Количество теплоты Q, полученной газом в процессе изотермического расширения, превращается в работу над внешними телами. При изотермическом сжатии работа внешних сил, произведенная над газом, превращается в тепло, которое передается окружающим телам.
Билет№3
Уравне́ние состоя́ния — уравнение, связывающее между собой термодинамические (макроскопические) параметры системы, такие, как температура, давление, объём, химический потенциал и др.
Уравнение состояния идеального газа — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа.
P=nkT
P(V-νb)= νRT --- уравнение состояния газа с учетом конечного размера молекул
P+Pi=nkT
или (P+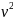 a/
a/ )V=Νrt
--- с учетом
внутеннего давления
)V=Νrt
--- с учетом
внутеннего давления
Pi не зависит от материала стенки, в противном случае удалось бы создать вечный двигатель первого рода
(P+ a/ ) (V-νb)= νRT--- данное уравнение справедливо при условии νb<<V, a/ <<P
Температу́ра — физическая величина, характеризующая термодинамическую систему и количественно выражающая интуитивное понятие о различной степени нагретости тел. Температура - физическая величина, характеризующая среднюю кинетическую энергию частиц макроскопической системы, находящейся в состоянии термодинамического равновесия. В равновесном состоянии температура имеет одинаковое значение для всех макроскопических частей системы. Абсолютная температура это температура, измеряемая в Кельвинах
T=t+273(K)
Внутренняя энергия идеального газа — в идеальных газах внутренняя энергия определяется как сумма кинетических энергий молекул. Между молекулами идеального газа отсутствуют силы притяжения и потенциальная энергия взаимодействия равна нулю. Это означает, что внутренняя энергия идеального газа рассматривается как сумма всех кинетических энергий молекул.
Внутренняя энергия U равна сумме свободной и связанной энергии(TS)
U=F+TS
Свободная энергия – максимальная возможная работа, которую может совершить система, обладая каким-то запасом внутренней энергии.
Связанная энергия – это та часть внутр. энергии, которая не может быть переведена в работу это бесценная часть внутренней энергии.
Теплоёмкость идеального газа — отношение количества теплоты, сообщённого газу к изменению температуры , которое при этом произошло
Молярная теплоёмкость — теплоёмкость 1 моля идеального газа.
δQ=νC∆T
Cm=(1/ ν) (δQ/∆T)
Адиабатический
В адиабатическом процессе теплообмена с окружающей средой не происходит, то есть dQ=0. Однако, объём, давление и температура меняются, то есть dT≠0.
Следовательно, теплоёмкость идеального газа в адиабатическом процессе равна нулю: C=0/dT=0;
Изотермический
В изотермическом процессе постоянна температура, то есть dT=0 . При изменении объёма газу передаётся (или отбирается) некоторое количество тепла. Следовательно, теплоёмкость идеального газа равна плюс-минус бесконечности:C→-∞;
Изохорный
В изохорном процессе постоянен объём, то есть dV=0.
Элементарная работа газа равна произведению изменения объёма на давление, при котором происходит изменение (δA-δVP).
Первое Начало Термодинамики для изохорного процесса имеет вид:
dU=δQ=ν ∆T;
∆T;
А для идеального газа
dU=(i/2) νR∆T;
Таким образом,
=(i/2)R;
Где i— число степеней свободы частиц газа.
Другая формула:
=R/(γ-1)
Где γ — показатель адиабаты, R — универсальная газовая постоянная.
Изобарный
Молярная теплоёмкость
при постоянном давлении обозначается
как
 .
В идеальном газе она связана с теплоёмкостью
при постоянном объёме соотношением
Майера
.
В идеальном газе она связана с теплоёмкостью
при постоянном объёме соотношением
Майера
= +R
Молекулярно-кинетическая теория позволяет вычислить приблизительные значения молярной теплоёмкости для различных газов через значение универсальной газовой постоянной:
для одноатомных газов =5/2R то есть около 20.8 Дж/(моль·К);
для двухатомных газов =7/2R то есть около 29.1 Дж/(моль·К);
для многоатомных газов =4R то есть около 33.3 Дж/(моль·К).
Теплоёмкости можно также определить исходя из уравнения Майера, если известен показатель адиабаты, который можно измерить экспериментально (например, с помощью измерения скорости звука в газе или используя метод Клемана — Дезорма).
Билет 4 Термодинамические параметры состояния. Равновесные и неравновесные процессы.
Совокупность физических свойств системы в рассматриваемых условиях называют термодинамическим состоянием системы.
К основным параметрам состояния, поддающимся непосредственному измерению простыми техническими средствами, относятся абсолютное давление P, удельный объём v и абсолютная температура T. Эти три параметра носят название термических параметров состояния.
К
параметрам состояния относятся также
внутренняя энергия U, энтальпия
H и
энтропия ![]() ,
которые носят название калорических
параметров состояния.
,
которые носят название калорических
параметров состояния.
Различают равновесные и неравновесные процессы.
Равновесным процессом называется термодинамический процесс, представляющий собой непрерывную последовательность равновесных состояний. В таком процессе физические параметры изменяются бесконечно медленно, так что система все время находится в равновесном состоянии. Кроме того, все части системы имеют одинаковые температуру и давление.
Неравновесным процессом называется термодинамический процесс, представляющий собой последовательность состояний, среди которых не все являются равновесными. В неравновесном процессе различные части системы имеют разные температуры, давления, плотности, концентрации.
Если термодинамическая система выведена из состояния равновесия и предоставлена сама себе, то через некоторый промежуток времени она снова придет в состояние равновесия. Процесс перехода системы из неравновесного состояния в равновесное называется релаксацией, а время перехода в состояние равновесия — временем релаксации.
