
Билет №13
1, Буферлік жүйелер. Электролититік диссоциация теориясы және протолиттік теория көзқарасымен буферлік әрекет механизмі. Буферлік жүйелердің негізгі теңдеулері. Буферлік жүйелердің рН мәндерін Гендерсона-Гессельбах теңдеулерімен есептеу.
Биологиялық
сұйықтарда ортаның қышқылдығы маңызды
орын аплады.Су адамның артерия қаны
плазмасының pH![]() 0,2 –0,3 –ке ғана өзгерісі ауыр науқасқа
ұшыратуы мүмкін
0,2 –0,3 –ке ғана өзгерісі ауыр науқасқа
ұшыратуы мүмкін
Адамның қан жүйесінде сутектік көрсеткішті реттеп отыратын арнаулы жүйелер бар,соның бірі буферлік жүйе .
Электролититік диссоциация заттың молекулаларының еріткіштің полярлы молекулаларымен электростатикалық әрекеттесуі барысында заттың иондарға ыдырау процесі.
Протолиттік буферлік жүйеле:
Сұйылтқанда
Аздаған мөлшерде күшті қышқыл қосқанда;рН тың мәнін тұрақты қалпында сақтайтын жүйе
Буферлік ерітіндінің сутектік көрсеткіші Гендерсон-Гассельбахтың теңдеуі арқылы анықталады. Бұл теңдеу б/ша әлсіз қышқылмен өлсіз негізбен ыдырау константалар қолданылыады.
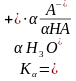
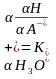
Егер
ерітіндінің иондық куші нольге тең боса
, НА активтілігі бірге тең болған жағдайда
:а![]() с,
с,
![]()
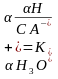

Қышқылдың буферлік жүйесінің сутектік көрсеткішін былай есептеуге болады:
|
Буферлік жүйелер дегеніміз сыртан әсері болғанда өзінің қандайда бір параметірінің шамасын өзгертпей тұрақты қалпында сақтайтын жүйелер. Ол адамның қанның жүйесінде сутек көрсеткішті реттеп отыратын арнаулы жүйелері бар, соның бірі буферлік жүйе. Буф жүй негізі қасиетінің бірі орта қышқылдын сілтінің қосылуына н/е Сүйылуына қарамастан сутектік көрсеткішті турақты етіп отыруб , бұл жүйенің құрамынна байланысты бірнеше түрге бөлінеді. 1.Әлсіз ыдырайтын қышқыл осы қышқылдын күшті негізбен түзетін тұзы (H CO Na HCO) 2.Әлсіз негіз осы негіздің күшті қышқылмен түзетін тұзы (NH OH NH HCL) 3.Амфотерлі ( HN CH COO ) Электролиттер ерткенде н/е балқытқанда иондарға ыдырайтын ж/е өз бойынан электір тоғын өткізетін заттар. Электорлиттін диссоциация заттын молекулаларының еркіштің полярлы молекулаларымен электростатикалық әрекеттесуі. Протолиттік буферлік жүйе сұйылтқанда Аздаған мөлшерде күшті қышқыл қосқанда РНтің мәнін тұрақты сақтайтын қалпында сақтайтын жүйе Протолит буферлік жүйелер жіктеледі. Қышқылдың буферлер ацетаты СН СООН СН СОО Na Негіздік сілтілік амалшақты NH OH NH CL Буферлік ертіндінің әсер ету механизмі ; Күшті қышқыл қосқанда HCL тұзбен CH COONa әрекеттеседі; нәтежесінде күшті қышқылға эквиваленті мөлшеріде әлсіз қышқыл түзіледі сірке қышқылының концентрациясы көбейеді ал диссоциациялану дірежесі төмендейді сондықтан да сутек иондарының концентрацясы ж/е ертіндінің рН ң өзгеріссіз қалады.
Гендерсон Гассельбах теңдеуі Қышқылдың буферлер үшін рН рКа pH=pKa-Lg Ca Va C C V
Сілтілік буферлер үшін PH=14-pKb-Lg C V . . C V
РНҚ мен ДНҚ нуклеотидтік құрамы. Нуклеин қышқылдарының гидролизі. ДНҚ–ның екіншілік құрылымы. ДНҚ–ның биологиялық функциясындағы комплементарлық әсерлердің ролі. РНҚ түрлері.
2)ДНҚ нуклеоидтың құрамы пуримидиндік негіздердің саны приминдік негіздердің санына тең А+Г =Ц+Т Пуримидиндік негіздердің lшы орындардағы оксо топтардың санына тең демек А+Ц= Г+Т адининің саны цитозиннің санынна тең А+Т=Г+Т
Бұл ережеге кейбір РНҚ құрамы сәйкес келмеуі мункін.
РНҚ түрлері Организмде РНҚ рибосомалауда, жасушалардың протоплазмасында болады. Олар белоктың синтезіне тікелей қатысады. тРНҚ мРНҚ ж/е рРНҚ бөлігі болды.тРНҚ барлық РНҚдың 10-20 құрайды. Олардың құрамынна 78-80нуклвотидер кіреді.
ДНҚ ның екінші реттік құрылымы 1953. жылы америка ғалымдары генетик Дж.Уотсон ж/е агылшын физигі Ф.Крик модел бойынша ДНҚ қос полимерлік тізбектен тұрады ж/е бұл екі тізбектің бағыты біріне бір қарама қарсы. Әрбір тізбек .. нуклеотидтің әртүрлі орналасыунан тұрады. Бір тізбектегі нуклеотидтің орналасуы өз бетінше, емен еркін болса, екінші тізбектегі нуклеотитердің орны бірінші тізбектегі нуклеотидтердің орыннына тәуелді болады. ДНҚ тізбегіндегі нуклотидтер біріне бірі комплементарлық принципке негізделіп орналасқан.

