
- •3. Реакция дезаминирования - эта реакция является процессом удаления аминогруппы путем окислительного, восстановительного, гидролитического или внутримолекулярного дезаминирования.
- •4. Переаминирование или трансаминирование ак - это путь синтеза необходимых ак из -кетокислот.
- •Билет 2
- •Биологическая роль кобальта (цианокоболамина)
- •2Вопрос
- •Классификация моносахаридов
- •Буферная система-это равновесная система, способная поддерживать примерно на постоянном уровне какой либо параметр при определенных внешних воздействиях.
- •При добавлении соляной кислоты к ацетатному буферу происходит взаимодействие соляной кислоты с одним из компонентов, в частности, с ацетатом натрия ch3cooNa:
- •Кислотные буферные системы, сост. Из слабой кислоты и ее солей сильного основания. Например:
- •Слабое основание и его соли, образованной сильной кислотой.
- •Va(Vb) –объем раствора кислоты(основания)
- •Концентрация компонентов
- •Отношение концентрации компонентов
- •Эфиры глюкозы и фосфорной кислоты различной степени замещения {г-po3Na2; г-po3NaH. Она способствует сохранению постоянства pH в организме.
- •В медицине кислотно-щелочное равновесие организма оценивают с помощью уравнения Гендерсона-Гассельбаха, выведенного для карбонатного буфера:
- •Т.Е., благодаря буферному действию вышеуказанных систем pH крови в норме практически не меняется, несмотря на поступление извне значительных количеств сильных кислот и щелочей.
- •Билет 11
- •4. Энергия Гиббса. (g).
Билет 1
Буферная система-это равновесная система, способная поддерживать примерно на постоянном уровне какой либо параметр при определенных внешних воздействиях.
Механизм буферного действия заключается в способности буферных систем поддерживать постоянство pH за счет того, что избыток протонов H+ или гидроксид-анионов OH-, поступающих в организм, связывается буферными компонентами в слабодиссоциирующие соединения. Рассмотрим механизм буферного действия на примере ацетатного буфера:
{CH3COOHCH3COO-+H+; CH3COONaCH3COO-+Na+.
При добавлении соляной кислоты к ацетатному буферу происходит взаимодействие соляной кислоты с одним из компонентов, в частности, с ацетатом натрия CH3COONa:
HCl+CH3COONa= CH3COOH+NaCl.
Т.е. избыточные протоны H+ соляной кислоты свяжутся в слабодиссоциирующую уксусную кислоту и pH почти не изменится.
Классификация протолитических буферных систем:
Кислотные буферные системы, сост. из слабой кислоты и ее солей сильного основания. Например:
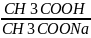
Слабое основание и его соли, образованной сильной кислотой.
Например:

СН3COOH;CH3COONa -ацетатный буфер
Н2СO3;NaHCO3 –бикарбонатный буфер
NH4OH;NH4Cl –аммиачный буфер
NaH2PO4;Na2HPO4 –фосфатный буфер
Уравнение Гендерсона-Гассельбаха
Для кислотного буферного раствора;

Для основного
буферного раствора;


Где Са(Сb)-концентрация раствора кислоты(основания)
Cs -концентрация раствора соли
Va(Vb) –объем раствора кислоты(основания)
Vs -объем раствора соли
 =-lgKa
– кислотный показатель
=-lgKa
– кислотный показатель
 =-lgKb
– основной показатель
=-lgKb
– основной показатель
Буферная ёмкость- это величина характеризующая способность буферного раствора противодействовать изменению реакции среды при добавлении сильных кислот или сильных оснований.


Ca- концентрация эквивалента сильной кислоты
Va- объем добав. сильной кислоты
Факторы влияющие на буферную емкость раствора
Концентрация компонентов
Отношение концентрации компонентов
При разбавлении буферная емкость уменьшается чем больше концентрация компонентов буфера тем больше буферная емкость.
Самой большой буферной емкостью и по кислоте и по щелочи обладает буферная система, когда соотношение компонентов =1.
Белковая буферная система - главный внутриклеточный буфер. Он составляет примерно 3 четверти буферной емкости внутриклеточной жидкости.
Компонентами белкового буфера явл-ся слабодисациирующий белок с кислыми св-ми (белок СООН) и соли сильного основания (белок COONa). При нарастании уровня кислот они взаимодействуют с солью белка с образованием нейтральной соли и слабой кислоты. При увеличении концентрации оснований реакция их происходит с белком с кислыми св-ми. В рез-те вместо сильного основания образуется слабоосновная соль.
Гемоглобиновая буферная система {HHbH++Hb-; KHbK++Hb- обладает самой большой величиной буферной емкости. Действует в эритроцитах крови. Ее буферная емкость () составляет 75% от всей буферной емкости крови.
Оксигемоглобиновая буферная система {HHbO2H++HbO2-; KHbO2K++HbO2- имеет такую же величину буферной емкости, как и гемоглобиновая буферная система.
Эфиры глюкозы и фосфорной кислоты различной степени замещения {Г-PO3Na2; Г-PO3NaH. Она способствует сохранению постоянства pH в организме.
Карбонатная буферная система {H2CO3H++HCO3-; NaHCO3Na++HCO3-. Характеризует кислотно-щелочной резерв крови. Действует в плазме крови и в эритроцитах.
В медицине кислотно-щелочное равновесие организма оценивают с помощью уравнения Гендерсона-Гассельбаха, выведенного для карбонатного буфера:
pH=pK+lg([HCO3-]/[H2CO3]).
Опытным путем было найдено, что в крови здорового человека pK=6,11 и pH=7,34-7,36, рабочая формула крови человека: pH=6,11+lg([HCO3-]/[CO2]).
Т.е., благодаря буферному действию вышеуказанных систем pH крови в норме практически не меняется, несмотря на поступление извне значительных количеств сильных кислот и щелочей.
Ацидоз-смещение кислотно-щелочного баланса организма в сторону увеличения кислотности.
Алкалоз-увеличение рН крови за счет накопления щелочных веществ.
Щелочной резерв крови: представляет собой объем(мл) химически связанного диоксида углерода СО2 (главным образом в виде гидрокарбонатов) в 100 мл плазмы крови; измеряется в объемных процентах; в норме составляет 50-70 объемных процентов (25-30 моль/л).
2))) -аминокислоты можно рассматривать как производные карбоновых кислот, в молекулах которых один из атомов водорода замещен аминогруппой (NH2). Общее число АК достигает 300, но из них выделяют группу 20-ти наиболее важных -АК, встречающихся в составе белков животного и растительного происхождения.
Для аминокислот характерна стереоизомерия. Асимметричным является -углеродный атом, т.к. с ним связаны четыре различные химические группы, в этом случае для каждой -аминокислоты существует две возможные конфигурации – D- и L-энантиомеры. В белках встречаются только L-изомеры -аминокислот. Это имеет важнейшее значение для формирования пространственной структуры белков и проявления ими биологической активности. С этим непосредственно связана стереоспецифичность действия ферментов.
I. Моноаминокарбоновые(Глицин, аланин, валин, лейцин, изолейцин)
II. Моноаминодикарбоновые (Аспарагиновая ,Глутаминовая)
III. Диаминомонокарбоновые(лизин, аргинин)
IV. Оксиаминокислоты(содержащие ОН-гр(серин, треонин))
V. Серосодержащие(цистеин, метионин)
VI. Ароматические(фенилаланин, тирозин)
VII. Гетероциклические(триптофан, гистидин)
Особое место среди гетероциклических -аминокислот занимают пролин и его гидроксипроизводные, являющиеся иминокислотами. В них -аминокислотный фрагмент входит только в состав пирролидинового цикла(пролин, гидроксипролин)
АК - это гетерофункциональные органические соединения, вступающие в реакции, характерные для карбоксильных групп, аминогрупп, и проявляющие ряд специфических биохимических свойств.
свойств.
1. Как амфолиты АК образуют соли при взаимодействии с кислотами и основаниями. [аланин с NaOH= натриевая соль аланина; с HCl= солянокислый аланин, (АК5)]
2. Реакция декарбоксилирования АК - это ферментативный процесс образования биогенных аминов из соответствующих -АК. Декарбоксилирование происходит с участием фермента - декарбоксилазы и кофермента (KoF) - перидоксаль фосфата. [серин= этаноламин+ угл. газ, (АК7)] Этаноламин участвует в синтезе фосфолипидов.
[гистидин= гистамин+ угл. газ, (АК8)] Гистамин является медиатором аллергических реакции организма. При декарбоксилировании глутаминовой АК образуется ГАМК (гамма-аминомасляная кислота), которая является медиатором торможения нервной системы.
3. Реакция дезаминирования - эта реакция является процессом удаления аминогруппы путем окислительного, восстановительного, гидролитического или внутримолекулярного дезаминирования.
4. Переаминирование или трансаминирование ак - это путь синтеза необходимых ак из -кетокислот.
Последовательность -АК в составе пептидов или белков определяет их первичную структуру. Если полипептид содержит менее 100 остатков АК, то его называют пептид, более - белок.
В 1950г. Полинг и Корн показали, что наиболее выгодной конформацией полипептидной цепи является правозакрученная -спираль.
Основной вклад в закрепление этой конформации цепи вносят водородные связи, формирующиеся между параллельными участками пептидных групп.
Известна другая вторичная структура белка: -структура в виде складчатого листа. Кроме водородных связей вторичная структура стабилизуется дисульфидными мостиками по месту цистеиновых остатков.
Третичная структура является более сложной пространственной организацией макромолекулы, которая стабилизируется водородной связью, дисульфидными мостиками, электростатическими взаимодействиями и силами Ван-дер-Ваальса.
По третичной структуре белки делят на:
- глобулярные - для них характерна -спиральная структура, уложенная в пространстве в виде сферы – глобулы (пр. яичный белок, фермент - глобин в составе гемоглобина);
- фибриллярные - для них характерна -структура.
Четвертичная структура известна для некоторых белков, выполняющих важные физиологические функции.
Доказано, что являться переносчиком кислорода гемоглобин может только при наличии четвертичной структуры глобина.
В последнее время аминокислоты и их производные нашли широкое применение в лечебной практике, напр., метионин – в лечении ряда заболеваний печени, глутаминовая кислота – в лечении некоторых поражений мозга. Наконец, ряд аминокислот и продукты их метаболизма оказывают регулирующее влияние на многие физиологические функции организма.
Билет 2
1)Электролитическая диссоциация – процесс распада электролита на ионы при его растворении или плавления.
Диссоциация в растворах:
Диссоциация на ионы в растворах происходит в следствии взаимодействия растворенного вещества с растворителем: по данным спектроскопических методов, это взаимодействие носит в значительной мере химический характер. Наряду с сольватирующей способностью молекул растворителя определяющую роль в электролитической диссоциации играет также макроскопическое свойство растворителя – его диэлектрическая проницаемость.
Диссоциация при плавлении:
Под действием высоких температур ионы кристаллической решетки начинают совершать колебания, кинетическая энергия повышается, и наступит такой момент ( при температуре плавления вещества), когда она превысит энергию взаимодействия ионов. Результатом этого является распад вещества на ионы.
Закон разведения Оствальда: Степень диссоциации слабых бинарных электролитов обратно пропорциональна корню квадратному из их концентрации или прямо пропорциональна корню квадратному из разведения:
K=Ca2/1-α, K=Ca2 => α=±√K/C
Теория сильных электролитов:
Сильные электролиты – химические соединения, молекулы которых в разбавленных растворах практически полностью диссоциированы на ионы. Степень диссоциации таких электролитов близка к 1. К сильным электролитам относятся многие неорганические соли, некоторые неорганические кислоты и основания в водных растворах, а также растворителях, обладающих высокой диссоциирующей способностью (спирты амиды и др.). Примеры сильных электролитов: некоторые кислоты (HClO4, HMnO4, H2SO4, HCl, HBr, HJ) , гидроксиды щелочных и щелочноземельных металлов (NaOH, KOH, Ba(OH)2, большинство солей.
Кислотно-основное равновесие – относительное постоянство соотношения кислота – основание внутренней среды живого организма, является составной частью гомеостаза. Кислотно-основное равновесие, обеспечивающее постоянство значении рН водных растворов организма, необходимое для нормального протекания биохимических процессов, обеспечиваются буферными системами жидкостей организма.
Согласно протолитической теории Бернстеда-Лоури, кислотами называют вещества, отдающие протоны, а основаниями – вещества, принимающие протоны. Протон не может существовать в растворе самостоятельно, он должен быть принят основанием, поэтому, чтобы кислота могла отдать протон, необходимо присутствие основания, к которому протон переходит. Таким образом, возникают кислотно-основные пары, которые называют сопряженными.
Константа диссоциации воды, равная произведению концентрации протонов гидроксид-ионов, называется ионным произведением воды.
Водородный показатель (pH)-количественная мера характеристика кислотности среды, равная отрицательному десятичному логарифму концентрации свободных ионов водорода в растворе
Колометрический метод определения pH-в основном сводится к подбору ряда индикаторов с различным значением pH, зона перемены окраски которая могла бы охватывать значения рН в пределах от 0 до 14
Сильные электролиты – все кислоты и основания, константы ионизации которых больше 10–2.
В водных растворах концентрации ионов Н+ и ОН– взаимосвязаны выражением ионного произведения воды
Кв = Кд[H2O] = 1,810–1655,49 = 10–14
[H+] [OH–] = 10–14
Концентрации ионов Н+ (ОН–) и, следовательно, рН растворов слабых кислот (оснований) определяется не только концентрацией раствора, но и константой ионизации кислоты (основания), т.е. природой электролита.
2) -аминокислоты можно рассматривать как производные карбоновых кислот, в молекулах которых один из атомов водорода замещен аминогруппой (NH2). Общее число АК достигает 300, но из них выделяют группу 20-ти наиболее важных -АК, встречающихся в составе белков животного и растительного происхождения.
Для аминокислот характерна стереоизомерия. Асимметричным является -углеродный атом, т.к. с ним связаны четыре различные химические группы, в этом случае для каждой -аминокислоты существует две возможные конфигурации – D- и L-энантиомеры. В белках встречаются только L-изомеры -аминокислот. Это имеет важнейшее значение для формирования пространственной структуры белков и проявления ими биологической активности. С этим непосредственно связана стереоспецифичность действия ферментов.
I. Моноаминокарбоновые(Глицин, аланин, валин, лейцин, изолейцин)
II. Моноаминодикарбоновые (Аспарагиновая ,Глутаминовая)
III. Диаминомонокарбоновые(лизин, аргинин)
IV. Оксиаминокислоты(содержащие ОН-гр(серин, треонин))
V. Серосодержащие(цистеин, метионин)
VI. Ароматические(фенилаланин, тирозин)
VII. Гетероциклические(триптофан, гистидин)
Особое место среди гетероциклических -аминокислот занимают пролин и его гидроксипроизводные, являющиеся иминокислотами. В них -аминокислотный фрагмент входит только в состав пирролидинового цикла(пролин, гидроксипролин)
АК - это гетерофункциональные органические соединения, вступающие в реакции, характерные для карбоксильных групп, аминогрупп, и проявляющие ряд специфических биохимических свойств.
свойств.
1. Как амфолиты АК образуют соли при взаимодействии с кислотами и основаниями. [аланин с NaOH= натриевая соль аланина; с HCl= солянокислый аланин, (АК5)]
2. Реакция декарбоксилирования АК - это ферментативный процесс образования биогенных аминов из соответствующих -АК. Декарбоксилирование происходит с участием фермента - декарбоксилазы и кофермента (KoF) - перидоксаль фосфата. [серин= этаноламин+ угл. газ, (АК7)] Этаноламин участвует в синтезе фосфолипидов.
[гистидин= гистамин+ угл. газ, (АК8)] Гистамин является медиатором аллергических реакции организма. При декарбоксилировании глутаминовой АК образуется ГАМК (гамма-аминомасляная кислота), которая является медиатором торможения нервной системы.
3. Реакция дезаминирования - эта реакция является процессом удаления аминогруппы путем окислительного, восстановительного, гидролитического или внутримолекулярного дезаминирования.
4. Переаминирование или трансаминирование АК - это путь синтеза необходимых АК из -кетокислот.
Последовательность -АК в составе пептидов или белков определяет их первичную структуру. Если полипептид содержит менее 100 остатков АК, то его называют пептид, более - белок.
В 1950г. Полинг и Корн показали, что наиболее выгодной конформацией полипептидной цепи является правозакрученная -спираль.
Основной вклад в закрепление этой конформации цепи вносят водородные связи, формирующиеся между параллельными участками пептидных групп.
Известна другая вторичная структура белка: -структура в виде складчатого листа. Кроме водородных связей вторичная структура стабилизуется дисульфидными мостиками по месту цистеиновых остатков.
Третичная структура является более сложной пространственной организацией макромолекулы, которая стабилизируется водородной связью, дисульфидными мостиками, электростатическими взаимодействиями и силами Ван-дер-Ваальса.
По третичной структуре белки делят на:
- глобулярные - для них характерна -спиральная структура, уложенная в пространстве в виде сферы – глобулы (пр. яичный белок, фермент - глобин в составе гемоглобина);
- фибриллярные - для них характерна -структура.
Четвертичная структура известна для некоторых белков, выполняющих важные физиологические функции.
Доказано, что являться переносчиком кислорода гемоглобин может только при наличии четвертичной структуры глобина.
В последнее время аминокислоты и их производные нашли широкое применение в лечебной практике, напр., метионин – в лечении ряда заболеваний печени, глутаминовая кислота – в лечении некоторых поражений мозга. Наконец, ряд аминокислот и продукты их метаболизма оказывают регулирующее влияние на многие физиологические функции организма.
Билет 3.
Высокомолекулярные соединения(вмс)-это соединения состящие из больших молекул(макромолекул) и имеющие молекулярную массу порядка 10 в степени 4 - 10 в степени 6 а.е.м. и выше.
Классификация ВМС по происхождению:
Природные(биополимеры) белки, нуклеиновые кислоты, полисахариды, пектины и др.
Синтетические получаемые в процессе полимеризации и поликонденсации мономеров (синтетические каучуки, пластмассы, синтетические волокна).
Классификация ВМС по строению полимерной цепи:
Линейные, построенные из длинных цепей одномерных элементов
Разветвленные имеющие цепи с боковыми ответвлениями
Пространственные образующие единую трехмерную сетку
Пространственные со сшитой структурой цепи которых связаны короткими мостиковыми химическими связями через атом кислорода или серы.
Классификация по типу атомов, входящих в главную цепь макромолекулы:
Карбоцепные
Гетероцепные
Ограниченное набухание-это самопроизвольный процесс проникновения растворителя в полимер сопровождающиеся увеличением его массы и объема до определенны значений.
Неограниченное набухание- это процесс приводящий к разрыву межмолекулярных связей полимеров с образованием его истинного раствора.
Факторы влияющие на степень набухания:
Природа полимера; природа растворителя; присутствие электролитов; температура; рН среды.
Застудневание-это процесс перехода раствора полимера в студень вследствие ограниченного набухания или частичного испарения растворителя из раствора.
Синерезис-самопроизвольный необратимый процесс сжатия и уплотнения пространственной структурной сетки полимера и выделения жидкой фазы приводящий к уменьшению объема студня с сохранением его прежней формы.
Коацервация-процесс слияния водных оболочек нескольких частиц без объединения самих частиц.
Высаливание-выделение ВМС из раствора под влиянием концентрированных растворов электролитов.
Изоэлектрическая точка- это значение рН при котором суммарный заряд полимера равен нулю, обозначается ИЭТ или рI
Осмотическое давление – по величине выше чем это требует закон Вант Гоффа так ка макромолекула ВМС в растворе из за своей гибкости ведет себя как несколько коротких молекул; рассчитывается по уровню Галлера.
Уравнение Галлера
Пи= CRT/M + KCв степени 2
Где С-массовая концентрация полимера
К- константа отражающая свойства растворителя и характеризующая отклонение осмотического давления раствора полимера от закона Вант-Гоффа.
Онкотическое давление это часть осмотического давления плазмы крови обусловленная наличием в ней молекул белка.
Мембранное равновесие Доннана это равновесие которое устанавливается в системе растворов разделенных мембраной непроницаемой хотя бы для одного вида присутствующих в системе ионов.
Удельная вязкость-это относительное увеличение вязкости растворителя за счет введения растворенного вещества
Уравнение Штаудингера- это зависимость удельной вязкости от молекулярной массы полимера
уд=КМС, где:
К – константа;
С – концентрация ВМВ в растворе;
М – молекулярная масса ВМВ.
Уравнение Марка Куна Хаувинка [n ]=КМ а вверху
Вязкость крови определяется содержанием в крови белков и форменных элементов
Зависит от размера кровеносных сосудов
При заболеваниях печени(циррозе) или длительном ограничении потребления белка в плазме крови понижается подержание альбуминов что увеличивает вязкость крови. Это вызывает нарушения работы сердца, функции сердечно сосуд системы, всех обменных процессов.
К липидам относят сложные органические вещества растительного и животного происхождения, разнородные по составу и выполняющие в организме разнообразные функции. Они нерастворимы в воде, но растворяются в неполярных или малополярных растворителях (бензол, эфиры и др.).
По способности к гидролизу липиды классифицируют на:
1. омыляемые или подвергающиеся гидролизу;
2. неомыляемые - гидролизу не подвергающиеся.
Омыляемые липиды в свою очередь делятся на:
1. простые, которые содержат остатки спиртов и высших карбоновых кислот;
2. сложные. Они кроме названных компонентов включают остатки фосфорной кислоты, углеводы и др.
Простые липиды включают:
1. воска - это сложные эфиры высших одноатомных спиртов и высших жирных кислот. Выполняют защитные функции. Напр. ланалин предохраняет кожу и волосы от воздействия влаги; растительный воск защищает плоды и листья от воздействия воды и микроорганизмов; пчелиный воск или мерицилпальмитат С15Н31-СО-О-С31Н63.
2. жиры и масла - это сложные эфиры глицерина и высших жирных кислот, в которых все 3 гидроксида этерифицированы (оцилированы). В природе встречаются в основном полные эфиры глицерина, поэтому их называют триглицериды (триацилглицерины). Они делятся на простые, включающие остатки одной и той же кислоты, и смешанные, включающие остатки различных кислот.
Пр. простого - триолеин (триолеилглицерин) (лип1)
смешанного – 1-пальмито-2-олеостеарин (1-пальмитоил-2-олеоил-3-стеароинглицерин) (лип2)
Твердые жиры содержат предельные карбоновые кислоты (пальмитиновую, стеариновую и др.), а жидкие (масла) - непредельные кислоты (олеиновая, ленолевая). Так оливковое масло содержит 84% олеиновой кислоты.
Т.о. в состав природных жиров входят жирные кислоты с числом атомов углерода от 16 до 18 (число четное), их структура не разветвлена. При этом организм синтезирует только предельные и олеиновые кислоты, остальные поступают с пищей, особенно с растительными маслами.
Содержание в жирах и маслах непредельных кислот характеризуют йодным числом, которое показывает, какая масса иода в граммах присоединяется к 100г масла или жира по месту разрыва двойных связей. Условно в медицине жирами считаются те триглицериды, йодное число которых меньше 70г. Если йодное число больше 70г, то это масло.
Биологическая роль и функции жиров
1. жиры являются основными компонентами клеточных мембран;
2. участвуют в регуляции деятельности гормонов, ферментов, процессах биологического окисления, транспорта веществ. Примерно 50% массы мозга составляют липиды;
3. хорошие растворители ряда биологически активных веществ: витамины А, Д, Е, К и др., что способствует всасыванию их в кишечнике и усвоению в организме;
4. энергетическая - при окислении 1г жира выделяется 37,7-39,8 кДж энергии. Скандий - 29,5 кДж;
5. защищают организм от охлаждения и ушибов;
Билет 4
1. А)
Дисперсная система -это система ,состоящая из дисперсной фазы и дисперсной среды .
Дисперсная фаза-это вещество,находящееся в сильно измельченном состоянии (мельчайшие твердые частицы , капельки жидкости,пузырьки газа.и др) и равномерно распределенное в дисперсионной среде .
Дисперсионная среда -это однородное вещество (жидкость .газ . твердое вещество), в котором равномерно распределены частицы дисперсной фазы.
Примеры дисперсных систем организма:
*Лиофильные связнодисперсные-цитоплазма,вещество мозга ,водянистое содержимое глазного яблока,мышцы и тд.
*Лиофильные свободно дисперсные- растворы белков в составе лимфы ,крови,спинномозговой жидкости .
*Лиофобные -золи труднораствооримых фосфатов и карбонатов кальция,солей мочевой кислоты ,холестерина ,билирубина,липидов.
Б )
Классификация дисперсных систем по агрегатным состояниям фаз.
Дисперсион-ная среда |
Дисперс-ная фаза |
Примеры дисперсных систем |
Твердая |
Твердая |
Рубиновое стекло; пигментированные волокна; сплавы; рисунок на ткани, нанесенный методом пигментной печати |
Твердая |
Жидкая |
Жемчуг, вода в граните, вода в бетоне, остаточный мономер в полимерно-мономерных частицах |
Твердая |
Газо- образная |
Газовые включения в различных твердых телах: пенобетоны, замороженные пены, пемза, вулканическая лава, полимерные пены,пенополиуретан |
Жидкая |
Твердая |
Суспензии, краски, пасты, золи, латексы |
|
|
|
Жидкая |
Жидкая |
Эмульсии: молоко, нефть, сливочное масло, маргарин, замасливатели волокон |
Жидкая |
Газо- образная |
Пены, в том числе для пожаротушения и пенных технологий замасливания волокон, беления и колорирования текстильных материалов |
Газообразная |
Твердая |
Дымы, космическая пыль, аэрозоли |
Газообразная |
Жидкая |
Туманы, газы в момент сжижения |
Газообразная |
Газо- образная |
Коллоидная система не образуется |
Классификация дисперсных систем по степени дисперсности :
грубудисперсные системы (акварельные краски,туман,молоко),истинные растворы (молекулярные и онные) ( водные растворы кислот,солей ,щелочей,раствор сахара), коллоидные растворы(зали) ( кровь)
Классификация дисперсных систем по взаимодействию дисперсной фазы и дисперсной среды :
*лиофильные золи
*лиофобные золи
Дисперсионные методы получения дисперсных систем 1. Механический Твердые тела дробятся в специальных дробилках, жерновах, мельницах различной конструкции. Тонко измельченные вещества приобретают множество полезных свойств. Например, красители - лучшую красящую способность, большую устойчивость, более красивые оттенки. Методом механического измельчения получают краски, смазочные материалы, фармацевтические препараты, пищевые продукты. 2. Ультразвуковой Твердые тела дробят под действием ультразвука. Этим способом получают гидрозоли различных полимеров, серы, графита, органозоли металлов и сплавов. Конденсационные методы получения дисперсных систем 1. Физические К ним относится замена растворителя. Например, в раствор серы в этиловом спирте добавляют воду. 2. Химические В основе лежат химические реакции окисления, восстановления, обмена, гидролиза. Например, FeCl3 + 3H3O = Fe(OH)3 ¯ + 3HCl.
В) Мицелла -это структурная электронейтральная коллоидная единица , т.е частица дисперсной фазы, окруженная двойным электрическим слоем .

интермицеллярная жидкость это дисперсионная среда разделяющая мицеллы.
Г) Свойства дисперсных систем
Броуновское движение – это непрерывное беспорядочное движение частиц микроскопических и коллоидных размеров, не затухающие во времени. Это движение тем интенсивнее, чем выше температура и чем меньше масса частицы и вязкость дисперсионной среды.
Для количественной характеристики броуновского движения используется средний сдвиг , который связан с коэффициентом диффузии уравнением Эйнштейна-Смолуховского:
,
где D – коэффициент диффузии, t – время диффузии
Диффузией называется самопроизвольный процесс выравнивания концентрации молекул, ионов или коллоидных частиц под влиянием их теплового движения. Процесс диффузии идет самопроизвольно, поскольку он сопровождается увеличением энтропии системы. Напомним, что равномерное распределение вещества в системе отвечает ее наиболее вероятному состоянию.
Для количественного описания диффузии используется закон Фика, который был установлен по аналогии с законами переноса тепла и электричества:
,
где dQ – количество продиффундировавшего вещества; D – коэффициент диффузии; dc/dx – градиент концентрации; s – площадь, через которую идет диффузия; τ – продолжительность диффузии.
Осмос – это односторонняя диффузия молекул растворителя через полупроницаемую мембрану при условии разности концентраций раствора по обе стороны мембраны. При разделении двух растворов различной концентрации или раствора и чистого растворителя полупроницаемой перегородкой (мембраной) возникает поток растворителя от меньшей концентрации вещества к большей, что приводит к выравниванию концентраций.Возникновение потока обусловлено тем, что число ударов молекул растворителя о мембрану со стороны более разбавленного раствора (или чистого растворителя) будет больше, чем со стороны более концентрированного раствора. Это избыточное число ударов и является причиной перемещения растворителя через поры мембраны туда, где молекул меньше.
Для коллоидных систем можно записать
.
Седиментация – это еще одно из явлений, связанных с молекулярно-кинетическими свойствами дисперсных систем.
Седиментацией называют процесс оседания (в редких случаях всплывание) частиц дисперсной фазы в жидкой или газообразной среде под действием силы тяжести. Седиментация характерна для суспензий. В эмульсиях, наоборот, частицы дисперсной фазы обычно всплывают
Д) Электрофорез -это перемещение заряженных коллоидных частиц под действоем внешнего электрического поля к противоположно заряженному электроду.
Электроосмос-это передвижение дисперсионной среды относительно неподвижной дисперсной фазы под действием внешнего электрического поля к электроду в направлении ,противоположном движению гранулы
Е)Применение электрофореза в медицине биологии формации:
*введение лекарственных препаратов через капиллярную систему кожного покрова.
*Очищение лекарственных препаратов (антибиотики ,витамины и др.)
*устанавление степени чистоты лекарственных средств .
*изучение электрохимических свойств биологических систем(энзимов,вирусов,форменных элементов крови)
*разделение белков ,аминокислот на фракции
Ж) Коллоидная защита – защита золя высокомолекулярными соединениями. Адсорбируясь на границе раздела фаз, они образуют в поверхностном слое сетчатые и гелеобразные структуры, создающие структурно-механический барьер, который препятствует объединению частиц дисперсной фазы.
З)
Методы очиски коллоидных растворов:
*диализ
*электродиализ
*ультрафильтрация
Диализ -это метод ,основаннай на применении полепроницаемых мембран ,легко пропускающих низкомолекулярные вещества и задерживающих коллоидные частицы.
Электродиализ - это метод диализа ,ускоренный действием постоянного электрического тока.
Ультрафильтрация -это диализ ,осуществляемый за счет разницы давлений по обе стороны от мембраны.
И)
Грубодисперсные системы это системы с размерами частиц порядка десять в степени (-7) - десять в степени (-4)
Аэрозоли -это дисперсные системы с газообразной дисперсной средой :
туманы(жидкая дисперсная фаза)
*дымы(твердая дисперснаяя фаза конденсационного происхождения)
*пыли (твердая дисперсная фаза ,образованная путем диспергирования)
*смоги (смешанная дисперсная фаза)
успензии- это дисперсные системы , в которых дисперсной фазой являются частицы твердого тела , а дисперсионной фазой являются частицы твердого тела ,а дисперсионной средой -жидкость .
примеры:
*вода природных и искусственных водоемов
*почвы и грунты при достаточном содержании влаги
*вся твердообразная пища в процессе усвоения
* лекарственные средства
*косметические средства
Эмульсии- это своборнодисперсные системы , в которых дисперсная фаза и дисперсионная среда представляют собой несмешивающиеся жидкости.
примеры:
* природные эмульсии:молоко ,яичный желток,млечный сок растений,сырая нефть и др.
*пищеварение : поглощенный жир эмульгируется в кишечнике и всасывается через его стенки , эмульгатор - холиевы кислоты , содержащиеся в желчи
* лекарственные эмульсии: Для внутреннего применения 1 типа (м/в), для наружного применения 2 типа (в/м)
*пищевые (маргарин ,майонез) и парфюмерные (кремы, лосьены ) эмульсии
2
2)Пиримидиновые: урацил, тимин, цитозин. Пуриновые: аденин, гуанин.
Нуклеиновые кислоты - это ВМС, молярная масса которых составляет от 25 тыс. до 1 млн. Нуклеиновые кислоты впервые были обнаружены в ядрах живых клеток в 1869г. Они играют важнейшую роль в переносе генетической информации в живых существах от одного поколения к другому посредством управления точным ходом биосинтеза белка в клетках.
Нуклеиновые кислоты называются полинуклеотидами; это полимеры, цепи которых состоят из мономерных единиц - мононуклеотидов. Каждый мононуклеотид является 3-х компонентным образованием. Он включает:
1. гетероциклическое азотистое основание (пуриновое или пиримидиновое) в лактатной форме;
2. углеводный остаток пентозы (рибозы или дезоксирибозы) в β-фуранозном цикле;
3. фосфатная группа - остаток Н3РО4.
В зависимости от углеводородного компонента различают:
- рибонуклеотиды, содержащие остаток рибозы (пр. структурные звенья РНК);
- дезоксирибонуклеотиды, содержащие остаток дезоксирибозы (ДНК).
Строение нуклеотидов
Нуклеотиды - это N-гликозиды, образованные азотистым основанием и пентозой. Азотистое основание присоединяется к углеводному компоненту вместо полуацетальной ОН-группы через атом N в положении 1 для пиримидинов и в положении 9 для пуринов, образуя N-гликозидную связь.
Пр.: образование аденозина из аденина (пуриновое основание) и рибозы (НК1)
Основой названия гликозидов является тривиальное название соответствующего азотистого основания с суффиксом «идин» для пиримидиновых и «озин» для пуриновых нуклеотидов.
В РНК входят следующие нуклеотиды: аденозин, гуанозин, цитидин, уридин. Их азотистые основания: аденин, гуанин, цитозин, урацил.
В ДНК входят следующие нуклеотиды: аденозин, гуанозин, цитидин, тимидин. Их азотистые основания: аденин, гуанин, цитозин, тимин.
Строение мононуклеотидов
Нуклеотиды - это фосфаты нуклеозидов. Фосфорная кислота (Н3РО4) присоединяется к 5’ атому углерода пентозы образуя сложноэфирную связь.
Пр. рассмотрим образование 5’-цитидиловой кислоты (НК2)
Нуклеотид имеет 2 названия:
1. как монофосфат соответствующего нуклеозида: цитидин-5’-фосфат (СМР);
2. как кислота: 5-цитидиловая кислота.
Нуклеотиды являются кислотами, т.к. при физиологическом значении рН=7,34-7,36 фосфатные группы ионизированы.
Названия нуклеотидов РНК: аденозин-5’-фосфат (5’-адениловая кислота - АМР); гуанозин-5’-фосфат (5’-гуаниловая кислота - GMP); цитидин-5’-фосфат (5’-цитидиловая кислота - СМР); уридин-5’-фосфат (5’-уридиловая кислота - UMP).
Названия нуклеотидов ДНК: дезоксиаденозин-5’-фосфат (5’-дезоксиадениловая - dАМР); дезоксигуанозин-5’-фосфат (5’-дезоксигуаниловая - dGМР); дезоксицитидин-5’-фосфат (5’-дезоксицитидиловая - dСМР); тимидин-5’-фосфат (5’-тимидиловая - dTMP).
Строение нуклеотидов РНК
5’-гуаниловая к-та (НК3);
5’-адениловая к-та (НК4);
5’-цитидиловая к-та (НК5);
5’-уридиловая к-та (НК6);
Строение нуклеотидов ДНК
5’-тимидиловая к-та (НК7);
5’-дезоксиадениловая к-та (НК8);
5’-дезоксигуаниловая к-та (НК9);
5’-дезоксицитидиловая к-та (НК10);
Мононуклеотиды – это не только компоненты нуклеиновых кислот, некоторые из них также могут свободно находиться в организме, играя важную роль. Наибольшее значение имеют адениловая кислота и её фосфатно-кислотные производные: аденозиндифосфат (АДФ) и аденозинтрифосфат (АТФ), выполняющие энергетическую функцию.
Строение АТФ
(НК11)
АТФ относится к макроэнергетическим соединениям. Её энергия заключена между 2 и 3 остатками фосфорной кислоты (Н3РО4). При гидролизе АТФ выделяется энергия, необходимая для осуществления многих биологических и биохимических процессов, таких как ионный транспорт, электрическая активность нервных клеток, биосинтез белка и др.
При физиологическом значении рН (7,35) фосфатные группы АТФ ионизированы и могут образовывать связи с катионами металлов, напр. с катионами Mg2+.
Гидролиз АТФ протекает ступенчато:
1. АТФ+Н2ОАДФ+Фн. При этом выделяется свободная энергия Gº=-(25-40) кДж·моль-1. Значение выделившейся энергии зависит от рН среды, присутствия катионов Mg2+ и др.
2. АДФ+Н2ОАМФ+Фн, ∆Gº=-30 кДж·моль-1.
3. АМФ+Н2ОАденозин+Фн, ∆Gº=-14 кДж·моль-1.
Вместе с тем в организме протекают процессы синтеза АТФ - это эндотермические процессы. Энергия, выделяющаяся при биохимическом окислении белков, жиров, углеводов запасается в макроэргических связях АТФ.
Структура нуклеиновых кислот
Структура ДНК
Впервые структура ДНК была расшифрована в 1953г. Уотсоном и Криком. ДНК включает несколько уровней структурной оргенизации. Днк имеет первичную, вторичную и третичную структуры.
Первичная структура - это последовательность мононуклеотидов, соединенных (3'5') фосфодиэфирными связями.
Полинуклеотидная цепь может включать сотни мононуклеотидных звеньев, соединенных (3'5') фосфодиэфирными связями. Например эти связи соединяют 5’-дезоксиадениловую и 5'-дезоксицитидиловую кислоты. (НК12)
Вторичная структура ДНК - это пространственное расположение полинуклеотидных цепей в молекуле ДНК.
Молекула ДНК представляет собой две полинуклеотидные цепи, правозакрученные с образованием двойной спирали. Эти две полинуклеотидные цепи антипараллельны друг другу, т.е. направления фосфодиэфирных связей в них противоположны. В одной цепи 3'5' в другой цепи 5'3'. Вторичная структура стабилизируется за счет образования водородных связей между парами комплиментарных азотистых оснований. Комплиментарность означает взаимодополняемость.
Комплиментарными являются: А=Т; ГЦ. Между А и Т возникает 2 водородные связи, а между Г и Ц - 3 водородные связи. (НК13,14)
Комплиментарность цепей является химической основой важнейших функций ДНК - переноса и хранения наследственной информации.
Третичная структура ДНК представляет собой многократную спирализацию вторичной структуры, обеспечивая плотную упаковку ДНК в ядрах клеток.
Структура РНК
В основном обладают первичной структурой, сходной со структурной ДНК, только азотистое основание урацил вместо гуанина, а углеводный компонент рибоза вместо дезоксирибозы.
В зависимости от функций, места нахождения и состава РНК делятся на 3 основные вида:
1. и-РНК (информационная или матричная) 5-10% от всех РНК в клетке;
2. р-РНК (рибосомная) 80-90%
3. т-РНК (транспортная) 5-10%
5 билет
1.Поверхностные явления это процессы, происходящие на границе раздела фаз и обусловленные особенностями состава и строения поверхностного слоя.
Адсорбция- это процесс самопроизвольного изменения концентрации растворенного вещества на границе раздела фаз.
ПАВ – это вещества, при растворении которых вызывает незначительное повышение поверхностного натяжения на граниуе раздела фаз. ( например неорганические кислоты, основания, соли, глицерин, альфа аминокислоты и тд)
ПНВ – это вещества, растворение которыхрактически не изменяет поверхностное натяжение на границе раздела фаз (например дисахариды, глюкоза и тп.)
ПАВ - это вещества, обладающие низким поверхностным натяжением, т.е. /C, а потому из уравнения Гиббса следует, что величина адсорбции больше нуля.
ПАВ вызывают положительную адсорбцию, так как они не растворяются в жидком адсорбенте, а концентрируются в поверхностном слое.
ПАВ принимают участие во многих физиологических процессах в организме. Большинство веществ в составе живого организма являются ПАВ. Типичными ПАВ являются высокомолекулярные жирные кислоты.
Поверхностно неактивные вещества – ПНВ - это растворы электролитов, они характеризуются большим поверхностным натяжением, отношение /C больше нуля, следовательно величина адсорбции меньше нуля.
Эти вещества растворяются во всем объеме адсорбента, а не в поверхностном слое.
Адсорбция на твердых адсорбентах (твердое вещество-жидкость, твердое вещество-газ).
Абсорбция – это процесс сорбции, который сопровождается самопроизвольной диффузией вещества по всему объему сорбента.
Ионообменная адсорбция – это процесс адсорбции, при котором адсорбент и раствор омениваются между собой эквивалентным количествомодноименно заряженных ионов. Применение в медицине: -очитска воды, антмбиотиков , белков, витаминов
-извлечение лекарственных веществ из растений
- предупреждение свертываемости крови
-нормализация ионного баланса в организме
Хроматография – это физико – химическй метод разделения, анализа и исследования веществ исмесей, который
-основан на распределении веществ между двумя несмешивающимися фазами , одна из которых является неподвижной , а другая- подвижной
-представляет собой многократно повторяющиеся процессы сорбции и десорбции. Применение в биологии и медицине : - для удаления токсических веществ из слоя жидкостей
-очистка лекарственных препаратов
-установление качества лекарственных препаратов
-биохимические анализы для изучения белковых веществ , для определения в крови летучих веществ, определения скорости кровотока в легких
2) Гетероциклическими соединениями называются соединения, в цикле которых кроме атомов углерода содержатся другие атомы (N, O, S), называемые гетероатомами. Обобщенно можно констатировать, что ненасыщенные пяти- и шестичленные гетероциклы обладают ароматическими свойствами и способны вступать в реакции электрофильного замещения подобно аренам и их производным. Однако, по мере накопления в гетероцикле электроотрицательных гетероатомов, напр., у шестичленных гетероциклов с двумя атомами азота, способность вступать в реакции электрофильного замещения резко падает, но одновременно возрастает способность к реакциям нуклеофильного замещения.
Многочисленные гетероциклические соединения играют важную роль в биологии, медицине и сельском хозяйстве. Они входят в состав важнейших природных продуктов: красящих веществ крови и растений (гемина и хлорофилла), нуклеиновых кислот, многих витаминов, антибиотиков и алкалоидов (к алкалоидам относятся гетероциклические азотсодержащие вещества растительного происхождения; значительная часть алкалоидов является биологически активными соединениями).
Классификация гетероциклических соединений основана на двух признаках:
1. число атомов в гетероцикле (трех-, четырех-, пяти-, шестичленные гетероциклические соединения);
2. число гетероатомов (один, два и более).
Пятичленные гетероциклы с одним гетероатомом: пиррол, фуран, тиофен. Пиррол, фуран и тиофен относятся к так называемым п-избыточным гетероциклам, т.е. соединениям с повышенной электронной плотностью внутри кольца . Поэтому они обладают повышенной склонностью вступать в реакции электрофильного замещения по сравнению с бензолом.
Пятичленные с двумя и более гетероатомами: имидазол, пиразол, оксазол, тиазол.
Шестичленные с одним гетероатомом: пиридин, хинолин, изохинолин, акридин.
Шестичленные с 2мя гетероатомами: пиримидин
Важную группу азотсодержащих природных веществ составляют так называемые тетрапиррольные соединения, т.е. соединения, в состав которых входят четыре пиррольных кольца. Четыре пиррольных кольца образуют циклическую сопряженную систему, называемую порфином, которая входит в состав хлорофилла, гемоглобина, цитохромов.
Состав гемоглобина
Гемоглобин эритроцитов состоит из а) гема и б) растворимого в воде белка глобина.
Производные порфиринов, содержащие ион двухвалентного железа, называются геммами.
Пиридин. За счет атома азота пиридин проявляет основные свойства. Ядро пиридина содержится в молекулах некоторых алкалоидов - никотина, витамина "РР".
Никотиновая кислота и ее амид (никотинамид) получили известность как две формы витамина РР, применяющегося в медицине для лечения пеллагры. Никотинамид является составной частью ферментных систем, ответственных за окислительно-восстановительные процессы в организме, а диэтиламид никотиновой кислоты (кордиамин) служит эффективным стимулятором ЦНС.
Наиболее известным производным пиразола является пиразолон – 5. Для этого соединения предполагается наличие таутомерного равновесия между гидрокси и оксоформами. На основании пиразолона-5 созданы известные лекарственные средства: антипирин, амидопирин, анальгин. Антипирин и амидопирин широко применяются в медицине как жаропонижающие, болеутоляющие и успокаивающие средства. Анальгин по активности превосходит амидопирин и антипирин.
Алкалоидами называются гетероциклические азотсодержащие основания растительного происхождения, обладающие выраженным физиологическим действием. Производные пиридина-никотин, тропана – кокаин, пуриновых – кофеин.
Билет 6
1.Электродный потенциал – это скачок потенциала, возникающий на границе раздела фаз металл-раствор в результате протекания окислительно – восстановительных реакций на межфазной границе, сопровождаемых переходом катионов металла через нее.
Окислительно-восстановительный потенциал – потенциал который возникает на границе электропроводник – раствор, содержащей сопряженную окисл-востановит пару, в результате протекания окислит-востановит реакций на межфазной границе за счет перехода через нее электронов. Для измерения электродного потенциала нужно собрать гальванический элемент, состоящий из электрода определения и электрода сравнения. Электроды сравнения: нормальный водородный, каломельный, хлорсеребряный. Электроды определения(их потенциал зависит от концентрации ионов водорода или от рН): нестандартный водородный, хингидронный, стеклянный.
Диффузный потенциал – это скачок потенциала, возникающий на границераздела фаз раствор- раствор в результате направленного перехода ионов через границу раздела с разной скоростью.
Мембранный потенциал – это скачок потенциала, возникающий на границе раздела фаз мембрана – раствор вследствие избирательной проницаемости мембраны.
Ионоселективный электрод - это электрохимическая система, разделенная на две части мембраной , избирательно чувствительной к определенному виду ионов.
Потенциометрическое титрование – это метод определения точки эквивалентности путем измерения ЭДС гальванического элемента в процессе хим реакции между определяемым ионом и подходящим титрантом.
Методом потенциометрии определяют : рН биологических жидкостей и тканей , концентрацию ионов в биожидкостях, концентрацию ферментов и субстратов в тканях, концентрацию токсичных ионов в продуктах питания и биосредах, константу ионизации слабых электролитов ( нуклеиновых кислот, белков), константу нестойкости биокомплексов.
2.
2) Олигосахариды иначе называются сахароподобными сложными углеводами, т.к. это кристаллические вещества, легко растворимые в воде, часто обладающие сладким вкусом.
В зависимости от числа молекул моносахаридов, образующихся при их гидролизе, олигосахариды подразделяют на дисахариды, трисахариды, тетрасахариды и т.д.
Дисахариды – природные вещества, которые находятся в плодах, овощах и образуются при частичном гидролизе полисахаридов. Существуют также и синтетические методы их получения.
В клетках и биологических жидкостях дисахариды находятся как в свободном виде, так и в составе смешанных углевод-белковых комплексов.
Все дисахариды строятся как гликозиды, т.е. молекула воды выделяется при взаимодействии двух ОН-групп молекул моносахаридов с обязательным участием полуацетального (гликозидного) гидроксила.
По строению и по химическим свойствам дисахариды делят на два типа.
Соединения первого типа – это дисахариды, образующиеся за счет выделения воды из полуацетального гидроксила одной молекулы моносахарида и одного из спиртовых гидроксилов другой.
Эти сахариды имеют один полуацетальный гидроксил. По свойствам они аналогичны моносахаридам, в частности, они могут восстанавливать такие окислители, как оксиды серебра и меди, и поэтому их называют восстанавливающими дисахаридами. Дисахарид восстанавливающего типа рассматривают как моносахарид, в котором один спиртовой атом водорода замещен гликозильным остатком.
Соединения второго типа образуются так, что вода выделяется за счет полуацетальных гидроксилов обоих моносахаридов. В дисахаридах этого типа нет полуацетального гидроксила, и они называются невосстанавливающими дисахаридами.
Благодаря наличию в молекулах дисахаридов этого типа полуацетального гидроксила они так же, как моносахариды, способны к таутомерным превращениям. Это проявляется в мутаротации растворов (изменение оптической активности, т.е. угла вращения плоскости поляризации света, с течением времени).
Важнейшие из восстанавливающих дисахаридов – мальтоза и лактоза.
Мальтоза (солодовый сахар) представляет собой замещенную D-глюкозу, содержащую в положении 4 остаток ,D-глюкопиранозы, и поэтому мальтоза называется 4-(,D-глюкопиранозил)-D-глюкозой. Для мальтозы возможны циклические (, ) и открытая (оксикарбонильная) таутомерные формы.
Мальтоза (солодовый сахар) широко распространена в растительных и животных организмах. В промышленности её получают неполным гидролизом крахмала ферментами, содержащимися в солоде, т.е. в проросших зернах злаков. Мальтоза выделена в кристаллическом состоянии, она хорошо растворима в воде, сбраживается дрожжами. В результате гидролиза мальтоза расщепляется на две молекулы глюкозы.
Лактоза (молочный сахар) представляет собой замещенную D-глюкозу, содержащую в положении 4 остаток ,D-галактопиранозы, а именно 4-(,D-галактопиранозил)-D-глюкозу, содержит -гликозидную связь. При гидролизе лактоза расщепляется на глюкозу и галактозу.
Лактозу получают из молока: в коровьем молоке содержится до 5% лактозы, женское молоко содержит до 8,5% лактозы. В женском молоке лактоза связана с сиаловой кислотой, которая подавляет рост кишечных болезнетворных бактерий. С этим связаны целебные свойства грудного молока.
Сахароза (тростниковый или свекловичный сахар). Названия возникли в связи с её получением либо из сахарной свеклы, либо из сахарного тростника. Тростниковый сахар был известен за много столетий до нашей эры. Лишь в середине XVIII века этот дисахарид был обнаружен в сахарной свекле и только в начале XIX века он был получен в производственных условиях. Сахароза очень распространена в растительном мире. Листья и семена всегда содержат небольшие количества сахарозы. Она содержится также в плодах (абрикосах, персиках, грушах, ананасах). Её много в кленовом и пальмовом соках, кукурузе. Это наиболее известный и широко применяемый сахар.
В состав сахарозы входят разные молекулы моносахаридов:
1. ,D-глюкопираноза,
2. ,D-фруктофураноза;
тип связи 1,2-гликозидная
Оба моносахарида присутствуют в построении молекул сахарозы своими полуацетальными гидроксилами, т.е. у нее нет свободного полуацетального гидроксила.
Будучи по своему строению гликозидами, дисахариды в присутствии кислот или ферментов легко гидролизуются с образование двух молекул моносахаридов.
Полисахариды - это высокомолекулярные углеводы, по химической природе относящиеся к полигликозидам, т.е. продуктам поликонденсации моносахаридов, связанные между собой гликозидными связями.
По составу полисахариды делят на
1. гомополисахариды - биополимеры, образованные из остатков одного моносахарида;
2. гетерополисахариды, образованные из остатков разных моносахаридов.
Все они имеют общее название: гликаны.
Гомополисахариды.
К биологически важным относятся крахмал, гликоген, клетчатка, состоящая из остатков глюкозы.
Крахмал - это смесь двух полисахаридов: амилозы и амилопектина в соотношении 10-20% к 80-90%.
Макромолекула амилозы свёрнута в спираль, во внутренний канал которой могут проникать молекулы небольших размеров, образуя комплексы, которые называются «соединения включения». Например, комплекс амилазы с йодом имеет синее окрашивание.
Амилопектин - это гомополисахарид разветвлённой структуры, в составе которого линейная цепь -D-глюкопиранозных остатков построена за счёт (14) гликозидных связей, а элементы разветвления формируются за счёт гликозидных связей.
Свойства крахмала.
Крахмал - это белое аморфное вещество, синтезируемое в растениях в процессе фотосинтеза и запасающееся в клубнях и семенах. Биохимическое превращение сводится к его гидролизу. Гидролиз в живом организме начинается в ротовой полости под действием -амилазы слюны, где крахмал расщепляется до декстринов. Гидролиз продолжается в тонкой кишке под действием -амилазы поджелудочной железы и заканчивается образованием молекул глюкозы.
Качественным реактивом на крахмал и продукты гидролиза является раствор йода. С крахмалом он образует комплекс тёмно-синего цвета. С декстринами - от фиолетового до красно-бурого цвета. Мальтоза и глюкоза раствором йода не окрашиваются.
Гликоген или животный крахмал.
Гликоген является структурным и функциональным аналогом крахмала. Он содержится во всех животных тканях, особенно много в печени (до 20%) и мышцах (до 4%).
С раствором йода гликоген даёт окрашивание от винно-красного до бурого цвета.
Клетчатка или целлюлоза.
Клетчатка - это структурный гомополисахарид растительного происхождения, являющийся основой опорных тканей растений. Структурной единицей клетчатки является ,D-глюкопираноза, звенья которой связаны (14) гликозидными связями. Из сложных углеводов только клетчатка не расщепляется в тонком кишечнике из-за отсутствия некоторых ферментов; в толстом кишечнике она частично гидролизуется под действием ферментов микроорганизмов. В процессе пищеварения клетчатка выполняет роль балластного вещества, улучшая перистальтику кишечника.
Гетерополисахариды.
Гиалуроновая кислота.
Она является полисахаридом соединительной ткани. Её макромолекула строится из остатков дисахаридов, соединённых (14) гликозидными связями.
барьерная функция, обеспечивающая непроницаемость соединительной ткани для болезнетворных бактерий. В комплексе с полипептидами гиалуроновая кислота входит в состав стекловидного тела глаза, суставной жидкости, хрящевой ткани.
Билет 7
1 вопрос.
Биогенные элементы – это элементы , необходимые для построения и жизнедеятельности клеток организма в целом. Биогенные элементы - химические элементы, играющие существенную роль в составе живых организмов: О, Н, Са, Mg, С, Na, Fe. Из этих элементов кислород составляет 70% массы организмов, углерод - 18, а водород - 10%. Биогенным является весь кислород атмосферы. Р, Са, К, S, С, N обладают меньшей миграционной способностью, чем остальные, входящие в организмы элементы.
*биогенные s элементы располагаются в 1А и 2А группах переодической системы Менделеева. Содержат на внешней оболочке атома :
-по одному s электрону (Н),(Na) (K) 1А группа ПС
-или по два s электрона (Mg) (Ca) 2А группа ПС
Натрий и калий: ионы натрия и калия распределены по всему организму человека, причем ионы натрия входят преимущественно в состав межклеточных жидкостей, ионы Хлорид натрия (NaCl) - раствор хлорида натрия (0,9% - физиологический раствор) применяется для внутривенных вливаний при больших кровопотерях. Сульфат натрия – Na2SO4 ∙ 10H2O (глауберова соль) – бесцветные прозрачные кристаллы горьковато – соленого вкуса. В медицине эта соль применяется как слабительное средство и как противоядие при отравлении солями бария и свинца, с которыми дает нерастворимые осадки BaSO4 и РвSO4: Ацетат калия СН3СООК – кристаллический порошок белого цвета, легко расплывается на воздухе, является мочегонным средством, хорошо действует при сердечных и почечных отеках. *биогенные р элементы располагаются в главных подгруппах 3-7 групп периодической системы (3А-7А)
-содержат на внешней оболочке атома от 1 до 6 электронов
-валентными являются не только р электроны , но и s-электроны внешнего уровня
-сумма числа валентных электронов (от ns² np¹ до ns² np⁵)соответствует номеру группы и высшей степени окисления.
(С) 2р² (Si) 3p² 4А группа ПС
(N) 2p³ (P)3p³ 5А группа ПС
(О)2р⁴ (S)3p⁴ 6Агруппа ПС
Основной (фактически единственной) функцией кислорода является его участие как окислителя в окислительно-восстановительных реакциях в организме. Благодаря наличию кислорода, организмы всех животных способны утилизировать (фактически «сжигать») различные вещества (углеводы, жиры, белки) с извлечением определенной энергии «сгорания» для собственных нужд. В покое организм взрослого человека потребляет 1,8-2,4 г кислорода в минуту.
Озонотерапия — это метод, который оказывает влияние на перенос кислорода в ткани при помощи озона. Применение кислорода весьма многообразно. Его применяю для интенсификации химических процессов во многих производствах (например, в производстве серной и азотной кислот.) Кислород используют в медицине при затрудненном дыхании.
Бактерицидное действие озона связано с его высоким окислительным потенциалом и легкостью его диффузии через клеточные оболочки микробов. Он окисляет органические вещества микробной клетки и приводит ее к гибели
Перекись водорода - бесцветная вязкая жидкость с металлическим привкусом. С водой смешивается в любых соотношениях. Пергидроль - 30% перекись водорода, из нее готовят 3 и 6% рабочие растворы. Водные растворы бесцветны, лишены запаха и не оказывают токсического действия на животных в концентрациях до 3% включительно. Бактерицидные свойства йода (J2) широко используют в пищевой санитарии для обработки поверхности производственных емкостей, оборудования и тары. Йод плохо растворяется в воде (0,03% при 293 К), но хорошо растворяется в растворе йодида калия (KJ), а также спирте, эфире и других органических растворителях. Растворы йода обладают сильным бактерицидным и спороцидным действием
Фторид (Fluoride) – это ион фтора. Все органические и неорганические соединения, содержащие фтор – это и есть фториды, речь о которых пойдет в этой статье. Фтор – это газ, и в природе он находится чаще всего в соединениях с другими веществами, например как фтористый кальций (CaF)или фтористый натрий (NaF). Фторид может доставить серьезные проблемы здоровью даже при употреблении в малых дозах, которые имеются в зубной пасте или фторированной воде.Флюороз – хроническая интоксикация фтором. Бывает двух видов: зубной и скелетный, выражается в страшных симптомах.
Среди многих химических элементов, которые слагают разнообразные горные породы и минералы, входят в состав морских и пресных вод, содержатся в тканях животных и клетках растений, важное место занимают фтор, хлор, бром и йод. Представители одного химического "семейства" - галогенов,- эти четыре элемента активно взаимодействуют с различными металлами, образуя соли (отсюда возникло их название "галогены" - рождающие соли), бурно реагируют с водородом, вступают в реакцию с углеродом, кремнием и другими металлоидами. Распыленные в земной коре в ничтожных количествах, они, тем не менее, играют огромную роль в развитии живой природы. Неизмеримо велика роль галогенов и в современной технике. Нет почти ни одной отрасли промышленности, в которой не применялись бы те или иные соединения этих элементов. Нужны они в химическом, пищевом, металлургическом, холодильном, стекольном, текстильном, красильном, фармацевтическом, бумажном производствах и т. д.
*Биогенные d элементы
Располагаются в побочных подгруппах 1- 8 групп, в больших периодах между s и p элементами
Заполняют орбитали предвнешнего d слоя
На внешнем слое находится 1-2 s электрона.
(Cr)3d⁵4s¹ (Co)3d⁷4s² (Mo)4d⁵5s¹
(Fe)3d⁶4s² (Cu)3d¹⁰4s¹
(Mn)3d⁵4s² (Zn)3d¹⁰4s²
Биологическое значение :
Хром- микроэлемент (содержание в организме 10̄⁵ -10̄⁴%)
Топография: Металический хром нетоксичен. Соединения Cr(3) и Cr(5)токсичны,опасны для здоровья
Биологическая роль хрома:
*участвуют в обмене углеводов( усиливает активность инсулина)
*участвуют в обмене белков( входит в активный центр фермента трепсина)
Недостаток вызывает :повышение содержания сахара в крови и моче, повышение холестерина в моче, увеличение атеросклеротических бляшек в аорте, нарушение центральной нервной системы , задержку роста, снижение числа сперматозоидов и их оплодотворяющей способности.
Соединения хрома (6)вызывают:общую интоксикацию организма, повреждение клетки печени и почек ,развитие злокачественных образований.
Марганец относится к эссенциальным (жизненно важным) микроэлементам. Его содержание в организме взрослого человека составляет 12-20 мг. Наибольшие концентрации марганца наблюдают в головном мозге, печени, почка, поджелудочной железе.Биологическая роль марганца
активирует или входит в состав многих ферментов
является катализатором некоторых реакций в организме человека
участвует в синтезе белка, нуклеиновых кислот, нейромедиаторов
участвует в обмене инсулина, гормонов щитовидной железы
Железо необходимо для нормального кроветворения и тканевого дыхания:
а) данный микроэлемент входит в состав гемоглобина эритроцитов, доставляющего кислород к органам и тканям;
б) входит в состав миоглобина мышц, обеспечивающего тканевое дыхание мускулатуры Человека;
в) является составной частью ферментов, участвующих в дыхательных процессах.
