
- •Дегидрирование алканов в соответствующие алкены:
- •4. Каталитическое превращение образовавшихся жирных кислот до ацетил-КоА по механизму β-окисления.
- •Особенности метаболизма метилотрофных микроорганизмов.
- •2 . Рибулозомонофосфатный путь. Он представляет собой модифицированный вариант пентозофосфатного цикла. Ключевой реакцией является конденсация формальдегида с молекулой рибулозо-5-фосфата.
- •В.2. Схема включения этанола и ацетата в метаболические процессы.
- •В.3. Схема β- и α-окисления жирных кислот.
- •В. 4. Механизмы ассимиляции азотсодержащих соединений.
- •В.5. Взаимосвязь обмена белков, липидов и углеводов в клетках микроорганизмов.
- •Пентозы
Лекция 10. АССИМИЛЯЦИЯ УГЛЕРОДСОДЕРЖАЩИХ И АЗОТСОДЕРЖАЩИХ СОЕДИНЕНИЙ МИКРООРГАНИЗМАМИ
Ассимиляция углеводородов микроорганизмами. Особенности метаболизма метилотрофных микроорганизмов.
Схема включения этанола и ацетата в метаболические процессы.
Схема β- и α-окисления жирных кислот.
Механизмы ассимиляции азотсодержащих соединений.
Взаимосвязь обмена белков, липидов и углеводов в клетках микроорганизмов.
В. 1. Ассимиляция углеводородов микроорганизмами. Особенности метаболизма метилотрофных микроорганизмов.
Углеводороды широко используются в качестве углеродных субстратов при культивировании микроорганизмов, в первую очередь, дрожжей. Целевые продукты, синтезируемые микроорганизмами при культивировании на углеводородных средах, делят на три группы:
1. Метаболиты, не отличающиеся от продуктов микробного синтеза, получаемых на углеводных средах (аминокислоты, органические кислоты, углеводы, водорастворимые витамины, антибиотики, ферменты);
2. Жирорастворимые вещества, продуцирование которых значительно усиливается при ассимиляции клетками углеводородов (липопротеины, гликолипиды, коэнзим А, жирорастворимые витамины и их предшественники);
3. Метаболиты, строение которых связано со структурой углеводородных субстратов; синтезируются только при наличии в среде последних (ω-аминокислоты; спирты; жирные кислоты).
Способностью к ассимиляции углеводородов обладают дрожжи, в первую очередь, рода Candida; некоторые культуры грибов; отдельные виды бактерий Actinomyces, Streptomyces, Bacillus.
При исследовании ассимиляции дрожжами углеводородов были выявлены следующие общие закономерности:
алифатические углеводороды ассимилируются значительно быстрее и эффективнее, чем ароматические и С1-содержащие углеводороды (и вообще все галогенопроизводные), ароматические соединения даже в низких концентрациях токсичны для алканутилизирующих дрожжей;
многие виды дрожжей способны утилизировать 1-алкены, однако, выход биомассы в данном случае ниже, чем при ассимиляции культурой соответствующих алканов;
наиболее доступными для клеток дрожжей являются алканы с длиной цепи С9-С18; расщепление более длинных цепей затруднено, а жидкие алканы С5-С8 проявляют способность к растворению компонентов цитоплазматической мембраны;
изоалканы доступны для микроорганизмов только тогда, когда содержат в своем составе достаточно длинные линейные участки.
В соответствии с современными представлениями, механизм ассимиляции алканов включает следующие стадии:
Образование макроэмульсий (1-100 мкм) в результате перемешивания частиц и микроэмульсий (0,01-0,5 мкм) под действием ПАВ-эмульгаторов, продуцируемых клетками микроорганизмов (определяющая характеристика ассимиляции углеводородов!!!).
Сорбция эмульгированных частиц н-алканов (простая диффузия) и перемещение через клеточную мембрану по механизму активного транспорта за счет образования комплексов с липополисахаридами клеточной мембраны по специальным каналам;
Окисление н-алканов в соответствующие жирные кислоты, может осуществляться по трем направлениям:
окисление н-алканов моноксигеназной системой переноса электронов, включающей ФАД-зависимую редуктазу, железосодержащий белок рубредоксин и алкан-1-гидролазу, имеющую активный центр, специфичный к СН3-радикалам линейных алканов:
Н



 АДН
редуктаза рубредоксин
(Fe2+)
R-CH2-CH3
АДН
редуктаза рубредоксин
(Fe2+)
R-CH2-CH3
 (ФАД)
О2
(ФАД)
О2
1-алкангидролаза редуктаза Н2О
R-CH2-CH2-ОН
НАД (ФАДН2) рубредоксин (Fe3+)
Образовавшийся спирт подвергается окислению до альдегида и далее до соответствующей жирной кислоты;
гидропероксидация н-алканов, включает образование алкилгидроперекисей из сводобных радикалов и их восстановление в первичные и вторичные спирты:
R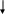 -CH2-CH3
-CH2-CH3


R

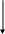 -CH-CH3
R-CH2-CH2
-CH-CH3
R-CH2-CH2

 О2;
R\H
О2;
R\H
 OOH
OOH
OOH
OOH
R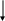 -CH-CH3
R-CH2-CH2
-CH-CH3
R-CH2-CH2
OH
R-CH-CH3 R-CH2-CH2 -OH
Дегидрирование алканов в соответствующие алкены:

 О
Н2О
ОН
О
Н2О
ОН
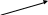


 О2
R-CH
CH3
R-CH-CH2ОН
О2
R-CH
CH3
R-CH-CH2ОН
R

 -CH2-CH3
R-CH=CH2
-CH2-CH3
R-CH=CH2
НАД НАДН Н2О R-CH2-CH2 -НO
4. Каталитическое превращение образовавшихся жирных кислот до ацетил-КоА по механизму β-окисления.
Особенности метаболизма метилотрофных микроорганизмов.
К метилотрофным относят микроорганизмы, использующие в качестве углеродных субстратов метан и метанол. Окисление метана в метанол осуществляется бактериями Methylomonas; Methylococcus; Methylosinus и катализируется ферментом метанмонооксидазой, специфичной к одноуглеродным субстратам, и локализованным в клеточной мембране:

О2 Н2О
С

 Н4
СН3ОН
НСНО
Н4
СН3ОН
НСНО
НАДН НАД НАД НАДН
Окисление метанола в формальдегид, помимо вышеперечисленных, осуществляют бактерии Methylophilus, некоторые виды Pseudomonas. Процесс катализируется ферментом метанолдегидрогеназой, для проявления активности которого необходимо присутствие кофермента – феназинметилсульфата. У метанолутилизирующих дрожжей Candida boidinii и Pichia pinus, данная реакция катализируется ФАД-зависимой метанол-оксидазой. Оба фермента индуцибельны в отношении метанола. Завершающей стадией включения метана и метанола в метаболические процессы клетки является окисление формальдегида:
НАД НАДН НАД НАДН
Н

 СНО
НСООН СО2
+ 2Н+
СНО
НСООН СО2
+ 2Н+
Н2О
Данный процесс, помимо феназинметасульфат-связанной метанолдегидрогеназы, способны катализировать ряд формальдегиддегидрогеназ. Выявлены два основных пути утилизации формальдегида, приводящие к синтезу С3- и С4-соединений.
1. Сериновый путь. Предусматривает последовательность реакций конденсации формальдегида, глицина и СО2 в яблочную кислоту. У метилотрофных микроорганизмов выявлены два варианта данного метаболического пути: с участием изоцитратлиазы («+» – вариант) и без участия данного фермента («-» - вариант). В первом случае цепь превращений катализируется цитратсинтетазой, аконитатгидратазой и изоцитратлиазой; «-» – вариант предусматривает аналогичную последовательность реакций, но без вовлечения ферментов изоцитратлиазы.
Общая схема процесса:
Н
 СНО
НСООН
СО2
СНО
НСООН
СО2
 ТГФК
ТГФК
С1 – ТГФК ТГФК


 Глицин
Серин
Глицин
Серин
окси-ПВК


 АТФ
АТФ
 НАДН
НАДН
НАД
 АДФ
АДФ
2-ФГК 3-фосфоглицерат


 ФЕП
ФЕП
СО2
ЩУК
 Глиоксиловая кислота
НАДН
Глиоксиловая кислота
НАДН

 НАД
НАД
Яблочная кислота
и
 золимонная
кислота НS-КоА
АТФ
золимонная
кислота НS-КоА
АТФ
янтарная кислота АДФ
 Малил-КоА
Малил-КоА
Лимонная кислота ЩУК
Ацетил-КоА
Т ГФК
– тетрагидрофолевая кислота; -
трансоксиметилаза;
ГФК
– тетрагидрофолевая кислота; -
трансоксиметилаза;
- оксипируваткиназа; - фосфоенолпируваткарбоксилаза;
- малил-КоА-лиаза; - изоцитратлиаза.
Энергетическая эффективность серинового пути равна 12,5 АСБ/моль АТФ.
