- •Лекция № 1 Вводная – 2 часа
- •1. Цели и задачи изучения курса
- •2. Определение специальной стали и сплава
- •3. Классификация сталей и сплавов
- •Лекция № 2 Химическая коррозия – 2 часа
- •1. Природа химической коррозии
- •2. Влияние легирующих элементов на жаростойкость
- •Лекция № 3 Электрохимическая коррозия - 2 часа
- •1. Природа электрохимической коррозии
- •2. Виды электрохимической коррозии в сварном соединении
- •2.1. Влияние легирующих элементов на коррозионную стойкость сварных соединений (стойкость против электрохимической коррозии).
- •Лекция № 4 Характеристики работоспособности стали при повышенных температурах - 2 часа
- •1. Критерии жаропрочности
- •2. Влияние легирующих элементов на жаропрочность сварного соединения
- •3. Поведение сварных соединений при высоких температурах
- •Лекция №5 Охрупчивание сварных соединений при повышенных температурах - 2 часа
- •2. Сигма-охрупчивание.
- •3. Разрушение сварного шва под нагрузкой при повышенных температурах.
- •Лекция № 6 Сварка теплоустойчивых сталей - 2 часа
- •1. Трудности сварки теплоустойчивых сталей
- •2. Влияние легирующих элементов на свойства металла шва
- •3. Выбор рациональной технологии сварки
- •Лекция № 7 Сварки хромоникелевых сталей аустенитного и аустенитно-ферритного классов - 2 часа
- •1. Область применения
- •2. Особенности сварки
- •2.1. Аустенитные стали
- •2.2. Аустенитно-ферритные стали
- •3. Технология сварки
- •3.1. Аустенитные стали
- •3.2. Аустенитно-ферритные стали
- •Лекция № 8 Сварка хромистых сталей мартенситного и ферритного классов - 2 часа
- •1. Область применения
- •2. Особенности сварки
- •3. Технология сварки
- •Лекция № 9
- •1 Область применения низколегированных бейнитно-мартенситных сталей и микролегированных сталей
- •2. Особенности сварки
- •3. Технология сварки
- •Лекция № 10
- •1. Область применения среднелегированных мартенситно-бейнитных сталей
- •3. Технология сварки
- •Лекция № 11 Сварка тугоплавких металлов и сплавов на их основе – 2 часа
- •1. Свойства сплавов на основе ванадия, ниобия, тантала, хрома, молибдена,
- •2. Особенности сварки тугоплавких металлов и их сплавов
- •3. Технология сварки тугоплавких металлов и их сплавов
- •3.1. Сварка сплавов на основе хрома, молибдена, вольфрама
- •3.2. Сварка сплавов на основе ванадия, тантала, ниобия и циркония
- •Лекция № 12 Технология сварки алюминия и его сплавов – 2 часа
- •1. Характеристика алюминиевых сплавов
- •2. Особенности сварки
- •3. Способы сварки
- •Лекция № 13 Особенности сварки титановых сплавов – 2 часа
- •1. Характеристика титановых сплавов
- •Лекция №14 Технология сварки титановых сплавов – 2 часа
- •2. Аргонодуговая сварка
- •3. Сварка под флюсом
- •4. Электрошлаковая сварка
- •5. Термообработка сварных соединений
- •Лекция № 15 Сварка меди и ее сплавов – 2 часа
- •1. Характеристика меди и ее сплавов
- •2. Особенности сварки медных сплавов
- •3. Технология сварки меди и ее сплавов
- •Лекция № 16 Сварка чугуна – 2 часа
- •2. Особенности сварки чугуна
- •3. Способы сварки чугуна
- •3.1. Способы сварки, обеспечивающие получение однородного соединения
- •3.2. Способы сварки чугуна разнородными металлами
- •Лекция №17 Сварка плавлением разнородных металлов и сплавов – 2 часа
- •1. Особенности сварки разнородных металлов и сплавов
- •2. Сварка стали с цветными металлами и сплавами
- •2.1. Сварка стали с алюминием
- •2.2. Сварка сталей с медью и ее сплавами
- •2.3. Сварка сталей с титаном (аргонодуговая неплавящимся электродом)
- •2.4. Сварка сталей с ниобием, молибденом и ванадием
- •3. Сварка разнородных цветных металлов и сплавов
- •3.1. Сварка алюминия и его сплавов с медью
- •3.2. Сварка алюминия и его сплавов с титаном
- •3.3. Сварка меди и ее сплавов с титаном
- •3.4. Сварка меди с ниобием, молибденом, танталом
2. Влияние легирующих элементов на жаростойкость
Из температурной зависимости окисления железа следует, что окисление идет медленно до температуры 560о С, т к. на поверхности присутствуют оксиды Fe2O3 и Fe3O4 с хорошими защитными свойствами. При температуре выше 560о С существует оксид FeO с коэффициентом 2,5. Поэтому, предельно допустимая температура нагрева на воздухе металла составляет примерно 560о С. За счет легирования эту температуру можно поднять до 1100-1200о С. Повышение жаростойкости сварных соединений из низколегированных сталей вызвана тем, что легирующие элементы В, входящие в решетку с матрицей из основного металла А, образуют легированные оксиды (АВ)nOm.
В высоколегированных сталях легирующий элемент образует на поверхности изделия собственный оксид ВnOm. Если данные оксиды обладают лучшими защитными свойствами при более высоких температурах, чем оксид железа (т.е. имеют = 12,5), то жаростойкость повышается.
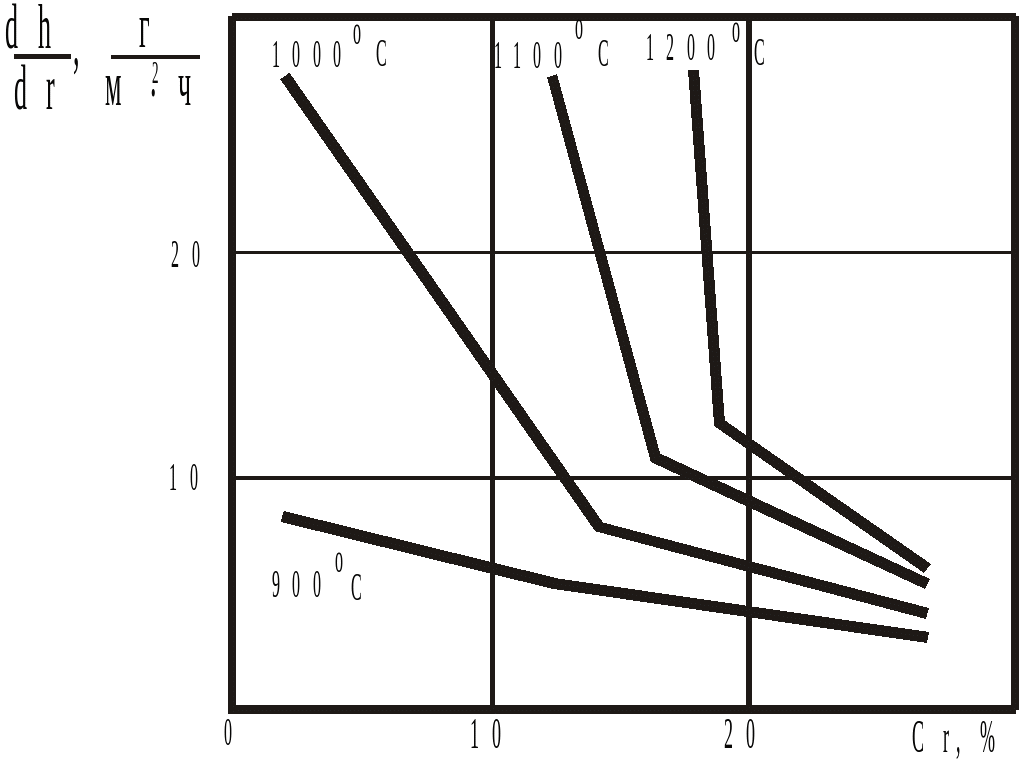
На рисунке в качестве примера показано влияние хрома на образование окалины в стали с 0,5 % C на воздухе при различных температурах:
|
Основные легирующие элементы в сталях оказывают на жаростойкость (окалиностойкость) следующее влияние. – Хром, кремний, алюминий повышают жаростойкость. – Никель оказывает положительное влияние при введении его в больших количествах, никельсодержащие стали плохо работают в сернистой среде (H2S) (S выделяясь из H2S охрупчивает сталь при температурах более 650 о С). |
– Марганец при содержании до 6% слабо влияет на жаростойкость, а при содержании более 10 % ухудшает (но хромомарганцевые стали обладают жаростойкостью до 900 о С при наличии серосодержащих газов).
– Ванадий резко снижает жаростойкость.
– Молибден понижает жаростойкость.
– Вольфрам до 900о С почти не влияет на жаростойкость, а при более высоких температурах ухудшает, образовывая на поверхности стали очень пористую окалину.
Лекция № 3 Электрохимическая коррозия - 2 часа
1. Природа электрохимической коррозии.
2. Виды электрохимической коррозии в сварочном соединении.
2.1. Влияние легирующих элементов на коррозионную стойкость сварных соединений (стойкость против электрохимической коррозии)
1. Природа электрохимической коррозии
Электрохимическая коррозия – это процесс самопроизвольного разрушения металла в результате электрохимических реакций.
Как правило электролитами служат водные растворы. Большинство металлов и сплавов при контакте с растворителем (агрессивной средой) переходят в раствор (ионы металла вырываются из кристаллической решетки и переходят в раствор).
Мерой термодинамической неустойчивости служит так называемый нормальный электродный потенциал, который пропорционален энергии перехода иона металла в электролит. Чем более отрицателен электродный потенциал тем легче растворяется металл. Между двумя замкнутыми электродами опущенными в электролит возникает ток, он называется коррозионным, а электроды, опущенные в электролит называются гальванопарой.
Величина коррозионного тока определяется по закону Ома
![]() ,
,
где I – величина коррозионного тока, А; R – сопротивление гальванопары, Ом; E, EА – электронные потенциалы катода и анода.
В сварных соединениях микрогальванопары возникают:
1. Между оксидной пленкой и металлом соединения;
2. Между различными участками сварного соединения (металл шва - основной металл; металл шва - ЗТВ; ЗТВ - основной металл и т. д.)
3. Между участками металла на уровне зерна и менее (внутри зерна), имеющими различный химический состав (за счет химической неоднородности) или различную структуру. Например: карбиды - зерна металла, нитриды - зерна металла, поверхность зерна насыщенная примесями - тело зерна. При этом сварное соединение представляет сложную электрохимическую систему, включающую в себя множество гальванопар.
|
Принципиальная схема коррозионного разрушения металла. |
При коррозионном разрушении металла различают три стадии:
1. Анодная реакция – переход иона металла в раствор составлением эквивалентного количества свободных электронов в металле.
2. Катодная реакция – процесс восстановления окислительных элементов среды.
H + e H; O2 + 2H2O + 4e 4OH
3. Процесс протекания электронов в твердой фазе, а в жидкой – перемещение анионов и катионов.
При электрохимической коррозии возможна пассивация металла в ходе которой наблюдается торможение анодного процесса, и высокая коррозионная стойкость сварного соединения.