
- •Загальна та неорганічна хімія заняття 1
- •Основні поняття і закони хімії
- •Заняття 2 будова атома. Періодичний закон.
- •Заняття 3 розчини
- •План самостійної підготовки:
- •Заняття 4 основні класи неорганічних сполук. Окисно-відновні реакції
- •Назвіть оксиди за систематичною (міжнародною) номенклатурою: Cl2o7, no2, n2o, n2o4, p2o5, Cr2o3, CrO3.
- •Проведення дослідів:
- •Заняття 5 okcигeн. Сульфур.
- •Виховання дослідів:
- •2. Хімічні властивості кисню.
- •Заняття 6 нітроген. Фосфор.
- •Виконання дослідів:
- •Заняття 7 метали. Елементи і-ііі а груп
- •Виконання дослідів:
- •Органічна хімія заняття 8
- •Виконання дослідів:
- •1.Одержання метану і його властивості.
- •Отримання етилену і його властивості.
- •Дія етилену на розчин бромної води і кМnО4.
- •Властивості рідких алкенів.
- •Заняття 9 спирти. Альдегіди. Карбонові кислоти
- •Виконання дослідів:
- •Розчинність спиртів у воді та їхнє ставлення до індикаторів.
- •Одержання діетилетеру (ефіру) і його горіння.
- •Якісна реакція на багатоатомні спирти з Cu(oh)2.
- •Кольорова реакція на альдегіди з фуксинсульфітною кислотою.
- •Виділення вищих насичених кислот з мила.
- •Заняття 10 підсумкова контрольна робота
Заняття 3 розчини
Контрольні запитання:
Дисперсні системи та їх поділ за агрегатним станом і розміром частинок дисперсної фази. Справжні розчини. Компонент. Розчинник.
Механізм процесу розчинення твердих речовин. Сольватація при розчиненні.
Відмінність розчинів від механічних сумішей і хімічних сполук.
Які розчини називаються насиченими? Ненасиченими? Пересиченими? Чи збігаються поняття “концентрований” і “насичений”?
Що є мірою розчинності речовин при даних умовах?
Як залежить розчинність твердих речовин від температури?
Як залежить розчинність газів від температури і парціального тиску?
Контрольні задачі:
20 г хлориду натрію розчинили у 200 г води. Визначити масову частку натрій хлориду в розчині.
Обчисліть масову частку магній сульфату в розчині, одержаному при внесенні 40 г MgSO4. 7H2O в 400 води.
Скільки грамів натрій гідроксиду і води потрібно взяти для приготування 135 г розчину (w=57 %) ?
Гідроген сульфід об’ємом 336 мл (н.у.) розчинили в 180 мл води. Розрахуйте масову частку речовини в одержаному розчині.
Яку масу BaCl2 · 2H2O слід розчинити в 450 мл води, щоб утворився розчин з масовою часткою барій хлориду 24 %?
Які об’єми 87% розчину /=1,81г/мл/ сульфатної кислоти та води потрібно змішати, щоб приготувати 150 г 50% розчину кислоти.
Скільки грамів HNO3 міститься в 2 л 0,25 М розчину?
Обчисліть молярну концентрацію 14 % розчину H2SO4 /=1,10 г/мл/.
План самостійної підготовки:
Виготовлення розчину певної масової частки (у відсотках) з двох розчинів з відомими масовими частками.
Приклад 1.
З 60%-ного і 20%-ного розчинів приготувати 30%-ний розчин. Для виконання завдання користуємося правилом змішування: в 1-му стовпчику (зліва) записуємо концентрації вихідних розчинів, в 2-му (посередині) – задану концентрацію, в 3–му (справа) – різницю між вихідною концентрацією і заданою (різниця береться по діагоналі).
1
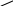
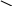 0
в.ч. 60%
0
в.ч. 60%
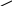
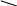 30
30
30 в.ч. 30%
За схемою на 10 вагових частин 60%-ного розчину необхідно взяти 30 вагових частин 20%-ного. Якщо розчину потрібно приготувати певну кількість, наприклад 250 г, то складаємо співвідношення:
Для приготування 40 г 30% розчину потрібно 10 г 60%
Для приготування 250 г 20% розчину потрібно Х г 60%.
40 250 = 10 Х
![]() г
60%-ного і 250 г – 62,5 г = 187,5 г 20%-ного.
г
60%-ного і 250 г – 62,5 г = 187,5 г 20%-ного.
Для змішування краще використати об’єми розчинів.
Об’єми розраховуємо за масою, користуючись формулою: V = m/ρ, де V – об’єм розчину, m – маса розчину, – густина в г/мл (г/см3) або кг/м3.
Приклад 2.
С
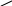 кільки
мл 30% розчину хлоридної кислоти (
= 1,19 г/мл) і води потрібно взяти для
приготування 250 мл 10% розчину (
= 1,05 г/мл)?
Розв’язок
30 10 в.ч. 30%
кільки
мл 30% розчину хлоридної кислоти (
= 1,19 г/мл) і води потрібно взяти для
приготування 250 мл 10% розчину (
= 1,05 г/мл)?
Розв’язок
30 10 в.ч. 30%
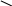 10
10
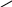 0
20 в.ч. води.
0
20 в.ч. води.
Нуль у 1-му стовпчику означає концентрацію кислоти у воді. Отже, на 10 вагових частин 30%-го розчину потрібно взяти 20 вагових частин води.
Для приготування 30 г 10% розчину потрібно 10 г 30%
Для приготування 250 · 1,05 г розчину потрібно Х г 30%.
30 250 · 1,05 = 10 Х
![]() г
30%-ного розчину
г
30%-ного розчину
![]()
![]() мл
30%-ного розчину
мл
30%-ного розчину
