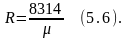- •Рабочая учебная программа по дисциплине
- •Цель и задачи дисциплины
- •Тематическое содержание дисциплины
- •Материально-техническое обеспечение дисциплины
- •Методические указания для студентов
- •2.2. Понятие рабочего тела. Идеальный газ.
- •Термодинамические параметры состояния.
- •Давление.
- •2.3.2.Температура.
- •2.3.3. Удельный объём.
- •3.2. Первый закон термодинамики.
- •3.2. Работа. Свойства работы как формы обмена энергией.
- •3.3. Энтропия. Потенциалы и координаты термодинамических взаимодействий.
- •Это основное термодинамическое тождество.
- •4.2. Формулировка 2-го закона термодинамики.
- •5.2 Уравнение состояния реальных газов.
- •Лекция №6 термодинамические процессы. Методы их исследования.
- •6.2 Изобарный процесс.
- •6.3 Изотермический процесс.
- •6.4 Адиабатный процесс.
- •6.5 Политропный процесс и его обобщающее значение.
- •Лекция №7 газовые смеси. Влажный воздух как частный случай газовой смеси.
- •Лекция №8 первый закон термодинамики для открытых систем.
- •8.1 Уравнение 1-го закона термодинамики для открытой системы.
- •8.2 Истечение из суживающегося сопла.
- •8.3 Основные закономерности течения газа в соплах и диффузорах.
- •9.2 Обобщённый (регенеративный) цикл Карно.
- •9.3 Обратимый цикл Карно.
- •9.4 Изменение энтропии в необратимых процессах.
- •9.5 Максимальная работа. Эксергия.
- •Лекция №10 циклы теплосиловых установок.
- •10.1 Термодинамическая эффективность циклов тсу.
- •10.2 Циклы поршневых двигателей внутреннего сгорания.
- •10.3. Циклы газотурбинных установок.
- •Лекция №11. Превращение воды в пар. Цикл Ренкина. Дросселирование газов и паров.
- •11.2. Теплофикация.
- •11.3. Дросселирование газов и паров.
- •Лекция №14. Теплопроводность. Основные понятия и определения.
- •Теплопроводность
- •Лекция №15 конвективный теплообмен (теплоотдача) Основной закон конвективного теплообмена.
- •Теплоотдача при изменении агрегатного состояния вещества.
- •Лекция №16 лучистый теплообмен Описание процесса и основные определения
- •Основные законы лучистого теплообмена
- •Лекция №17 Теплопередача Сложный теплообмен
- •Теплопередача между двумя жидкостями через разделяющую их стенку
- •Основы теплового расчёта теплообменных аппаратов Типы теплообменных аппаратов
- •Виды теплового расчёта теплообменников
- •Закон смещения Вина
4.2. Формулировка 2-го закона термодинамики.
Из первого закона термодинамики следует, что превращения теплоты в механическую энергию и наоборот механической в теплоту в двигателе должно осуществляться в строго эквивалентных количествах. Двигатель, который позволял бы получать работу без затрат энергии называется вечным двигателем 1-го рода. Разумеется такой двигатель создать невозможно. Первый закон термодинамики может быть сформулирован так: вечный двигатель 1-го рода невозможен. В 1755 году Французская Академия наук прекратила приём заявок на рассмотрение проектов вечного двигателя. Можно целиком механическую работу превратить в теплоту, но теплоту целиком превратить в работу не удавалось никому. Это противоречило бы 2-му закону термодинамики. Рассмотрим представленную схему, на которой дана термодинамическая картина теплового двигателя.
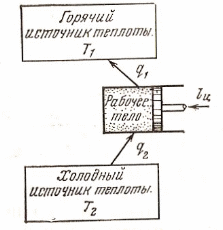
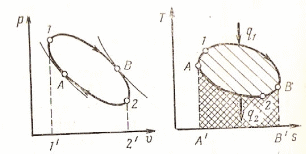
Из опыта установлено, что все тепловые двигатели должны иметь горячий источник теплоты, рабочее тело, совершающее замкнутый круговой процесс – цикл, и холодный источник теплоты.
В современных двигателях горячий источник - химическая реакция горения топлива, холодный источник – окружающая среда (атмосфера). Рабочие тела – это газы пары. Для представленной схемы в соответствии с 1 законом термодинамики запишем:
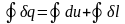
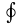 -
интеграл по контуру 1В2А1. u
– функция состояния системы и при
возвращении системы в исходное состояние
внутренняя энергия принимает то же
значение
-
интеграл по контуру 1В2А1. u
– функция состояния системы и при
возвращении системы в исходное состояние
внутренняя энергия принимает то же
значение
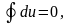 соответственно теперь мы можем написать:
соответственно теперь мы можем написать:
Отношение количества работы, выполненной в термодинамическом цикле, к количеству теплоты, подведённой в этом цикле от горячего источника, называется термическим к.п.д. цикла:
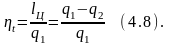
Тепловой двигатель без холодного источника теплоты, т.е. двигатель, полностью превращающий теплоту, подведённую в цикле, в работу, называется вечным двигателем 2-го рода. Отсюда ещё одна формулировка 2-го закона :
-вечный двигатель 2-го рода невозможен. Приведём формулировку Томсона (1851 г.):
-«невозможна периодически действующая тепловая машина, единственным результатом действия которой было бы получение работы за счёт отнятия тепла от некоторого источника.»
ЛЕКЦИЯ №5
УРАВНЕНИЕ СОСТОЯНИЯ ДЛЯ ИДЕАЛЬНЫХ И РЕАЛЬНЫХГАЗОВ.
ГАЗОВЫЕ ПОСТОЯННЫЕ. ТЕПЛОЁМКОСТЬ,
ФОРМУЛА МАЙЕРА.
5.1 Идеальные газы.
Согласно закону Бойля-Мариотта произведение удельного объёма на давление величина const в изотермическом процессе:
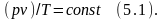
Таково уравнение состояния для идеальных газов при t=const. В опытах была установлена взаимосвязь трёх параметров f(p, v, T)=0. Такая зависимость обусловлена тем, что величина каждого из параметров определяется положением и скоростью движения молекул, а они в свою очередь для каждого отдельного состояния имеют вполне определённые значения.
Возможна для уравнений состояния и такая форма записи:
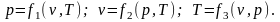
Очевидно, из трёх независимыми являются два параметра.
В термодинамике все газы, обладающие такими же свойствами, как система невзаимодействующих материальных точек, называются идеальными. К таким газам близки и реальные при низких давлениях.
Из классической механики известны соотношения:
,ми |
|
,


Величину Nk постоянную для 1кг газа обозначим R, тогда выражение (5.3) запишем в виде:
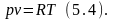
Это уравнение впервые было получено в 1834 году французским учёным Клапейроном. Для массы газа М:
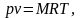
если это выражение отнести к 1киломолю газа, то выражение (5.4) будет иметь вид:
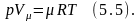
Это выражение
получено Д.И. Менделеевым, выражение
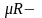 универсальная
газовая постоянная, согласно закону
Авогадро (в 1киломоле идеального газа
N=
универсальная
газовая постоянная, согласно закону
Авогадро (в 1киломоле идеального газа
N=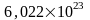 молекул) 1811 г. 1моль вещества при нормальных
условиях занимает 22,4146
молекул) 1811 г. 1моль вещества при нормальных
условиях занимает 22,4146
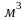 ,
отсюда получим:
,
отсюда получим: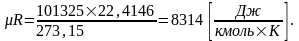
Газовая постоянная 1кг любого газа может быть определена из выражения: