
- •Рабочая учебная программа по дисциплине
- •Цель и задачи дисциплины
- •Тематическое содержание дисциплины
- •Материально-техническое обеспечение дисциплины
- •Методические указания для студентов
- •2.2. Понятие рабочего тела. Идеальный газ.
- •Термодинамические параметры состояния.
- •Давление.
- •2.3.2.Температура.
- •2.3.3. Удельный объём.
- •3.2. Первый закон термодинамики.
- •3.2. Работа. Свойства работы как формы обмена энергией.
- •3.3. Энтропия. Потенциалы и координаты термодинамических взаимодействий.
- •Это основное термодинамическое тождество.
- •4.2. Формулировка 2-го закона термодинамики.
- •5.2 Уравнение состояния реальных газов.
- •Лекция №6 термодинамические процессы. Методы их исследования.
- •6.2 Изобарный процесс.
- •6.3 Изотермический процесс.
- •6.4 Адиабатный процесс.
- •6.5 Политропный процесс и его обобщающее значение.
- •Лекция №7 газовые смеси. Влажный воздух как частный случай газовой смеси.
- •Лекция №8 первый закон термодинамики для открытых систем.
- •8.1 Уравнение 1-го закона термодинамики для открытой системы.
- •8.2 Истечение из суживающегося сопла.
- •8.3 Основные закономерности течения газа в соплах и диффузорах.
- •9.2 Обобщённый (регенеративный) цикл Карно.
- •9.3 Обратимый цикл Карно.
- •9.4 Изменение энтропии в необратимых процессах.
- •9.5 Максимальная работа. Эксергия.
- •Лекция №10 циклы теплосиловых установок.
- •10.1 Термодинамическая эффективность циклов тсу.
- •10.2 Циклы поршневых двигателей внутреннего сгорания.
- •10.3. Циклы газотурбинных установок.
- •Лекция №11. Превращение воды в пар. Цикл Ренкина. Дросселирование газов и паров.
- •11.2. Теплофикация.
- •11.3. Дросселирование газов и паров.
- •Лекция №14. Теплопроводность. Основные понятия и определения.
- •Теплопроводность
- •Лекция №15 конвективный теплообмен (теплоотдача) Основной закон конвективного теплообмена.
- •Теплоотдача при изменении агрегатного состояния вещества.
- •Лекция №16 лучистый теплообмен Описание процесса и основные определения
- •Основные законы лучистого теплообмена
- •Лекция №17 Теплопередача Сложный теплообмен
- •Теплопередача между двумя жидкостями через разделяющую их стенку
- •Основы теплового расчёта теплообменных аппаратов Типы теплообменных аппаратов
- •Виды теплового расчёта теплообменников
- •Закон смещения Вина
3.2. Первый закон термодинамики.
Термодинамический
метод исследования основан на использовании
всеобщего закона сохранения и превращения
энергии. Вместе с тем согласно теории
относительности установлено эквивалентное
соотношение между массой энергией
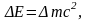 посему справедливо было бы говорить о
сохранении массы и энергии. Однако дело
в том, что в термодинамике изменения
энергии таковы, что сопровождающее их
изменение массы незначительно. Поэтому
масса закрытой термодинамической
системы считается неизменной.
посему справедливо было бы говорить о
сохранении массы и энергии. Однако дело
в том, что в термодинамике изменения
энергии таковы, что сопровождающее их
изменение массы незначительно. Поэтому
масса закрытой термодинамической
системы считается неизменной.
Для расширенной термодинамической системы, представленной на рисунке,-*-+
,+
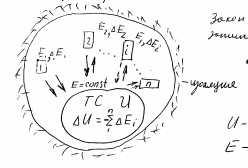
можем дать следующие
соотношения. Закон сохранения энергии
можно записать в виде:

Все тела
взаимодействуют только с термодинамической
системой и изменение энергии каждого
тела
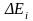 равно количеству воздействия тела
равно количеству воздействия тела
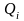 на систему:
на систему:
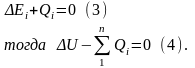
Если взаимодействия различны, то:
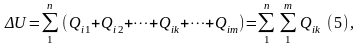
здесь k- обозначение рода взаимодействия.
Если
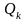 полученное воздействие на систему
полученное воздействие на систему
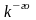 рода, то:
рода, то:
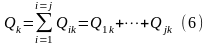
В этом случае первый закон термодинамики получит выражение:
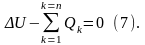
Для произвольной термодинамической системы, обладающей многими степенями свободы, первый закон термодинамики – изменение внутренней энергии термодинамической системы равно алгебраической сумме внешних воздействий.
Воздействия могут быть различных родов. В технической термодинамике термическое воздействие обозначается Q (теплота) и считается положительным, если внутренняя энергия системы в результате воздействий возрастает. Остальные воздействия называют работой (механической или немеханической). Механическая работа, связанная с объёмной деформацией обозначается L. Работа положительна, если в результате воздействия на систему (её деформации) происходит уменьшение её внутренней энергии. В этом случае система совершает работу над окружающей средой. Таким образом, знаки количества нетермических воздействий противоположны знакам количеств соответствующих работ. Первый закон термодинамики для термодеформационной системы получит вид:
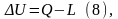
- изменение внутренней энергии системы равно разности между количеством теплоты и работой –
Изменения, происходящие в результате элементарного воздействия, можно представить выражением:
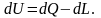
Для однородных рабочих тел удобны удельные величины:
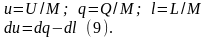
3.2. Работа. Свойства работы как формы обмена энергией.
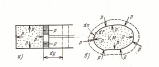
Работу мы
определяем как деформацию замкнутой и
неподвижной термодинамической системы
с однородным газообразным рабочим
телом.
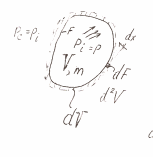
Газ при этом
находится в равновесии с окружающей
средой, то есть
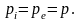 Далее происходит бесконечно малое
расширение газа. Величина, выполненной
в результате расширения газа, работы
определится из выражения:
Далее происходит бесконечно малое
расширение газа. Величина, выполненной
в результате расширения газа, работы
определится из выражения:
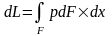 ,
(10) выполним интегрирование по всей
поверхности оболочки F,
в результате получим элементарный
объём:
,
(10) выполним интегрирование по всей
поверхности оболочки F,
в результате получим элементарный
объём:
 Переходя
на единицу массы рабочего тела, можем
записать:
Переходя
на единицу массы рабочего тела, можем
записать:
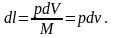 В ходе конечного термодинамического
процесса р=var,
т.е. выражение (10) интегрировать по всему
процессу. Если 1- начальное состояние,
а 2-конечное, то:
В ходе конечного термодинамического
процесса р=var,
т.е. выражение (10) интегрировать по всему
процессу. Если 1- начальное состояние,
а 2-конечное, то:
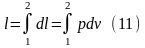 р- абсолютное давление, оно всегда
положительно, dv>0
работа величина положительная, т.е.
система производит работу над окружающей
средой, при dv<0
(сжатие системы) работа совершается
окружающей средой над системой и
считается отрицательной. Для вычисления
интеграла в выражении (11) необходимо
знать функцию р=р(v)
(12).
р- абсолютное давление, оно всегда
положительно, dv>0
работа величина положительная, т.е.
система производит работу над окружающей
средой, при dv<0
(сжатие системы) работа совершается
окружающей средой над системой и
считается отрицательной. Для вычисления
интеграла в выражении (11) необходимо
знать функцию р=р(v)
(12).
Работа термодинамического процесса зависит от характера термодинамического процесса, а не состояния системы.
Нет функции, выражающей работу через параметры состояния, элементарная работа не обладает математическими свойствами полного дифференциала. Это бесконечно малое количество энергии, переданной рабочим телом окружающей среде определённым образом. То есть, если подынтегральное выражение не является полным дифференциалом некоторой функции, то интеграл по замкнутому контуру от такого выражения в конечном случае не равен нулю.
Следовательно,
для замкнутого термодинамического
цикла очевидно: система получит от
окружающей среды (или отдаст ей) некоторое
количество
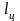 ,
причём в состоянии системы никаких
изменений не произойдёт:
,
причём в состоянии системы никаких
изменений не произойдёт:
 .
.
