
- •Рабочая учебная программа по дисциплине
- •Цель и задачи дисциплины
- •Тематическое содержание дисциплины
- •Материально-техническое обеспечение дисциплины
- •Методические указания для студентов
- •2.2. Понятие рабочего тела. Идеальный газ.
- •Термодинамические параметры состояния.
- •Давление.
- •2.3.2.Температура.
- •2.3.3. Удельный объём.
- •3.2. Первый закон термодинамики.
- •3.2. Работа. Свойства работы как формы обмена энергией.
- •3.3. Энтропия. Потенциалы и координаты термодинамических взаимодействий.
- •Это основное термодинамическое тождество.
- •4.2. Формулировка 2-го закона термодинамики.
- •5.2 Уравнение состояния реальных газов.
- •Лекция №6 термодинамические процессы. Методы их исследования.
- •6.2 Изобарный процесс.
- •6.3 Изотермический процесс.
- •6.4 Адиабатный процесс.
- •6.5 Политропный процесс и его обобщающее значение.
- •Лекция №7 газовые смеси. Влажный воздух как частный случай газовой смеси.
- •Лекция №8 первый закон термодинамики для открытых систем.
- •8.1 Уравнение 1-го закона термодинамики для открытой системы.
- •8.2 Истечение из суживающегося сопла.
- •8.3 Основные закономерности течения газа в соплах и диффузорах.
- •9.2 Обобщённый (регенеративный) цикл Карно.
- •9.3 Обратимый цикл Карно.
- •9.4 Изменение энтропии в необратимых процессах.
- •9.5 Максимальная работа. Эксергия.
- •Лекция №10 циклы теплосиловых установок.
- •10.1 Термодинамическая эффективность циклов тсу.
- •10.2 Циклы поршневых двигателей внутреннего сгорания.
- •10.3. Циклы газотурбинных установок.
- •Лекция №11. Превращение воды в пар. Цикл Ренкина. Дросселирование газов и паров.
- •11.2. Теплофикация.
- •11.3. Дросселирование газов и паров.
- •Лекция №14. Теплопроводность. Основные понятия и определения.
- •Теплопроводность
- •Лекция №15 конвективный теплообмен (теплоотдача) Основной закон конвективного теплообмена.
- •Теплоотдача при изменении агрегатного состояния вещества.
- •Лекция №16 лучистый теплообмен Описание процесса и основные определения
- •Основные законы лучистого теплообмена
- •Лекция №17 Теплопередача Сложный теплообмен
- •Теплопередача между двумя жидкостями через разделяющую их стенку
- •Основы теплового расчёта теплообменных аппаратов Типы теплообменных аппаратов
- •Виды теплового расчёта теплообменников
- •Закон смещения Вина
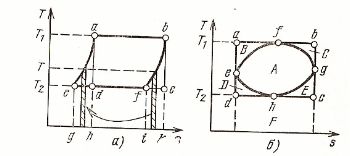
9.2 Обобщённый (регенеративный) цикл Карно.
При наличии только двух источников теплоты с температурами T1 и T2 осуществить более сложный цикл, если использовать регенерацию теплоты.
Краткая суть процесса, (см. рис. 9.2).
Цикл
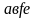 состоит из
2-х изотерм и 2-х произвольных процессов
состоит из
2-х изотерм и 2-х произвольных процессов
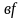 и
и
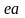 ,
,
линии
которых эквидистантны в T,
s-
диаграмме. Для равновесного нагрева по
и охлаждения по
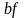 нужно большое количество источников,
но можно сделать следующее. Теплота
δq,
выделяемая при охлаждении, при изменении
температуры по линии
нужно большое количество источников,
но можно сделать следующее. Теплота
δq,
выделяемая при охлаждении, при изменении
температуры по линии
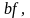 затрачивается на нагрев рабочего тела
при той же температуре по линии
затрачивается на нагрев рабочего тела
при той же температуре по линии
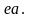 Ввиду эквидистантности эти количества
теплоты между собою равны. (площадь
Ввиду эквидистантности эти количества
теплоты между собою равны. (площадь
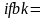 площади
площади
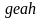 теплота, отданная при охлаждении по
линии
регенерируется полностью по линии
теплота, отданная при охлаждении по
линии
регенерируется полностью по линии
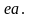
Таким образом от
горячего источника с температурой T1
поступает теплота, соответствующая
площади фигуры
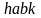 ,
и к холодному источнику с температурой
Т2 отводится теплота, соответствующая
площади фигуры
,
и к холодному источнику с температурой
Т2 отводится теплота, соответствующая
площади фигуры
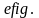 Для этого случая термический к.п.д. можно
найти из выражения:
Для этого случая термический к.п.д. можно
найти из выражения:
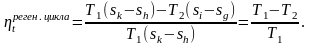
Обобщённые (регенеративные) циклы Карно имеют такой же термический к.п.д. как и циклы Карно. Любой другой обратимый цикл имеет меньше термического к.п.д. цикла Карно. Рассмотрим такой пример, который представлен на рисунке 9.2б.
Оба цикла
 обратимые, но
обратимые, но
 осуществляется при наличии большого
числа источников теплоты.
осуществляется при наличии большого
числа источников теплоты.
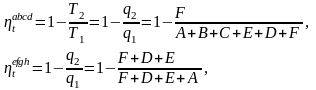
отсюда
явно видно
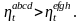
Вывод: при одинаковых предельных температурах обратимый цикл Карно имеет более высокий термический к.п.д., нежели любой другой обратимый цикл.
9.3 Обратимый цикл Карно.
Осуществим обратимый цикл Карно в обратном направлении.
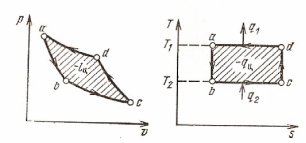
На
представленном рисунке рабочее тело
с параметрами в т.
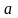 адиабатно расширяется, совершая работу
за счёт внутренней энергии, охлаждаясь
при этом до температуры Т2. Дальнейшее
расширение идёт изотермически, и рабочее
тело отбирает от нижнего источника
теплоту
и далее сжатие по адиабате с повышением
температуры от Т2 до Т1 с последующим
изотермическим сжатием с передачей
адиабатно расширяется, совершая работу
за счёт внутренней энергии, охлаждаясь
при этом до температуры Т2. Дальнейшее
расширение идёт изотермически, и рабочее
тело отбирает от нижнего источника
теплоту
и далее сжатие по адиабате с повышением
температуры от Т2 до Т1 с последующим
изотермическим сжатием с передачей
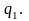
И это уже термодинамическая схема холодильной машины.
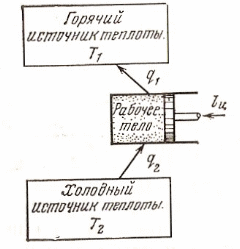
Сжатие
при более высокой температуре нежели
расширение (см. рис.), посему работа
сжатия больше работы расширения на
величину площади
 ограниченной контуром цикла. Эта
указанная работа превращается в теплоту
и вместе с теплотой
передаётся верхнему источнику.
ограниченной контуром цикла. Эта
указанная работа превращается в теплоту
и вместе с теплотой
передаётся верхнему источнику.
На осуществление
адиабатного цикла затрачена работа
благодаря чему переносим теплоту от
источника с низкой температурой к
источнику с более высокой температурой.
При этом нижний источник отдаёт
,
а верхний получит количество теплоты
 Обратный цикл Карно – идеальный цикл
холодильной машины и тепловых насосов.
Обратный цикл Карно – идеальный цикл
холодильной машины и тепловых насосов.
Эффект холодильной машины оценивается холодильным коэффициентом:
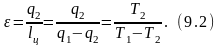
Второй закон в формулировке Р. Клаузиуса:
Теплота не может самопроизвольно переходить от тел с более низкой к телам с более высокой температурой.
9.4 Изменение энтропии в необратимых процессах.
Необратимость всегда приводит к увеличению энтропии рабочего тела при том же количестве подведённой теплоты и к потере части работы.
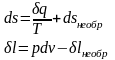
Если в адиабатно-изолированной системе осуществляются равновесные процессы, то энтропия системы остаётся постоянной.
Самопроизвольные процессы в изолированной системе всегда приводят к увеличению энтропии.
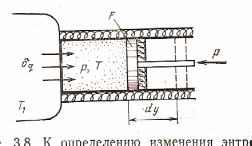
Для обратимого процесса, если система термодинамически представляет собой изображённую на схеме:
 опии
опии
в необратимых процессах.
Для данной схемы очевидно, что процесс будет обратимым, если Т=Т1, внешняя сила Р=рF, и не будет ни внешнего, ни внутреннего трения.
Работа расширения газа будет равна
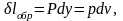
соответственно
изменение энтропии
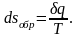
Если эти условия не выполняются, и имеет место скажем сила внутреннего или внешнего трения, то
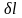 будет уже меньше
будет уже меньше
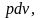 часть работы пойдёт на преодоление сил
трения и эта работа вся перейдёт в
теплоту
часть работы пойдёт на преодоление сил
трения и эта работа вся перейдёт в
теплоту
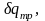 соответственно
возрастёт энтропия
соответственно
возрастёт энтропия
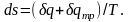
При отсутствии механического равновесия, поршень приобретает ускорение, завихрения в газе при торможении под действием внутреннего трения также перейдут в теплоту и опять уменьшится работа, возрастёт энтропия.
Необратимость, вызванная теплообменом с окружающей средой:
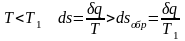 при меньшей
температуре газа
при меньшей
температуре газа
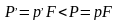 соответственно
соответственно
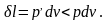
Положение для самопроизвольных процессов состоит втом, что энтропия системы в этом случае всегда возрастает.
 справедливо только
по отношению к изолированным
термодинамическим системам.
Если же система не изолирована, то её
энтропия может убывать, однако суммарное
изменение энтропии системы и энтропии
внешних сил всегда положительно (либо
н0ль, если протекают равновесные процессы
в термодинамической системе).
справедливо только
по отношению к изолированным
термодинамическим системам.
Если же система не изолирована, то её
энтропия может убывать, однако суммарное
изменение энтропии системы и энтропии
внешних сил всегда положительно (либо
н0ль, если протекают равновесные процессы
в термодинамической системе).
Состояние системы с максимальной энтропией является наиболее устойчивым состоянием изолированной системы. Самопроизвольные процессы в системе могут протекать, пока система не достигла равновесия.
