
- •Техническая термодинамика
- •Содержание
- •Введение
- •Лекция 1 Предмет термодинамика и основные понятия термодинамики.
- •Состояние термодинамической системы
- •Давление
- •Лекция 2 Температура
- •Лекция 3 Уравнение состояние системы
- •Взаимодействие систем с окружающей средой. Параметры взаимодействия.
- •Лекция 4 Термодинамический процесс
- •Лекция 5 Теплота
- •Энтропия системы
- •Лекция 6 Теплоёмкость
- •Лекция 7 Внутренняя энергия
- •Первый закон термодинамики для замкнутой термодинамической системы
- •Энтальпия
- •Лекция 8 Первый закон для термодинамики для потока
- •Основные термодинамические процессы в области газа
- •Изохорный процесс
- •Изобарный процесс
- •Изотермический процесс
- •Лекция 9 Адиабатный процесс
- •Политропный процесс
- •Лекция 10 Процесс дросселирования
- •Влажный пар
- •Лекция 12 Термодинамический цикл
- •Прямой цикл
- •Обратные циклы
- •Лекция 13 Обратимый цикл Карно
- •Сравнение обратимого цикла Карно с другими циклами
- •Лекция 14 Второй закон термодинамики
- •Принцип возрастания энтропии. Уравнение Гюи – Стодолы
- •Лекция 15 Влажный воздух
- •Лекция 16 Циклы поршневых двигателей внутреннего сгорания (двс)
- •Цикл двс с изохорным подводом теплоты
- •Цикл двс с изобарным подводом теплоты
- •Цикл двс с изобарно-изохорным подводом теплоты
- •Циклы паросиловых установок
- •Заключение
- •Библиография
Основные термодинамические процессы в области газа
К основным термодинамическим процессам относиться: изохорный, изобарный, изотермический, адиабатный, политропный и процесс дросселирования.
Изохорный процесс
Изохорный процесc- это процесс, протекающий при постоянном объеме
V=ConsT; dV=0.
Для идеального газа уравнение изохорного процесса, связывающие между собой основные термодинамические параметры, вытекает из уравнения состояния идеального газа.
Если m и V – постоянные величины, то постоянно и отношение
![]() .
.
Это же соотношение можно выразить через начальные и конечные параметры
|
(88) |
Уравнение (88) и является уравнением изохорного процесса. Из него следует, что при увеличении температуры давление газа возрастает.
Работа в изохорном процессе равна нулю
![]() ,
,
т.к. объём газа не изменяется. Поэтому теплота, подведенная или отведенная, определяется, на основе 1-го закона термодинамики, как
|
(89) |
где m – масса газа.
Изображение изохорных процессов в P-V диаграмме представлено на рис. 19
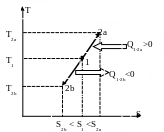
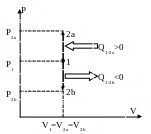
Рис. 19 Рис. 20.
Процесс 1-2a протекает с повышением давления, 1-2b – с понижением. Т.к. давление в процессе 1-2a повышается, то, в силу (88), возрастает и температура, что, в свою очередь говорит о том (см. (89)), что теплота положительна, т.е. подводится. В процессе 1-2b теплота отрицательна и отводится.
Чтобы
получить изображение изохорного процесса
и T-S
диаграмме, надо получить зависимость
температуры T
от энтропии s
для изохорного процесса. Для этого
подставив выражение
![]() в (45), получим
в (45), получим
![]() .
.
Проинтегрировав это выражение в пределах от T1 до T, получим
![]() .
.
Из этого уравнения следует, что
|
(90) |
Таким образом, изохора в T-S диаграмме является графиком экспоненты, которую, учитывая удалённость рассматриваемой области от начала координат, можно изображать наклонной прямой (см. рис. 20).
Изобарный процесс
Изобарный процесc - это процесс, протекающий при постоянном давлении
P=ConsT; dP=0.
Для идеального газа уравнение изобарного процесса, связывающие между собой основные термодинамические параметры, вытекает из уравнения состояния идеального газа.
Если m и Р – постоянные величины, то постоянно и отношение
![]() .
.
Это же соотношение можно выразить через начальные и конечные параметры
|
(91) |
Уравнение (88) и является уравнением изобарного процесса. Из него следует, что при увеличении температуры объём газа возрастает.
Работа в изохорном процессе определяется выражением
|
(92) |
Предпоследнее равенство основано на уравнении состояния идеального газа.
Количество теплоты, которым система обменялось с окружающей средой, можно определить, с одной стороны, через теплоёмкость
|
(93) |
а с другой стороны, через первый закон термодинамики
|
(94) |
Сравнивая выражения (93) и (94), можно получить уравнение Майера, связывающее изобарную и изохорную теплоёмкости
|
(95) |
которое справедливо только для идеального газа. Из этого уравнения следует, что изобарная теплоёмкость газа больше изохорной теплоёмкости.
Изображение изобарных процессов в P-V диаграмме представлено на рис. 21
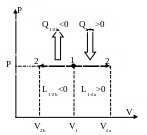
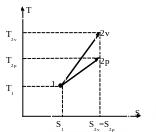
Рис. 21 Рис. 22.
Процесс 1-2a протекает с повышением объёма, 1-2b – с понижением. Поэтому работа в процессе 1-2a положительна, т.е. совершается системой, а в процессе 1-2b – отрицательна, т.е подводится к системе извне.
Т.к. объём в процессе 1-2a увеличивается, то на основе (91) температура возрастает, а это означает, в соответствии с (93), что теплота положительна и подводится к газу. Соответственно, в процессе 1-2b температура понижается, а теплота отводится, т.е. отрицательна.
Чтобы получить изображение изохорного процесса и T-S диаграмме, надо получить зависимость температуры T от энтропии s для изобарного процесса. Рассуждения в этом случае проводятся точно такие же, как и в случае изохорного процесса. В результате получается следующая зависимость температуры от энтропии
|
(96) |
Отличие от изохорного процесса состоит в том, что в знаменателе показателя степени экспоненты находится изобарная теплоёмкость. Т.к. она меньше изохорной, то показатель экспоненты в изобарном процессе меньше показателя экспоненты для изохорного процесса. Это значит, что график изохорного процесса в T-S диаграмме идёт «круче» графика изобарного процесса (на рис. 22 изохорный процесс изображён линией 1-2v, а изобарный – линией 1-2р). Этот факт можно обобщить и утверждать, что изохорный процесс в любой области T-S диаграммы идёт «круче» изобарного.

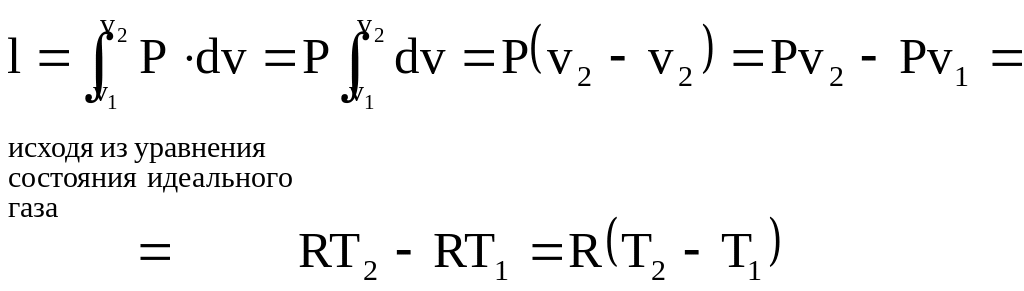 .
.