
- •Кислотно-основная классификация катионов
- •Скорость химической реакции и химическое равновесие.
- •Основные положения теории растворов электролитов. Общая (аналитическая) концентрация и активность ионов в растворе, их взаимосвязь.
- •Степень электролитической диссоциации
- •Константа диссоциации слабого электролита
- •Коэффициент активности и ионная сила
- •Кислотно-основные равновесия в водных растворах. Водородный показатель рН и кислотность среды. Контроль за кислотностью среды.
- •Ипо для некоторых индикаторов приведены в таблице:
- •Действие одноименных ионов
- •Произведение растворимости
- •Поведение сильных и слабых одноосновных кислот в водных растворах.
- •Поведение сильных и слабых однокислотных оснований в водных растворах.
- •3. Слабые многокислотные основания
- •Поведение сильных и слабых многоосновных кислот в водных растворах
- •4. Расчет pH смеси кислот или оснований
- •Количественный анализ
- •Гравиметрический анализ
- •Титриметрический анализ
- •Индикаторы в методе кислотно-основного титрования
- •Комплексонометрическое титрование
- •(Окраска 1) (окраска 2)
- •(Окраска 2) (окраска 1)
- •Способы комплексонометрического титрования.
- •Окислительно-восстановительное титрование
- •Перманганатометрия
- •Физико-химические методы анализа
- •Оптические и спектральные методы
- •Фотометрические методы анализа
- •Электрохимические методы анализа
- •Хроматографические методы анализа. Классификация методов, применение их в анализе.
- •Основная литература
- •Дополнительная литература
3. Слабые многокислотные основания
![]()
Например, рассчитать
pH
0,01М раствора
![]() .
Фосфат-ион ведет себя в растворе следующим
образом:
.
Фосфат-ион ведет себя в растворе следующим
образом:
![]()
Фосфат-ион является слабым основание и pH рассчитывают по формуле
![]()
Поведение сильных и слабых многоосновных кислот в водных растворах
1. Сильные многоосновные кислоты (HnX) в водных растворах диссоциируют полностью по уравнению:
HnX → nH + + Xn-
следовательно: [Н+] = n C(HnX) и рН = -lgn C(HnX)
Пример сильной двухосновной кислоты – серная кислота H2SO4 . Например, в 0,1 М растворе H2SO4:
H2SO4 → 2H + + SO4 2- рН = -lg2 C(H2SO4) = -lg0,2 = 0,7.
2. Слабые многоосновные кислоты (HnA) в водных растворах диссоциируют ступенчато и каждой ступени диссоциации отвечает своя ступенчатая константа кислотной диссоциации Kai. При этом величина каждой последующей константы превышает значение предыдущей. Например, для двухосновных слабых кислот Н2А процессы диссоциации выглядят следующим образом:
I
ступень: Н2А
↔ Н+
+ НА-
![]() - первая константа диссоциации
- первая константа диссоциации
II
ступень: НА-
↔ Н+
+ А2-
![]() - вторая константа диссоциации
- вторая константа диссоциации
Ka1 > Ka2, так как положительно заряженному иону водорода легче оторваться от нейтральной молекулы кислоты, чем от отрицательно заряженного гидроаниона.
В таблице приведены ступенчатые константы диссоциации некоторых двухосновных кислот:
Кислота |
|
|
|
|
|
|
|
|
|
|
|
Формально суммарное уравнение диссоциации двухосновной слабой кислоты имеет вид:
Н2А ↔ 2Н+ + А2-
и ему соответствует общая (суммарная) константа кислотной диссоциации:
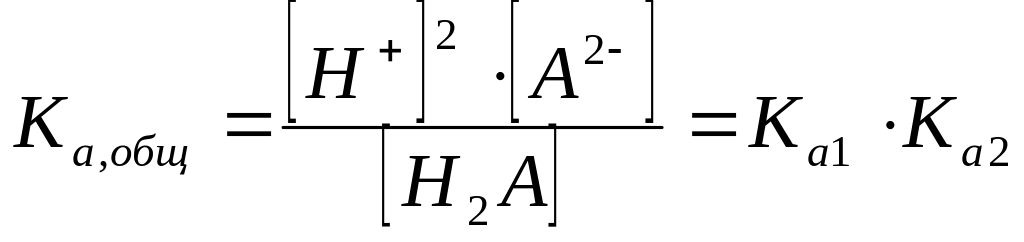
чье значение равно
произведению ступенчатых констант
диссоциации. Так как диссоциация
многоосновной кислоты по первой ступени
всегда протекает значительно сильнее,
то и расчет рН в ее растворе проводится
с использованием первой константы
диссоциации и при условии, что
![]() а
а
![]() имеем
имеем
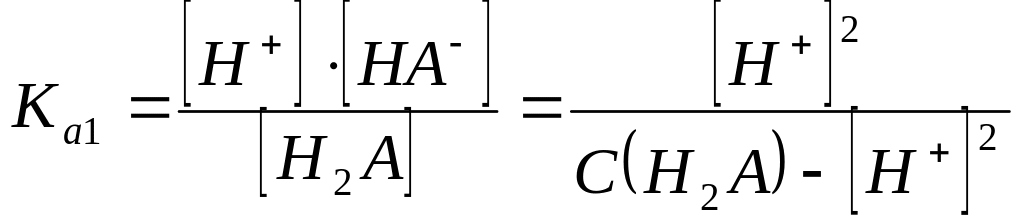
Тогда, если α
< 0, то
![]() .
.
![]() .
.
При α > 0,1 для определения решают квадратное уравнение. Затем рассчитывают pH.
Равновесную концентрацию аниона [А2-] находят из второй константы диссоциации кислоты:
Так как
,
то
![]() .
.
По первой ступени рассчитывается рН и в растворах других многоосновных кислот, например, трехосновных H3PO4, H3AsO4, H3SbO3 и т.д.
4. Расчет pH смеси кислот или оснований
Допустим в растворе присутствуют две кислоты – А1 и А2. Если одна из кислот сильнее другой, то почти всегда можно пренебречь протолизом. В том случае если кислоты сопоставимы по силе, необходимо учитывать диссоциацию или протолиз обоих кислот. Таким образом:
![]()
ЛЕКЦИЯ № 4
План лекции:
1. Структура количественного анализа.
2. Гравиметрический анализ.
3. Титриметрический анализ: кислотно-основное, компексонометрическое, окислительно-восстановительное, осадительное титрование.
4. Физико-химические методы анализа
Количественный анализ
Количественный анализ — раздел аналитической химии, в задачу которого входит определение количества (содержания) элементов (ионов), радикалов, функциональных групп, соединений или фаз в анализируемом объекте. Количественный анализ позволяет установить элементный и молекулярный состав исследуемого объекта или содержание отдельных его компонентов. В зависимости от объекта исследования различают неорганический анализ и органический анализ. В свою очередь их разделяют на элементный анализ, задача которого — установить, в каком количестве содержатся элементы (ионы) в анализируемом объекте, и на молекулярный и функциональный анализы, дающие ответ о количественном содержании радикалов, соединений, а также функциональных групп атомов в анализируемом объекте. Методы количественного анализа можно разделить на три большие группы: химические, физические, физико-химические. Химические методы анализа, хотя и являются в настоящее время основными в химических лабораториях, во многих случаях не отвечают возросшим требованиям к анализу, таким как высокая чувствительность, экспрессность, селективность, автоматизация и др. Этих недостатков лишены инструментальные методы анализа, которые можно разделить на три большие группы: оптические, электрохимические, хроматографические. Классическими методами количественного анализа являются гравиметрический (весовой) анализ и титриметрический (объемный) анализ.
