
- •Қазақстан республикасы білім және ғылым министрлігі қ. Жұбанов атындағы ақтөбе өңірлік мемлекеттік университеті
- •Дәрістік кешен
- •Негізгі түсініктер
- •Кинетиканың негізгі заңы.
- •Үдерістің молекулалығы мен реті.
- •0,1,2,3 Және n-ші ретті химиялық үдерістер
- •Реакция ретін анықтау әдістері
- •Әдебиеттер тізімі
- •Күрделі үдерістердің кинетикасы
- •Күрделі үдерістердің кинетикасының негізгі принциптері
- •Тізбектес үдерістердің кинетикасы
- •Параллель үдерістердің кинетикасы
- •1) Егер
- •2) Егер
- •Қайтымды үдерістердің кинетикасы
- •Әдебиеттер тізімі
- •Үдеріс жылдамдығына әр түрлі фкторлардың әсер етуі
- •Реагент табиғатының әсері
- •Реагент табиғатының әсері.
- •Көлемнің әсері.
- •Концентрация әсері.
- •Қысымның әсері
- •Температураның әсері
- •Белсендіру энергиясы
- •Әдебиеттер тізімі
- •Кинетика теориялары
- •Белсенді соқтығысулар теориясы (бст)
- •Аррениустың реакция жылдамдығының эмперикалық теңдігін талдау.
- •Бст теориясының негізгі түсініктері
- •Бст теориясының артықшылықтары мен кемшіліктері.
- •Белсенді комплекс теориясының негізгі түсініктері (бкт).
- •Белсенді комплекс теориясының ерекшеліктері.
- •Әдебиеттер тізімі
- •Гетерогенді үдерістердің кинетикасы
- •Гетерогенді үдерістердің механизмін талдау
- •Диффузия
- •Молекулалық диффузияның, стационарлы және стационарлы емес үдерістердің кинетикасы
- •Конвективті диффузия.
- •Диффузия жылдамдығының температураға тәуелділігі
- •Әдебиеттер тізімі
- •Масса берілу. Ұқсастық теориялары
- •Масса берілу
- •Сыртқы масса берілу.
- •Ішкі масса берілу.
- •Ұқсастық теориясының негіздері
- •Нюссельт критериясын талдау
- •Рейнольдс критериясын талдау
- •Прандтл критериясын талдау
- •Пекле критериясын талдау
- •Әдебиеттер тізімі
- •Адсорбциялық үдерістердің термодинамикасы мен кинетикасы
- •Сорбциялық құбылыстардың негізгі түсініктері
- •Адсорбцияның ерекшеліктері.
- •Мономолекулалық адсорбцияның теориялары. Лэгмюр теориясы
- •Фрейндлих теориясы
- •Полемолекулалық адсорбцияның теориясы. Бэт теориясы
- •Әдебиеттер тізімі
- •Беттік керілістің термодинамикасы мен кинетикасы
- •Беттік керілістің термодинамикасы мен кинетикасы
- •Б еттік керілістің механизмі.
- •Беттік белсенді және инбелсенді заттар. Адсорбцияның механизмі
- •Адсорбция мен беттік керіліс арасындағы тәуелділік
- •Әдебиеттер тізімі
- •Катализ. Гомогенді және гетерогенді катализ
- •Катализдің негізгі түсініктері
- •Катализ үдерісінің классификациясы
- •Катализаторлардың негізгі белгілері.
- •Гомогенді катализ механизмі
- •Гетерогенді катализ механизмі.
- •Катализ теориялары
- •Менделеев теориясы – деформациялық теория
- •Зелинский теориясы – химиялық теория
- •Боденштейн теориясы – физика-химиялық теория
- •Баландин теориясы – мультиплетті теория.
- •Кобозев теориясы – белсенді ансамбльдер теориясы
- •Әдебиеттер тізімі
- •Фазалық тепе-теңдіктің термодинамикалық теориясы
- •Фазалық тепе-теңдіктің негізгі теориялары
- •Фазалық тепе-теңдіктің негізгі түсініктер
- •Гиббстің фазалар ережесі
- •Жүйені физико-химиялық талдау
- •Әдебиеттер тізімі
- •Бір компонентті жүйелердің диаграммасын термодинамикалық және фазалық талдау
- •Бір компонентті жүйелердің диаграммалары туралы негізгі түсініктер.
- •Бір компонентті жүйелердің термодинамикасы
- •Үздіксіз және сәйкестік принциптері
- •Су диаграммасын талдау
- •Полиморфизм
- •Күкірт диаграммасын талдау
- •Әдебиеттер тізімі
- •Екі компонентті жүйелердің диаграммасын тұрғызу және фазалық талдау
- •Екі компонентті жүйелердің күй теңдігі
- •Салқындау қисықтарын тұрғызу әдістемесі
- •Екі компонентті жүйелердің диаграммасын тұрғызу әдістемесі
- •Гиббстің фазалар ережесі бойынша диаграмманы талдау
- •Канода бойынша диаграмманы талдау
- •Кристалдану реттілігі диаграмманы талдау
- •Екі компонентті жүйелердің диаграммаларын талдау жоспары
- •Әдебиеттер тізімі
- •Екі компонентті жүйелердің әр түрлі типті диграммаларын талдау
- •Екі компонентті жүйелердің күй диаграммаларының геометриялық белгілері.
- •Конгруэнтті балқу нүктесі бар екінші типті диаграмманы талдау.
- •Инконгруэнтті балқу нүктесі бар үшініші типті диаграмманы талдау
- •Шексіз еритін төртінші типті диаграмманы талдау
- •Қатты күйде шекті еритін бесінші типті диаграмманы талдау.
- •Сұйық күйде шекті еритін алтыншы типті диаграмманы талдау.
- •Екікомпонентті жүйенің күрделі диаграммалары
- •Әдебиеттер тізімі
- •Үш компонентті жүйелердің диаграммаларын тұрғызу және талдау әдістемесі
- •Үш компонентті жүйелердің термодинамикасы.
- •Үш компонентті жүйелердің құрамын талдау әдістемесі.
- •Кеңістік диаграмманы тұрғызу және талдау.
- •Жазықтық диаграмманы тұрғызу және талдау.
- •Диаграммалардағы сипаттамалық нүктелердің толық талдау:
- •Әдебиеттер тізімі
- •Геометриялық термодинамика
- •Термодинамикалық потенциалдардың концентрациялық тәуелділігі
- •Жүйедегі фазалар тепе-теңдігіне қысымның әсері.
- •Екі тұздардың ерітіндісіндегі фазалық тепе-теңдік
- •Фазалық күй диаграммасын талдау мен термодинамикалық есептеу мәселесінің қазіргі күйі
- •Фазалық тепе-теңдік диаграммаларын термодинамикалық есептеу және талдау мәселелерінің заманауи күйі
- •Әдебиеттер тізімі
Диффузия
Диффузия деген зерттелетін жүйенің көлемі бойынша концентрацияның өздігінен теңесуі.
Диффузияның механизмі реагенттердің агрегаттық күйімен анықталады:
Газдар үшін: Ддиффузия механизмі жүйе бөлшектерінің ретсіздік, жылулыөқ қозғалысымен анықталады немесе бос жүріс ұзындығымен сандық сипатталады.
Сұйық ортада: Диффузия механизмі сұйықтық қабаттарынің қозғалысымен анықталады, яғни актривті диффузиямен анықталады.
Қатты ортада: Диффузия мехизмі реагенттердің құрылымымен анықталады.
![]()
- көлемді механизм
![]()
- циклды
![]()
- ваканты
Молекулалық диффузияның, стационарлы және стационарлы емес үдерістердің кинетикасы
Молекулалық және конвективті диффузияны айырады.
Молекулалық диффузия деп жүйе бөлшектерінің жылулық ретсіздік қозғалысы арқылы атқарылатын диффузияны атайды.
Диффузиялық үдерістер стационарлы және стационарлы емес деп екіге бөлінеді.

Стационарлы үдеріс деп берілген бағытта бағытта немесе берілген көлемде зат массасының жинақталуы жүрмейтін үдерістерді айтады. П1 = П2
Стационарлы емес үдеріс деп берілген бағытта немесе көлемінде зат массаның жинақталу жүретін үдерістерді айтады. П1 > П2
Молекулалық диффузияның жылдамдығы Фиктің екі заңымен анықталады.
Ф![]() иктің
1-ші заңы: Диффузия
барысында тасмалданатын реагенттердің
массасы қимаға, уақытқа және концентрация
градиентіне тура пропорционал.
иктің
1-ші заңы: Диффузия
барысында тасмалданатын реагенттердің
массасы қимаға, уақытқа және концентрация
градиентіне тура пропорционал.
![]()
 ~
~
(1)
![]()
![]()
(2),
![]()
мұндағы - концентрация градиенті
Концентрация градиенті деп реагенттер концентрацияларының берілген бағытта (dx) немесе көлемде (dq+dz) өзгеруін атайды.
Д – диффузия коэффициенті.
Диффузиялық коэффициент – концентрация градиенті бірге тең болғандағы молекулалық диффузияның жылдамдығы.
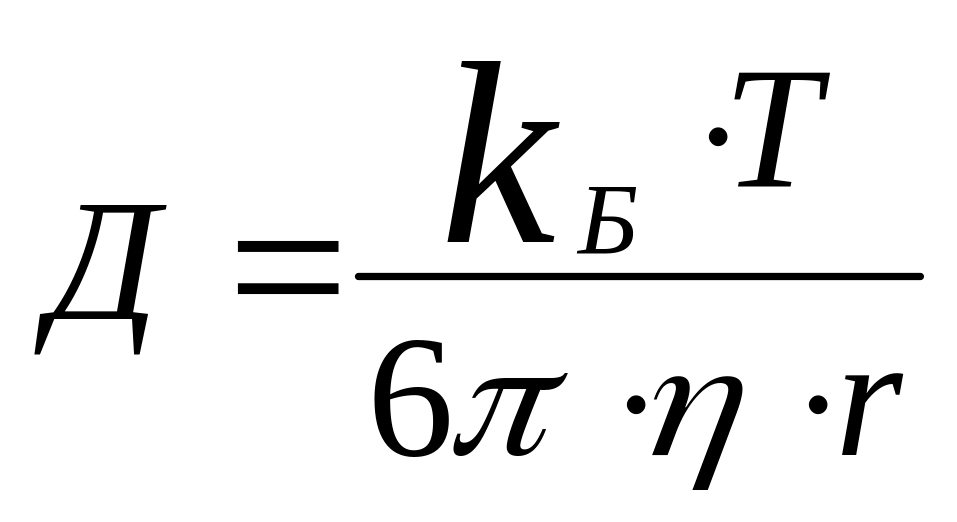
(3),
мұндағы η – тұтқырлық.
Фиктің 2-ші заңы: Стационарлы емес үдерістердің молекулалық диффузиясының жылдамдығы концентрация градиентінің екінші туындысына тура пропорционалды болады.

(4)
Конвективті диффузия.
Конвективті диффузия деп молекулалық диффузия және ағын есебінен масса берілуі арқылы іске асырылатын диффузия аталады. Диффузиялық ағын деп уақыт бірлігінде аудан бірлігі арқылы тасымалданатын зат мөлшері аталады.
Конвективті диффузияның жылдамдығы ағын және молекулалық диффузия жылдамдығының қосындысына тең.
![]()
![]() (1)
(1)
![]()
 (2),
(2),
мұндағы α – конвективті диффузияның коэффициенті.
Конвективті диффузия коэффициенті деп концентрация градиенті 1-ге тең болғандағы жылдамдықты атайды.
Диффузия жылдамдығының температураға тәуелділігі
Температураның диффузия жылдамдығына әсері температуралық облысқа тәуелді.
Вант-Гофф ережесі: Төмен температуралар облысында температураның әрбір 10 º-қа жоғарылауы жылдамдықтың 1,1÷1,5 есе артуына әкеледі.
![]() (1)
(1)
Ізінше
![]() (2)
(2)
![]() (3)
(3)
Аррениус ережесі: Жоғары температуралар облысында жылдамдық тұрақтысының логарифмі кері температураға тура пропорционал.
|
|
Гетерогенді үдеріс аралас бақылауда жүрген кезде диффузия үдерісі төмен температуралар облысында өтеді, ал химиялық әрекеттесу үдерісті жоғары температуралар облысында анықтайды.

Бақылау сұрақтары:
1. Физикалық ұғымдар: кинетикалық облыс; диффузиялық облыс; молекулалық диффузия; конвективті диффузия; стационарлы үрдіс; диффузия коэффициенті.
2. Фиктің бірінші заңының тұжырымдамасы мен формуласы.
3. Фиктің екінші заңының тұжырымдамасы мен формуласы.
4. Молекулалық және конвективті диффузияның жылдамдығы қалай анықталады?
Глоссарий:
Кинетикалық облыс – үдеріс жылдамдығы реакция жылдамдығымен лимиттелетін болғандағы күрделі гетерогенді үдерістердің облысы.
Диффузиялық облыс – үдеріс жылдамдығы диффузия жылдамдығымен лимиттелетін болғандағы күрделі үдерістің облысы.
Диффузия – зерттелетін жүйенің көлемі бойынша концентрацияның өздігінен теңесуі.
Молекулалық диффузия – жүйе бөлшектерінің жылулық ретсіздік қозғалысы арқылы атқарылатын диффузия.
Стационарлы үдеріс – берілген бағытта бағытта немесе берілген көлемде зат массасының жинақталуы жүрмейтін үдерістерді айтады.
Стационарлы емес үдеріс – берілген бағытта немесе көлемінде зат массаның жинақталу жүретін үдерістерді айтады.
Концентрация градиенті – реагенттер концентрацияларының берілген бағытта (dx) немесе көлемде (dq+dz) өзгеруі.
Диффузиялық коэффициент – концентрация градиенті бірге тең болғандағы молекулалық диффузияның жылдамдығы.
Конвективті диффузия – молекулалық диффузия және ағын есебінен масса берілуі арқылы іске асырылатын диффузия.
Блиц-тест:
1. Химиялық кинетикада диффузия деп нені атайды?
a) Концентрацияның өздігінен теңесу үрдісі
b) Температураның өздігінен теңесу үрдісі
c) Концентрацияның өзгеру үрдісі
d) Реакцияласушы аймаққа реагенттердің тасымалдануы
e) Реагенттерді ағын арқылы тасымалдау үрдісі
2. Қандай үрдіс станционарлы деп аталады? Стационарлы үрдіс деп:
a) Жүру барысында реагенттер массасы жинақталмайтын диффузиялы үрдісті атайды
b) Жүру барысында реагенттер массасы жинақталатын диффузиялы үрдісті атайды
c) Жүру барысында диффузия жылдамдығы өзгермейтін диффузиялы үрдісті атайды
d) Жүру барысында диффузия механизмі өзгермейтін диффузиялы үрдісті атайды
e) Жүру барысында ағын жылдамдығы өзгермейтін диффузиялы үрдісті атайды
3. Конвективті диффузия дегеніміз не? Конвективті диффузия деп:
a) Реагенттерді реакцияласушы аймаққа жылулық қозғалыс арқылы және ағын арқылы тасымалдау нәтижесінде жүзеге асырылатын диффузияны атайды
b) Концентрацияның өздігінен теңесу нәтижесінде жүзеге асырылатын диффузияны атайды
c) Реагенттер бөлшектерінің жылулық қозғалысы нәтижесінде жүзеге асырылатын диффузияны атайды
d) Реагенттер бөлшектерінің бағытталған қозғалысы нәтижесінде жүзеге асырылатын диффузияны атайды
e) Реагенттер бөлшектерінің жылулық қозғалысы нәтижесінде жүзеге асырылатын диффузияны атайды
4. Фиктің екінші заңы қалай оқылады? Молекулалық диффузияның жылдамдығы ... тура пропорционалды болады
a) Стационарлы емес процестер үшін концентрация градиентінің екінші туындысына
b) Стационарлы емес процестер үшін концентрация градиентінің бірінші туындысына
c) Стационарлы процестер үшін концентрация градиентінің екінші туындысына
d) Стационарлы процестер үшін концентрацияның градиентіне
e) Реагенттердің концентрациясына
5. Төмен температуралар облысында диффузияның жылдамдығына температураның әсері қандай?
a)
![]()
b)

c)
![]()
d)
![]()
e)
![]()
6. Қандай координаттарда диффузияның температураға тәуелділігі түзусызықты болады?
a)
![]()
b)
![]()
c)
![]()
d)
![]()
e)
![]()
7. Концентрация градиенті дегенімзі не?
a) Берілген бағытта реагенттер концентрациясының өзгерісі
b) Үрдіс температурасының өзгеруімен бірге концентрация өзгерісі
c) Реагенттердің бастапқы концентрациясы
d) Үрдіс барысында реагенттер концентрациясының өзгерісі
e) Уақыт моментінде реагент концентрациясының өзгерісі
8. Молекулалық диффузия деген не? Молекулалық диффузия деп ... арқылы атқарылатын диффузияны айтады:
a) Бөлшектердің жылулық қозғалысы
b) Бөлшектердің бағытталған қозғалысы
c) Реагенттердің реакциялық зонаға жылулық қозғалыс және ағыспен тасымалдау
d) Концентрацияның өздігінен теңесуі
e) Реагенттер бөлшектерінің механикалық қозғалысы
9. Фиктің бірінші заңы қалай оқылады? Молекулалық диффузияның жылдамдығы ... тура пропорционалды болады
a) Стационарлы процестер үшін концентрацияның градиентіне
b) Стационарлы емес процестер үшін концентрацияның градиентіне
c) концентрацияның градиентіне
d) Реагенттердің концентрациясына
e) Концентрация градиентінің екінші туындысына
10. Фиктің II – ші заңының теңдеуін көрсетіңдер
a)
![]()
b)
![]()
c)
![]()
d)
![]()
e)
![]()

