
- •Қазақстан республикасы білім және ғылым министрлігі қ. Жұбанов атындағы ақтөбе өңірлік мемлекеттік университеті
- •Дәрістік кешен
- •Негізгі түсініктер
- •Кинетиканың негізгі заңы.
- •Үдерістің молекулалығы мен реті.
- •0,1,2,3 Және n-ші ретті химиялық үдерістер
- •Реакция ретін анықтау әдістері
- •Әдебиеттер тізімі
- •Күрделі үдерістердің кинетикасы
- •Күрделі үдерістердің кинетикасының негізгі принциптері
- •Тізбектес үдерістердің кинетикасы
- •Параллель үдерістердің кинетикасы
- •1) Егер
- •2) Егер
- •Қайтымды үдерістердің кинетикасы
- •Әдебиеттер тізімі
- •Үдеріс жылдамдығына әр түрлі фкторлардың әсер етуі
- •Реагент табиғатының әсері
- •Реагент табиғатының әсері.
- •Көлемнің әсері.
- •Концентрация әсері.
- •Қысымның әсері
- •Температураның әсері
- •Белсендіру энергиясы
- •Әдебиеттер тізімі
- •Кинетика теориялары
- •Белсенді соқтығысулар теориясы (бст)
- •Аррениустың реакция жылдамдығының эмперикалық теңдігін талдау.
- •Бст теориясының негізгі түсініктері
- •Бст теориясының артықшылықтары мен кемшіліктері.
- •Белсенді комплекс теориясының негізгі түсініктері (бкт).
- •Белсенді комплекс теориясының ерекшеліктері.
- •Әдебиеттер тізімі
- •Гетерогенді үдерістердің кинетикасы
- •Гетерогенді үдерістердің механизмін талдау
- •Диффузия
- •Молекулалық диффузияның, стационарлы және стационарлы емес үдерістердің кинетикасы
- •Конвективті диффузия.
- •Диффузия жылдамдығының температураға тәуелділігі
- •Әдебиеттер тізімі
- •Масса берілу. Ұқсастық теориялары
- •Масса берілу
- •Сыртқы масса берілу.
- •Ішкі масса берілу.
- •Ұқсастық теориясының негіздері
- •Нюссельт критериясын талдау
- •Рейнольдс критериясын талдау
- •Прандтл критериясын талдау
- •Пекле критериясын талдау
- •Әдебиеттер тізімі
- •Адсорбциялық үдерістердің термодинамикасы мен кинетикасы
- •Сорбциялық құбылыстардың негізгі түсініктері
- •Адсорбцияның ерекшеліктері.
- •Мономолекулалық адсорбцияның теориялары. Лэгмюр теориясы
- •Фрейндлих теориясы
- •Полемолекулалық адсорбцияның теориясы. Бэт теориясы
- •Әдебиеттер тізімі
- •Беттік керілістің термодинамикасы мен кинетикасы
- •Беттік керілістің термодинамикасы мен кинетикасы
- •Б еттік керілістің механизмі.
- •Беттік белсенді және инбелсенді заттар. Адсорбцияның механизмі
- •Адсорбция мен беттік керіліс арасындағы тәуелділік
- •Әдебиеттер тізімі
- •Катализ. Гомогенді және гетерогенді катализ
- •Катализдің негізгі түсініктері
- •Катализ үдерісінің классификациясы
- •Катализаторлардың негізгі белгілері.
- •Гомогенді катализ механизмі
- •Гетерогенді катализ механизмі.
- •Катализ теориялары
- •Менделеев теориясы – деформациялық теория
- •Зелинский теориясы – химиялық теория
- •Боденштейн теориясы – физика-химиялық теория
- •Баландин теориясы – мультиплетті теория.
- •Кобозев теориясы – белсенді ансамбльдер теориясы
- •Әдебиеттер тізімі
- •Фазалық тепе-теңдіктің термодинамикалық теориясы
- •Фазалық тепе-теңдіктің негізгі теориялары
- •Фазалық тепе-теңдіктің негізгі түсініктер
- •Гиббстің фазалар ережесі
- •Жүйені физико-химиялық талдау
- •Әдебиеттер тізімі
- •Бір компонентті жүйелердің диаграммасын термодинамикалық және фазалық талдау
- •Бір компонентті жүйелердің диаграммалары туралы негізгі түсініктер.
- •Бір компонентті жүйелердің термодинамикасы
- •Үздіксіз және сәйкестік принциптері
- •Су диаграммасын талдау
- •Полиморфизм
- •Күкірт диаграммасын талдау
- •Әдебиеттер тізімі
- •Екі компонентті жүйелердің диаграммасын тұрғызу және фазалық талдау
- •Екі компонентті жүйелердің күй теңдігі
- •Салқындау қисықтарын тұрғызу әдістемесі
- •Екі компонентті жүйелердің диаграммасын тұрғызу әдістемесі
- •Гиббстің фазалар ережесі бойынша диаграмманы талдау
- •Канода бойынша диаграмманы талдау
- •Кристалдану реттілігі диаграмманы талдау
- •Екі компонентті жүйелердің диаграммаларын талдау жоспары
- •Әдебиеттер тізімі
- •Екі компонентті жүйелердің әр түрлі типті диграммаларын талдау
- •Екі компонентті жүйелердің күй диаграммаларының геометриялық белгілері.
- •Конгруэнтті балқу нүктесі бар екінші типті диаграмманы талдау.
- •Инконгруэнтті балқу нүктесі бар үшініші типті диаграмманы талдау
- •Шексіз еритін төртінші типті диаграмманы талдау
- •Қатты күйде шекті еритін бесінші типті диаграмманы талдау.
- •Сұйық күйде шекті еритін алтыншы типті диаграмманы талдау.
- •Екікомпонентті жүйенің күрделі диаграммалары
- •Әдебиеттер тізімі
- •Үш компонентті жүйелердің диаграммаларын тұрғызу және талдау әдістемесі
- •Үш компонентті жүйелердің термодинамикасы.
- •Үш компонентті жүйелердің құрамын талдау әдістемесі.
- •Кеңістік диаграмманы тұрғызу және талдау.
- •Жазықтық диаграмманы тұрғызу және талдау.
- •Диаграммалардағы сипаттамалық нүктелердің толық талдау:
- •Әдебиеттер тізімі
- •Геометриялық термодинамика
- •Термодинамикалық потенциалдардың концентрациялық тәуелділігі
- •Жүйедегі фазалар тепе-теңдігіне қысымның әсері.
- •Екі тұздардың ерітіндісіндегі фазалық тепе-теңдік
- •Фазалық күй диаграммасын талдау мен термодинамикалық есептеу мәселесінің қазіргі күйі
- •Фазалық тепе-теңдік диаграммаларын термодинамикалық есептеу және талдау мәселелерінің заманауи күйі
- •Әдебиеттер тізімі
Бст теориясының негізгі түсініктері
1. Химиялық әрекеттесуіге ретсіздік жылулық қозғалысы барысында өзара соқтығысатын жүйенің бөлшектері түседі. Соқтығысулардың жалпы саны. К0-ге тең.
![]() (4)
(4)
2. Алайда барлық соқтығысулар химиялық әрекеттесулермен аяқталмайды.Химиялық әрекеттесуге белсенді бөлшектердің соқтығысулары әкеледі.Олардың саны:
![]() (5)
(5)
Қорытынды:
осылайша (3) теңдік келесі түрге ие
болады:
![]() (6).
(6).
3. Бұл теңдеу бірінші реті реакцияланудың жылдамдықтарын жақсы сипаттайды. 2-ші ретті реакциялар үшін көптеген тәжірбиелік мәліметтерді Аррениус стериялық фактор ρ деп аталатын түзету коэффициентін енгізген. 2 және 3 ретті реакциялардың көптеген экспериментальді мәндері үшін Аррениус (6) теңдікке түзету коэффициентін енгізді ρ:
ρ=1÷10-8
Стериялық фактор химиялық әрекеттесудің актісіне әкелетін белсенді соқтығысулардың үлесін ескереді. Аррениус бойынша химиялық әрекеттесудің актысына бөлшектер өздерінің ыңғайлы геометриялық беттерімен жанасатын белсенді соқтығысулар әкеледі.
![]() (7)
(7)
Бст теориясының артықшылықтары мен кемшіліктері.
Теорияның артықшылықтары:
1.
Соқтығысулар ![]() және белсендіру энергиясы
және белсендіру энергиясы ![]() түсініктері енгізіледі.
түсініктері енгізіледі.
2.
Аррениустың эпирикалық
теңдеуінен ![]() теңдеуі табылады.
теңдеуі табылады.
3.
![]() графигінен
графигінен
![]() немесе
немесе
![]() оңай
анықтауға болады.
оңай
анықтауға болады.
4. Тәжірбиелік мәліметтер бойынша стероилық фактордың мәнін анықтауға болады.
Теорияның кемшіліктері:
1.
![]() ,
,
![]() ,
,
![]() .
есептеу үшін қатаң математикалық
қорытынды берілмейді.
.
есептеу үшін қатаң математикалық
қорытынды берілмейді.
2.
![]() және
-дің
физикалық мағыналарын сипаттамайды.
және
-дің
физикалық мағыналарын сипаттамайды.
3. Еріткіштің әсерін, яғни реакция ортасын түсіндірмейді.
Белсенді комплекс теориясының негізгі түсініктері (бкт).
ХХ ғ құрылыс саласында ғылым жетістіктері химилық үдерістер механизмін толық түсіндіретін және белсенді компоненттер теориясы (БКТ) деп аталатын теорияны енгізуге мүмкіндік берді.
Химиялық үдерісті БКТ- на сәйкес қарастырамыз:
А2+В2
 2АВ
2АВ
![]() БКТ-
на сәйкес бастап бастапқы реагенттердің
ақырғы өнімге өту үдерісі аралық
өнімдердің тұрақсыз аралық күйге өтуіне
дейін жүреді, онда реакцияны келесідей
жазуға болады:
БКТ-
на сәйкес бастап бастапқы реагенттердің
ақырғы өнімге өту үдерісі аралық
өнімдердің тұрақсыз аралық күйге өтуіне
дейін жүреді, онда реакцияны келесідей
жазуға болады:


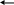
Белсенді комплекс теориясының ерекшеліктері.
Химиялық реакция схемасын талдауынан кейін:
Химялық әрекеттесу үдерісі кезінде реагенттер молекулалары аралық белсенді комплекс түзеді (АБК).
АБК- тұрақсыз өйткені ескі химиялық байланыстар әлсіреген, ал жаңа байланыстар белгіленген.
АБК-ның түзілуі кезінде бастапқы рагенттердің диссоциясы жүрмейді, яғни бұрынғы химиялық байланыстар үзілмейді, олар тек әлсірейді, сондықтан әлсіреу энергиясы диссоциация энергиясынан аз

АБК түзілген кезде реагент молекулаларының арасындағы ескі байланыстар әлсіреп және мүмкін жаңа байланыстар пайда болады.
БКТ теориясы реакция жылдамдығы тұрақтысының температураға тәуелділігін реакция жылдамдығының кинетикалық теңдігі негізінде қатаң математикалық қорытындылайды.
![]() (1)
(1)
Осы теңдеуді АБК-ның концентрациясы арқылы жазамыз:
![]() (2),
(2),
Мұндағы ϰ – трансмиссияның коэффицент. Ол реагенттердің бастапқы күйден ААК күйге өту мүмкіндігін көрсетедің
![]() -
аралық белсенді комплекстің соңғы
өнімді алу бағыты бойынша қозғалысының
орташа жылдамдығы.
-
аралық белсенді комплекстің соңғы
өнімді алу бағыты бойынша қозғалысының
орташа жылдамдығы.
![]() -
аралық белсенді комплекстің концентрациясы
-
аралық белсенді комплекстің концентрациясы
(1) және (2) теңдеулерді бір-біріне теңестіріп, жылдамдық кинетикасын анықтаймыз.
![]() (3)
(3)
![]() (4)
(4)
![]() (5)
(5)
![]() (6)
(6)
мұндағы
![]() - Планк тұрақтысы.
- Планк тұрақтысы.
![]() (7)
(7)
![]() (8)
(8)
х –газ тәрізді реагенттердің сандық молінің өзгеруін анықтайды.
![]() (9)
(9)
![]() (10)
(10)
мұндағы
![]() -
белснді комплекстің энтропиясы
-
белснді комплекстің энтропиясы
![]() -
теңдеумен есептелетін белсенді
комплекстің түзілуі энтольпиясы.
-
теңдеумен есептелетін белсенді
комплекстің түзілуі энтольпиясы.
![]() (11)
(11)
Көп
жағдайда х 0 ÷ 1 өзгереді, сондықтан ![]() (12)
(12)
(4) теңдеуге (7), (10) және (12) теңдеуін қоямыз:
![]() (13)
(13)
![]() (14)
(14) ![]() (15)
(15)
(13)теңдеу
мындай түрге өзгереді: ![]() .
.
Стериялық фактор деп белсендіру энтропиясымен байланысты және сол себепті АБК-ң ақырғы өнімге өту мүмкіндігін көрсететін шаманы айтады.
Экспоненциал алдындағы фактор деп реагенттердің химиялық байланыстарының қайтадан құрылатын құрылысымен және реагенттердің энергетикасымен, АБК-пен байланысты шаманы айтады.
Химиялық үдерістің өтуінің кинетикасының механизмін таулы жерде жолшының қозғалысының сызбасымен салыстырып көрсетуге болады.

Реагенттердің бөлшектері химиялық әсерлесу кезінде бастапқы күйден соңғы күйге өткенде ең аз энергетикалық бөгеті бар аралық күйде оптималды энергетикалық жол таңдалады.
Бақылау сұрақтары:
1. Физикалық ұғымдар: химиялық әрекеттесуді белсендіру; Гиббс энергиясы; тепе-теңдік тұрақтысы; белсендіру энтропиясы; экспоненциал алдындағы фактор.
2. Аррениустың белсенді соқтығысулар теориясын (БСТ) талдау: БСТ теориясының негізгі тұжырымдамалары; БСТ теориясы бойынша үрдістің механизмі; БСТ теориясы бойынша жылдамдық тұрақтысы теңдеуін шығару; БСТ теориясының артықшылығы мен кемшіліктері.
3. Белсенді кешендер теориясын (БКТ) талдау: БКТ теориясының негізгі тұжырымдамалары; БКТ теориясы бойынша үрдістер механизмі; БКТ теориясы бойынша жылдамдық тұрақтысының теңдеуін шығару; БКТ теориясының артықшылықтары мен кемшіліктері.
Глоссарий:
Стериялық фактор – белсендіру энтропиясымен байланысты және сол себепті АБК-ң ақырғы өнімге өту мүмкіндігін көрсететін шаманы айтады.
Экспоненциал алдындағы фактор – реагенттердің химиялық байланыстарының қайтадан құрылатын құрылысымен және реагенттердің энергетикасымен, АБК-пен байланысты шама.
Блиц-тест:
1. Белсендіру энтропиясы қалай есептеледі?
a)
![]()
![]() P
P
b)
P![]()
c)
P
![]()
d)
![]() P
P
e) - P
2. БКТ теориясы стериялық факторды қалай анықтайды?
a)
P=![]()
b)
P=![]()
c)
P=![]()
d)
P=![]()
e)
P=![]()
3. БКТ теориясы бойынша экспоненциал алдындағы көбейткіштің негізгі теңдеуін көрсетіңдер?
a)
![]()
b)
![]()
c)
![]()
d)
![]()
e)
![]()
4. БСТ және БКТ теориялары бойынша реакцияның жылдамдық константасы қалай анықталады?
a)
К=P![]()
b)
![]()
c)
К= P
![]()
d)
К= P P![]()
e) К=
5.
Кейбір реакцияның температуралық
коэффициенті
![]() тең. Температураны 200
жоғарлатқанда реакцияның
жылдамдығы қалай өзгереді?
тең. Температураны 200
жоғарлатқанда реакцияның
жылдамдығы қалай өзгереді?
a) 4 есе артады
b) 4 есе азаяды
c) 1,4 есе артады
d) 1,4 есе азаяды
e) өзгермейді
6. Бірінші ретті реакцияның жылдамдық константасының теңдеуін көрсетіңдер
a)
b)
c)
d)
e)
7. I – ші ретті реакциялары үшін жартылай ыдырау уақытының теңдеуін көрсетіңдер
a)
b)
c)
d)
e)
8. Келтірілген теңдеулердің арасында Аррениус теңдеуін табыңдар
a)
b)
c)
d)
e)
9. Төмен температуралық облыстарда қандай заңдылық температураның жылдамдыққа әсерін анықтайды?
a)
b)
c)
d)
e)
10. Белсендіру энергиясы аналитикалық түрде қалай есептеледі?
a)
b)
c)
d)
e)
