
- •Оглавление
- •Введение
- •Краткие указания к практическим занятиям Правила работы в лаборатории органической химии
- •Первая помощь при несчастных случаях в лаборатории
- •I. Методы выделения и очистки органических веществ
- •Опыт № 1. Перекристаллизация бензойной кислоты
- •Опыт №2. Возгонка (сублимация) бензойной кислоты
- •Опыт №4. Определение температуры плавления бензойной кислоты
- •Опыт №5. Разделение смеси веществ простой перегонкой
- •II. Качественный элементный анализ органических соединений
- •Опыт № 8. Обнаружение углерода и водорода
- •Опыт № 9. Обнаружение азота
- •Опыт № 10. Обнаружение галогенов (проба Бейльштейна)
- •Опыт № 11. Обнаружение серы
- •Опыт № 13. Получение и свойства этилена
- •Опыт №14. Получение и свойства бензола
- •IV. Галогенопроизводные углеводородов (галогеноуглеводороды)
- •Опыт № 15. Получение хлорэтана
- •V. Спирты. Простые эфиры
- •Опыт № 16. Обнаружение воды в спирте-ректификате
- •Опыт № 18. Окисление этилового спирта перманганатом калия
- •Опыт № 19. Получение простого (диэтилового) эфира
- •Опыт № 20. Получение сложного (уксусноэтилового) эфира
- •VI. Фенолы. Нафтолы
- •Опыт № 21. Получение фенолята натрия
- •Опыт № 24. Взаимодействие α- и β-нафтолов с хлоридом железа (III)
- •VII. Альдегиды и кетоны
- •Опыт № 25. Получение уксусного альдегида из этанола
- •Опыт № 26. Окисление альдегида. Образование серебряного зеркала
- •Опыт № 27. Реакция диспропорционирования формальдегида (реакция Канницаро)
- •Опыт № 28. Окисление формальдегида гидроксидом меди (II) в щелочной среде
- •Опыт № 29. Цветные реакции на альдегиды
- •Опыт № 30. Образование альдегидами и кетонами гидросульфитных производных
- •Опыт № 31. Йодоформная проба на ацетон
- •Опыт № 32. Окисление бензойного альдегида кислородом воздуха
- •VIII. Карбоновые кислоты и их производные
- •Опыт № 33. Получение уксусной кислоты из ацетата натрия
- •Опыт № 34. Получение и гидролиз ацетата железа (III)
- •Опыт № 35. Устойчивость уксусной кислоты к действию окислителей
- •Опыт № 36. Окисление муравьиной кислоты
- •Опыт № 37. Разложение муравьиной кислоты
- •Опыт № 38. Окисление олеиновой кислоты перманганатом калия (реакция Вагнера)
- •Опыт № 39. Разложение щавелевой кислоты при нагревании
- •Опыт № 40. Окисление щавелевой кислоты
- •IX. Гидроксикислоты
- •Опыт № 42. Разложение молочной кислоты при нагревании с концентрированной серной кислотой
- •Опыт № 43. Разложение молочной кислоты при нагревании с разбавленной серной кислотой
- •Опыт № 44. Окисление молочной кислоты в пировиноградную кислоту
- •Опыт № 45. Получение реактива Фелинга
- •Опыт № 46. Разложение лимонной кислоты при нагревании
- •Опыт № 47. Получение ацетилсалициловой кислоты (аспирин)
- •Опыт № 48. Доказательство отсутствия фенольного гидроксила в ацетилсалициловой кислоте (аспирине) и её гидролиз
- •Опыт № 49. Термическое декарбоксилирование салициловой кислоты
- •Опыт № 50. Взаимодействие салициловой и бензойной кислот с хлоридом железа (III)
- •Опыт № 52. Доказательство наличия гидроксильных групп в винной кислоте
- •Опыт № 53. Взаимодействие галловой кислоты и танина с хлоридом железа (III)
- •Опыт № 54. Обнаружение кислотных свойств ацетоуксусного эфира
- •Опыт № 55. Кетонное расщепление ацетоуксусного эфира
- •X. Углеводы
- •Опыт № 56. Реакция на обнаружение углеводов с -нафтолом (реакция Молиша)
- •Опыт № 57. Доказательство наличия гидроксильных групп в глюкозе
- •Опыт № 58. Восстановление гидроксида меди (II) глюкозой в присутствии щелочи (реакция Троммера)
- •Глюкоза глюконовая кислота
- •Опыт № 59. Взаимодействие глюкозы с реактивом Фелинга
- •Опыт № 60. Восстановление аммиачного раствора оксида серебра (реакция серебряного зеркала)
- •Опыт № 61. Реакция Селиванова на кетогексозы
- •Опыт № 62. Взаимодействие глюкозы со щелочным раствором глицерата меди (реактив Гайнеса)
- •Опыт № 63. Реакция фуксинсернистой кислоты с глюкозой и формальдегидом
- •Опыт № 64. Образование фурфурола и конденсация его с анилином (качественная реакция на пентозаны)
- •Опыт № 65. Доказательство наличия гидроксильных групп у сахарозы
- •Опыт № 66. Восстанавливающая способность дисахаридов
- •Опыт № 67. Инверсия сахарозы при гидролизе
- •Опыт № 68. Приготовление крахмального клейстера
- •Опыт № 69. Реакция крахмала с йодом
- •Опыт № 70. Отсутствие восстанавливающей способности у крахмала
- •XI. Азотсодержащие органические соединения
- •Нитросоединения
- •Опыт № 71. Получение нитрометана
- •Опыт № 72. Разложение мочевины при гидролизе
- •Опыт № 73. Взаимодействие мочевины с азотной кислотой
- •Опыт № 74. Взаимодействие мочевины с азотистой кислотой
- •Опыт № 75. Взаимодействие мочевины со щавелевой кислотой
- •Опыт № 76. Образование биурета
- •Опыт № 77. Определение кислотности аминоэтановой кислоты (глицина)
- •Опыт № 78. Получение медной соли глицина
- •Опыт № 79. Реакции аминокислот с нингидрином
- •Опыт № 80. Реакции аминокислот с формальдегидом
- •Опыт № 81. Реакции аминокислот с азотистой кислотой (дезаминирование)
- •Опыт № 82. Реакция глицина с хлоридом железа (III)
- •Заказ №
Опыт № 39. Разложение щавелевой кислоты при нагревании
Реактивы:
Щавелевая кислота
Известковая вода
Ход работы:
В пробирку с газоотводной трубкой вносят 2 г (0,022 моль) щавелевой кислоты и осторожно нагревают, опустив конец газоотводной трубки в пробирку с известковой водой. При нагревании выделяется оксид углерода (IV) и оксид углерода (II). Оксид углерода (IV) с известковой водой образует осадок карбоната кальция СaCO3. Оксид углерода (II) можно зажечь у отверстия газоотводной трубки, он горит голубым пламенем.
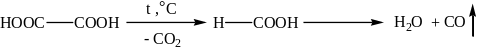
Опыт № 40. Окисление щавелевой кислоты
Реактивы:
Насыщенный раствор щавелевой кислоты
10% раствор серной кислоты
1% раствор перманганата калия
Известковая вода
Ход работы:
В пробирку наливают 4 мл 1% раствора перманганата калия (2,54∙10-4 моль), подкисляют 10% раствором серной кислотой (3-4 капли) и приливают 2 мл (0,016 моль) насыщенного раствора щавелевой кислоты. Пробирку закрывают пробкой со вставленной в нее изогнутой газоотводной трубкой. Закрепляют пробирку держателем, а свободный конец газоотводной трубки погружают в пробирку с известковой водой. Пробирку со смесью осторожно нагревают, щавелевая кислота при этом окисляется до оксида углерода (IV) и воды. Выделяющийся СО2, реагируя с известковой водой, образует осадок углекислого кальция.
5HOOC-COOH + 2KMnO4 + 3H2SO4 2MnSO4 + K2SO4 +8H2O +10CO2
CO2 + Ca(OH)2 H2O + CaCO3
IX. Гидроксикислоты
Гидроксикислоты (оксикислоты) – бифункциональные производные углеводородов, в молекулах которых содержатся одновременно карбоксильная –СООН и гидроксильная -ОН группы. Число карбоксильных групп определяет основность гидроксикислот; число гидроксильных групп, включая и гидроксил карбоксильной группы, определяет атомность гидроксикислот.
Для большого числа оксикислот распространены тривиальные названия; по рациональной номенклатуре в основе наименования лежит название соответствующей кислоты, положение гидроксигруппы указывается буквами греческого алфавита. По систематической номенклатуре названия строят, прибавляя приставку окси (диокси, триокси и т.д.) к систематическому названию кислоты:
НО-СН2-СООН оксиэтановая (гликолевая) кислота
СН3-СН (ОН)-СООН 2-оксипропановая (молочная) кислота
НО-СН2- СН (ОН)-СООН 2,3-диоксипропановая (глицериновая) кислота
НООС- СН2- СН (ОН)-СООН оксибутандиовая (яблочная) кислота
НООС- СН (ОН)- СН (ОН)-СООН 2,3 - диоксибутандиовая (винная) кислота
 2-оксибензойная
(салициловая) кислота
2-оксибензойная
(салициловая) кислота
 3,4,5-
триоксибензойная (галловая) кислота
3,4,5-
триоксибензойная (галловая) кислота
Гидроксикислоты - химически активные вещества. Наличие в составе их молекул двух видов функциональных групп (-СООН и -ОН) позволяет им легко вступать в различные химические реакции, характерные для карбоновых кислот и спиртов, а также подвергаться ряду специфических превращений, характерных только для этого класса химических соединений.
Опыт № 41. Обнаружение молочной кислоты
Реактивы:
1% раствор фенола
1% раствор хлорида железа
Молочная кислота
Ход работы:
К 3 мл 1%-ного раствора фенола (3,2∙10-4 моль) прибавляют 1-2 капли 1%-ного раствора хлорида железа (III). Жидкость окрашивается в ярко-фиолетовый цвет вследствие образования комплексных фенолятов трехвалентного железа. К полученной жидкости добавляют 2-3 капли молочной кислоты и наблюдают изменение цвета раствора в зелено-желтый благодаря образованию лактата железа:
3СН3-СН (ОН)-СООН + FeCl3 (CH3CH(OH)COO)3Fe + 3 HCl
