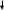- •Условия для получения суспензии клеток
- •Режимы воздействия мутагенов на l.Lactis
- •Условия для выделения колоний
- •Условия получения суспензии клеток
- •Условия для получения мутантов
- •Воздействие различных мутагенных факторов на молочнокислые бактерии
- •Повышение устойчивости молочнокислых бактерий к антибиотикам и к сушке
СЕЛЕКЦИЯ МОЛОЧНОКИСЛЫХ БАКТЕРИЙ ВОЗДЕЙСТВИЕМ
МУТАГЕННЫХ ФАКТОРОВ И АДАПТАЦИЕЙ
Молочнокислые бактерии, обладающие производственно-ценными свойствами, например, высокой активностью свертывания молока, способностью образовывать диацетил, в природных источниках встречаются редко. Интенсифицировать сквашивание молока и улучшить качество кисломолочных продуктов можно при использовании молочнокислых бактерий с повышенной биохимической активностью. Получение таких штаммов осуществляется воздействием сильно действующих мутагенных факторов.
Популяция культуры состоит из большого числа клеток, различающихся по биохимической активности. Реакция клеток в ответ на воздействие внешних факторов неодинакова: одни клетки погибают, другие изменяют свои морфологические, биохимические и физиологические свойства. Эти особенности микроорганизмов обусловливают их изменчивость и позволяют получить разнокачественные особи с необходимыми свойствами. Воздействие мутагенных факторов состоит из двух основных этапов - воздействия на клетки микроорганизмов сильно действующего мутагенного фактора и последующего отбора высокоактивных вариантов. Этот метод селекции является высокоэффективным и доступным для практического использования при селекции промышленных штаммов.
Наследственные изменения (мутации) свойств микроорганизмов могут происходить под влиянием химических и физических факторов (ионизирующее излучение и ультрафиолетовые лучи). При радиационной селекции используют преимущественно гаммалучи и быстрые нейтроны, которые дают лучший мутагенный эффект. Однако их использование для получения промышленных штаммов ограничено. Ультрафиолетовые лучи с длиной волны 2650 нм обладают также хорошим мутагенным действием, так как лучи этой длины волны избирательно поглощаются молекулами ДНК. Ультрафиолетовые лучи вызывают возбуждение молекулы, что в последующем приводит к их химическому изменению.
Химические мутагены более эффективны по количеству мутаций, чем физические, и часто обладают более тонким и специфическим действием на клетку бактерии. Химические мутагены дают значительно больше полезных мутаций, чем физические, являясь в то же время менее летальными. В качестве химических мутагенов используют нитрозосоединения, формальдегид, уретан, этиленимин, окись этилена, диэтилсульфит, саркализин и др.
Применяют также сочетание физических и химических факторов.
Для получения мутантов различных видов молочнокислых бактерий используют нитрозосоединения, этиленимин, ультрафиолетовые лучи, гамма-лучи, рентгеновские лучи, быстрые нейтроны.
Селекция молочнокислых бактерий воздействием мутагенных факторов показана на схемах 1-3.
Для получения мутантов среди культур отбирают штаммы, популяция которых характеризуется средней изменчивостью, коэффициентом вариации от 10 до 20 %.
Схема 1. Селекция культур L.lactis воздействием мутагенных факторов
|
Выращивание культуры на плотной или жидкой питательной среде |
|
|||
|
|
|
|||
Отделение и очистка клеток от среды |
|||||
|
|
|
|||
Воздействие на суспензию клеток этиленимином |
Воздействие на суспензию клеток НЭМ* |
||||
|
|
||||
Облучение суспензии клеток УФ-лучами |
Высев суспензии клеток на плотную питательную среду |
||||
|
|
||||
Высев суспензии клеток на плотную питательную среду |
Термостатирование чашек с посевами |
||||
|
|
||||
Термостатирование чашек с посевами |
Выделение колоний и отбор мутантов |
||||
|
|
||||
Выделение колоний и отбор мутантов |
|||||
*−N-нитрозоэтилмочевина
Схема 2. Селекция культур L.cremoris воздействием мутагенных факторов
Выращивание культуры на плотной или жидкой питательной среде |
|
|
Отделение и очистка клеток от среды
|
|
Воздействие на суспензию клеток НЭМ
|
|
Облучение суспензии клеток УФ-лучами
|
|
Высев суспензии клеток на плотную питательную среду
|
|
Термостатирование чашек с посевами
|
|
Выделение колоний и отбор мутантов
|
|
|
Схема 3. Селекция культур L.lactis subsp. acetoinicus воздействием мутагенных факторов
Выращивание культуры на плотной или жидкой питательной среде |
|
|
Отделение и очистка клеток от среды
|
|
Воздействие на суспензию клеток N-нитрозометилмочевины или N-нитрозобиуретмочевины
|
|
Облучение суспензии клеток УФ-лучами
|
|
Высев суспензии клеток на плотную питательную среду
|
|
Термостатирование чашек с посевами
|
|
Выделение колоний и отбор мутантов
|
|
|
Для наращивания клеток используют гидролизованное молоко с добавлением 2,5 % дрожжевого автолизата или плотную питательную среду (2 % агара), приготовленную из гидролизованного молока (с 2,5 % дрожжевого автолизата), среды после стерилизации должны иметь рН 6,8-7,0 и быть прозрачными.
Комбинированное воздействие этиленимина и ультрафиолетовых лучей на штаммы L.lactis. Отобранные штаммы L.lactis (17-18 часовые, выращенные на стерильном обезжиренном молоке) засевают в гидролизованное молоко с дрожжевым автолизатом, термостатируют при оптимальной температуре роста в течение 17-18 ч. Полученную культуру наносят на скошенную плотную питательную среду, посевы термостатируют при оптимальной температуре. После этого клетки смывают с поверхности среды стерильным физиологическим раствором. Суспензию клеток помещают в стерильные центрифужные стаканчики (пробирки), которые закрывают полиэтиленовой пленкой, закрепляя ее резинкой. Стаканчики (пробирки) центрифугируют, сливают надосадочную жидкость, встряхивают осадок, добавляют стерильную дистиллированную воду и вновь центрифугируют. Такую операцию повторяют 2 раза. В результате получают клетки, отмытые от остатков среды. Из отмытых клеток в стерильной дистиллированной воде готовят суспензию клеток, содержащую от 500 до 1000 тыс. клеток в 1 мл по стандарту мутности. Предварительно проверяют совпадаемость содержания клеток по стандарту мутности с данными, полученными при посеве на плотную питательную среду.
Среды, режимы термостатирования и центрифугирования при получении суспензии клеток приведены в табл.1.
Таблица 1
Условия для получения суспензии клеток
Операция |
Среда |
Термостатирование |
Центрифугирование |
||
Температура,ºС |
Продоолжительность,ч |
Частота вращения центрифуги, с-1 |
Продолжительность, мин |
||
Получение культуры |
Гидролизованное молоко с 2,5 % дрожжевого автолизата |
25 или 30 |
17-18 |
- |
- |
Наращивание клеток на плотной питательной среде |
Агар с гидролизованным молоком или 2,5 % дрожжевого автолизата |
25 или 30 |
17-18 |
- |
- |
Очистка клеток |
Дистиллированная вода |
- |
- |
313-523 |
10-15 |
При комбинированном воздействии этиленимина и ультрафиолетовых лучей вначале суспензию клеток подвергают действию этиленимина, а затем ультрафиолетовых лучей. Раствор этиленимина готовят на дистиллированной воде перед использованием. Для этого содержимое ампулы (0,1 мл) переносят в стерильную мерную колбу на 200 мл, добавляя дистиллированную воду до метки. Этот раствор имеет концентрацию 1:2000. Затем в стерильную пробирку отбирают 0,65 мл раствора этиленимина, 1,35 мл стерильной дистиллированной воды и 8 мл суспензии клеток. Получают концентрацию этиленимина в смеси 0,033 %. Смесь помещают в термостат, где выдерживают определенное время (табл.2).
Таблица 2
Режимы воздействия мутагенов на l.Lactis
Операция |
Концентрация мутагена, % |
Термостатирование |
Центрифугирование |
Продолжительность облучения УФ-лучами, с |
||||
Температура, ºС |
Продолжительность, мин |
Частота вращения центрифуги, с-1 |
Продолжительность, мин |
|||||
Воздействие этиленимина на суспензию клеток |
0,033 |
30 |
60 |
- |
- |
- |
||
Облучение суспензии клеток |
- |
- |
- |
- |
- |
15-45 |
||
Реактивация |
- |
18-22* |
60 |
- |
- |
- |
||
Воздействие N-нитрозоэтилмочевины |
1 |
25 или 30 |
30-60 |
- |
- |
- |
||
Снятие остаточного действия |
- |
- |
- |
313 |
10-15 |
- |
||
Подращивание клеток |
- |
25 или 30 |
180 |
- |
- |
- |
||
*Возможна выдержка при комнатной температуре на качалке.
Для снятия остаточного действия этиленимина смесь центрифугируют. Надосадочную жидкость сливают, клетки встряхивают и добавляют дистиллированную воду (10 мл). После перемешивания смесь помещают в чашки Петри (по 5 мл), которые устанавливают в бокс, где их открывают и облучают ультрафиолетовыми лучами (лампой БУВ-15 на расстоянии 30 см в течение 15-45 с). При облучении содержимое чашки перемешивают равномерным вращательным движением. Чашки с облученной суспензией закрывают светонепроницаемой бумагой и оставляют на 1 ч при комнатной температуре.
ют
при оптимальной температуре роста в
течение 17—18
ч.
Получен* ную культуру наносят на
скошенную плотную питательную среду,
посевы термостатируют при оптимальной
температуре. После этого клетки смывают
с поверхности среды стерильным
физиологическим раствором. Суспензию
клеток помещают в стерильные центрифужные
стаканчики (пробирки), которые закрывают
полиэтиленовой пленкой, закрепляя ее
резинкой. Стаканчики (пробирки)
центрифугируют, сливают надосадочную
жидкость, встряхивают осадок, добавляют
стерильную дистиллированную воду
и вновь центрифугируют. Такую операцию
повторяют 2 раза. В результате получают
клетки, отмытые от остатков среды. Из
отмытых клеток в стерильной
дистиллированной воде готовят
суспензию клеток, содержащую от 500 до
1000
тыс.
клеток в 1 мл по стандарту мутности.
Предварительно проверяют совпадаемость
содержания клеток по стандарту мутности
с данными, полученными при посеве на
плотную питательную среду.
11ри
комбинированном воздействии этиленимина
и ультрафиоле- гоиых лучей вначале
суспензию клеток подвергают действию
этилен- нмина, а затем ультрафиолетовых
лучей. Раствор этиленимина гото- иill
на дистиллированной воде перед
использованием. Для этого ( одержимое
ампулы (0,1
мл) переносят в стерильную мерную колбу
мн 200 мл, добавляя дистиллированную
воду до метки. Этот рас- 1ми|>
имеет концентрацию 1:2000.
Затем в стерильную пробирку н|Пи|шют
0,65
мл раствора этиленимина, 1,35
мл стерильной дистнл- Лн|||жпн110й
воды и 8 мл суспензии клеток. Получают
концентрацию *I н 'ii'iiitMiiiia
в смеси 0,033%.
Смесь помещают в термостат, где вы- н
|. I
11
п л ют определенное время (табл. 63).
Дли
снятия остаточного действия этиленимина
смесь центрифу-
От каждого штамма выделяют не менее 50-100 колоний (вариантов) в стерильное обезжиренное молоко, термостатируют при оптимальной температуре роста и отбирают вариант, свертывающие молоко не более чем за 24 ч, остальные отбраковывают. Отобранные варианты перевивают петлей в стерильное обезжиренное молоко 5-7 раз через 20-30 дней. При этом отбирают все варианты, свертывающие молоко не более 17 ч. Режим выделения и отбор вариантов после воздействия мутагенов приведены в табл. 3.
Таблица 3