
- •Лекция №1
- •Механика және оның құрылымы. Механикадағы моделдер.
- •Бақылау сұрақтары.
- •Лектор Физика 1 курсы бойынша Лекция №2
- •Бақылау сұрақтары.
- •Дененің ілгерілемелі қозғалысы үшін және қозғалмайтын ось бойымен оның айналуы үшін негізгі шамалармен қатынастарды салыстырамыз.
- •Бақылау сұрақтары.
- •Бақылау сұрақтары.
- •Статистикалық физика және термодинамика. Молекула-кинетикалық теорияның негіздері. Идеал газ молекулаларының орташа кинетикалық энергиясы.
- •Идеал газ молекуласының орташа квадраттық жылдамдығы:
- •Бақылау сұрақтары.
- •Газ заңдары. Идеал газ күйінің теңдеуі. Максвелл үлестірілуі. Сыртқы потенциялық өрістегі бөлшектер үшін Больцман үлестірілуі. Идеал газдың ішкі энергиясы.
- •Бойль – Мариот заңы.
- •Авогадро заңы.
- •Дальтон заңы.
- •Идеал газ күйінің теңдеуі.
- •Максвелл заңы.
- •Идеал газ молекуласының ең ықтимал жылдамдығы.
- •Газ молекуласының орташа жылдамдығы (орташа арифметикалық жылдамдық).
- •Газ күйін сипаттайтын жылдамдықтар.
- •Барометрлік формула.
- •Больцман таралуы.
- •Бақылау сұрақтары.
- •Еркіндік дәреженің саны.
- •Энергияның еркіндік дәрежесі бойынша бірқалыпты таралуы туралы
- •Бақылау сұрақтары.
- •Термодинамика негіздері. Термодинамиканың бірінші бастамасы. Изопроцесстер. Қайтымды және қайтымсыз жылулық процестер.
- •Газдың ұлғаю кезіндегі жұмысы.
- •Тұрақты көлемдегі молярлық жылу сыйымдылық
- •Газдың изотермиялық ұлғаюы кезіндегі жұмысы
- •Энтропияның статистикалық тұрғыдан түсіндірілуі.
- •Бақылау сұрақтары.
- •Молекула-кинетикалық теорияны тұжырымдайтын эксперименттер.
- •Жылу өткізгіштік, ішкі үйкеліс (тұтқырлық), диффузия. Тасымалдау құбылыстарының молекула-кинетикалық теориясы. Тасымалдау коэффициенттері. Тасымалдау құбылысы.
- •Жылу өткізгіштік.
- •Диффузия.
- •Ішкі үйкеліс (тұтқырлық).
- •Бақылау сұрақтары.
- •Реал газдар. Молекулалардың эффективті диаметрі. Молекула аралық өзара әсер күштері. Ван-дер-Ваальс тендеуі. Ван-дер-Ваальс изотермалары.
- •Бақылау сұрақтары.
- •Бірінші және екінші текті ауысулар. Фазалық тепе-теңдіктер және фазалық ауысулар. Клапейрон-Клаузиус теңдеуі. Кризистік нүкте. Үштік нүкте.
- •Бақылау сұрақтары.
- •Электростатика. Электр зарядының өзара әсерлесуі. Электр зарядының сақталу заңы. Электр өрісі. Электр өрісінің кернеулілігі. Суперпозиция принципі. Электрлік диполь. Электростатика
- •Кулон заңы.
- •Электр өрісінің кернеулігі.
- •Бақылау сұрақтары.
- •Векторының ағыны.
- •Электростатикалық өрістің суперпозиция принципі.
- •Бақылау сұрақтары.
- •Электростатикалық өрістің жұмысы. Электростатикалық өрістің циркуляциясы. Потенциал. Потенциалдың электростатикалық өріс кернеулілігімен байланысы.
- •Векторының циркуляциясы туралы теорема.
- •8.Зарядтың потенциалдық энергиясы.
- •11. Кернеулік пен потенциал арасындағы байланыс.
- •Бақылау сұрақтары.
- •Электростатикалық өрістердегі диэлектриктер. Поляризациялау зарядтары. Поляризациялану. Диэлектрик-тердің түрлері. Заттардың диэлектрлік өтімділігі. Электрлік ығысу.
- •Электр зарядтарының өзара әсерлесу энергиясы. Зарядталған конденсаторлардың және өткізгіштер жүйесінің энергиясы. Электростатикалық өріс энергиясы. Электрлік өріс энергиясының көлемдік тығыздығы.
- •Бақылау сұрақтары.
- •Электр қозғаушы күш және кернеу.
- •Бақылау сұрақтары.
- •Ом және Джоуль-Ленц заңдарының дифференциалды түрі. Сыртқы күштер. Гальваникалық элементтің э.Қ.К.-і.
- •N өткізгіштерді параллель жалғау:
- •Бақылау сұрақтары.
- •Газдар мен плазмадағы электр тогы.
- •Бақылау сұрақтары.
- •Бектібаев ш.Б., Рахимов қ., т.Б. Жалпы физика курсы.(Механика және молекулалық физика бөлімі): Оқу құралы. Қарағанды: КарМту. 1998
Тұрақты көлемдегі молярлық жылу сыйымдылық
Термодинамиканың
бірінші бастамасынан
,
және
ескерсек, 1 моль газ үшін
![]() аламыз.
болғанда сыртқы күштің жұмысы
нольге тең, ал газға берілген жылу оның
ішкі энергиясын өсіруге кетеді.
аламыз.
болғанда сыртқы күштің жұмысы
нольге тең, ал газға берілген жылу оның
ішкі энергиясын өсіруге кетеді.
![]()
газдың бір молінің температурасын 1К арттырғандағы ішкі энергияның өзгерісіне тең шама
![]() болғандықтан
болғандықтан
![]()
Тұрақты қысымдағы молярлық жылу сыйымдылық. Майер теңдеуі.
Егер газ болғанда қызыдрылса, онда
![]()
![]() процестің
түріне байланыссыз (ішкі энергия
-ғада
-ға
да байланыссыз, тек
арқылы анықталады) және барлық уақытта
процестің
түріне байланыссыз (ішкі энергия
-ғада
-ға
да байланыссыз, тек
арқылы анықталады) және барлық уақытта
![]() тең. Клапейрон-Менделеев теңдеуін
тең. Клапейрон-Менделеев теңдеуін
![]() бойынша
дифференциалдап
болғанда, аламыз:
бойынша
дифференциалдап
болғанда, аламыз:
![]() -
Майер
теңдеуі.
-
Майер
теңдеуі.
барлық уақытта -дан әмбебап газ тұрақтысына үлкен шама.
Бұл былай түсіндіріледі, қысымының тұрақтылығы газ көлемінің ұлғаюы есебінен қамтамасыз етілетіндіктен, тұрақты қысымда газды қыздырғанда газды ұлғаюту үшін жасалатын жұмысқа қосымша жылу мөлшері керек болады, .
![]() .
.
Термодинамикалық процестерді қарастырғанда, маңызды рольді γ шамасы атқарады
![]()
Бұл Пуассон коэффициенті деп аталады.
Изопроцестер. Термодинамикалық жүйемен өтетін тепе-тең процестерді, күйдің негізгі параметрлерінің біреуі тұрақты сақталатын кездегі процесті қарастырамыз.
Изохоралық процесс ( ).
Б ұл
процестің диаграммасы – изохора
-
координатындағы ординат осіне (p
осіне) параллель түзумен бейнеленеді.
2-1 процесс – изохоралық қызу, 2-3 процесс
– изохоралық суу.
ұл
процестің диаграммасы – изохора
-
координатындағы ординат осіне (p
осіне) параллель түзумен бейнеленеді.
2-1 процесс – изохоралық қызу, 2-3 процесс
– изохоралық суу.
Изохоралық
процесте газ сыртқы денемен жұмыс
жасамайды
![]() және
газға берілген барлық жылу оның ішкі
энергиясын
және
газға берілген барлық жылу оның ішкі
энергиясын
![]() арттыруға жұмсалады.
арттыруға жұмсалады.
![]() болғандықтан газдың кез келген массасы
үшін
болғандықтан газдың кез келген массасы
үшін
![]() .
.
Изобаралық
процесс
![]() .
.
Б ұл
процестің диаграммасы изобара–
ол
координатасындағы абсцисса осіне (
осіне) параллель түзумен бейнеленеді.
Изобаралық процесс кезінде газдың
көлемін
-ден
дейін арттыру үшін жасалатын жұмыс
мынаған тең:
ұл
процестің диаграммасы изобара–
ол
координатасындағы абсцисса осіне (
осіне) параллель түзумен бейнеленеді.
Изобаралық процесс кезінде газдың
көлемін
-ден
дейін арттыру үшін жасалатын жұмыс
мынаған тең:
 .
.
жне
штрихталған тік бұрыштың ауданымен
анықталады. Клапейрон теңдеуін пайдаланып
![]() ,
аламыз
,
аламыз
![]() ,
осыдан
,
осыдан
![]()
Әмбебап
газ тұрақтысының физикалық мағынасы:
![]() идеал
газдың 1 молін 1К қыздыру кезінде
изобаралық ұлғаю жұмысына сан жағынан
тең.
идеал
газдың 1 молін 1К қыздыру кезінде
изобаралық ұлғаю жұмысына сан жағынан
тең.
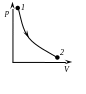 Изотермиялық
процесс
Изотермиялық
процесс
![]() .
.
Бұл процестің диаграммасы – изотерма – ол координатындағы гиперболаны береді.
Изотермиялық
процесс Бойль-Мариот заңымен сипатталады
![]() .
.
Газдың изотермиялық ұлғаюы кезіндегі жұмысы
 .
.
болғанда
идеал газдың ішкі энергиясы өзгермейді,
онда термодинамиканың бірінші бастамасынан
![]() ,
яғни газға берілген барлық жылу сыртқы
күшке қарсы жұмыс істеуге жұмсалады.
,
яғни газға берілген барлық жылу сыртқы
күшке қарсы жұмыс істеуге жұмсалады.
Сондықтан ұлғаю кезінде температура төмендемеу үшін изотермиялық процесс бойында сыртқы ұлғаю жұмысына балама жылу мөлшерін беріп отыру керек.
Адиабаталық
процесс
![]() .
.
Адиабаталық дегеніміз жүйе мен сыртқы орта арасында жылу алмасу болмайтын процесс .
Адиабаталық процеске барлық тез өтетін процестерді (жылу алмасу болуға үлгермейтін) мысалы, жарықтың ортада тарауын, ішкі жану қозғалтқыштарының, суытқыш қондырырғыларының ұлғаю және сығылу циклдерін жатқызуға болады.
Термодинамиканың
бірінші бастамасынан адиабаталық
процесс кезінде
![]() екендігін көруге болады.
екендігін көруге болады.
![]() және
және
![]() пайдаланып
пайдаланып
![]() (1) аламыз. Екінші жағынан
-дан
(1) аламыз. Екінші жағынан
-дан
![]() 2). (2)-ні (1)-ге бөліп, аламыз:
2). (2)-ні (1)-ге бөліп, аламыз:
![]()
немесе
![]() ,
мұндағы
,
мұндағы
![]() -
Пуассон коэффициенті.
-
Пуассон коэффициенті.
Осы
теңдеуді интегралдау
![]() береді, осыдан адиабаталық процесс
теңдеуі
Пуассон теңдеуін-адиабаталық процесс
теңдеуін
аламыз
береді, осыдан адиабаталық процесс
теңдеуі
Пуассон теңдеуін-адиабаталық процесс
теңдеуін
аламыз
![]() .
.
М енделеев
– Клапейрон теңдеуін
пайдаланып, аламыз.
енделеев
– Клапейрон теңдеуін
пайдаланып, аламыз.
![]()
![]() .
.
Адиабаталық процестердің диаграммасы координатында гиперболамен бейнеленеді.
Адиабата
(
),
изотермаға (![]() )
қарағанда тік болады. Бұл 1-3 адиабаталық
сығылу кезінде газдың қысымының артуы
оның көлемінің азаюымен ғана емес,
сонымен бірге температураның артуымен
жүретінімен түсіндіріледі.
)
қарағанда тік болады. Бұл 1-3 адиабаталық
сығылу кезінде газдың қысымының артуы
оның көлемінің азаюымен ғана емес,
сонымен бірге температураның артуымен
жүретінімен түсіндіріледі.
Адиабаталық процесс кезіндегі газдың жұмысы.
Адиабаталық
процесс кезінде
![]() ,
сондықтан
,
сондықтан
![]() .
Егер газ
көлемнен
көлемге адиабаталық ұлғайса, онда оның
температурасы
.
Егер газ
көлемнен
көлемге адиабаталық ұлғайса, онда оның
температурасы
![]() -ден
-ден
![]() -ге
дейін азаяды да идеал газдың ұлғаю
жұмысы
-ге
дейін азаяды да идеал газдың ұлғаю
жұмысы
 .
.
Осыдан Менделеев – Клапейрон теңдеуін пайдаланып,

аламыз.
Адиабаталық ұлғаю жұмысы 1-2 (штрихталған аудан) изотермиялық процесс кезіндегіден аз. Адиабаталық ұлғаю кезінде газдың сууы болады, сонда изотермиялық ұлғаю кезіндегідей температура сырттан балама жылу мөлшері есебінен тұрақты болып ұсталып тұрады.
Политроптық
процесс
![]() .
.
Жылу сыйымдылық тұрақты қалатын процесті политропты процесс деп атайды.
Жоғарыда қарастырылған изохоралық, изотермиялық, изобаралық және адиабаталық процестер, политропты процестің дербес жағдайлары.
Политроптың теңдеуі.
![]() .
.
мұндағы
коэффициент
![]() политропты
көрсеткіші
деп аталады. Жылу сыйымдылықтың мәні
және әртүрлі процестер үшін политроп
көрсеткіші кестеде көрсетілген.
политропты
көрсеткіші
деп аталады. Жылу сыйымдылықтың мәні
және әртүрлі процестер үшін политроп
көрсеткіші кестеде көрсетілген.
-
ПроцессПроцестер

АдиабатАдиабаталық
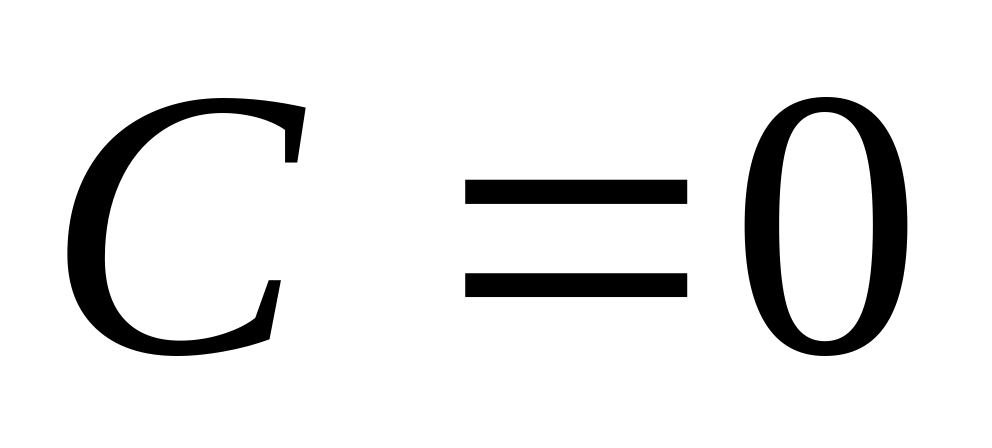

ИзотермИзотермиялық


ИзобараИзобаралық


ИзохораИзохоралық
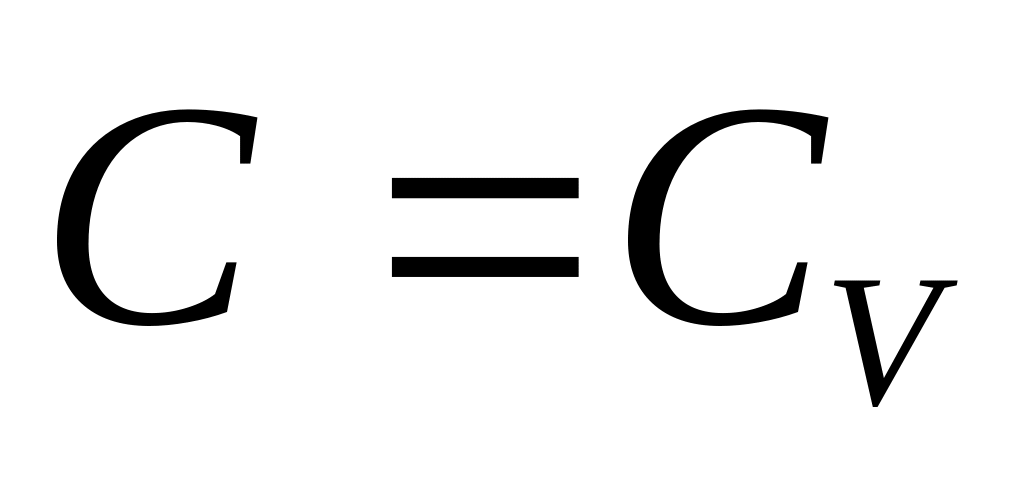
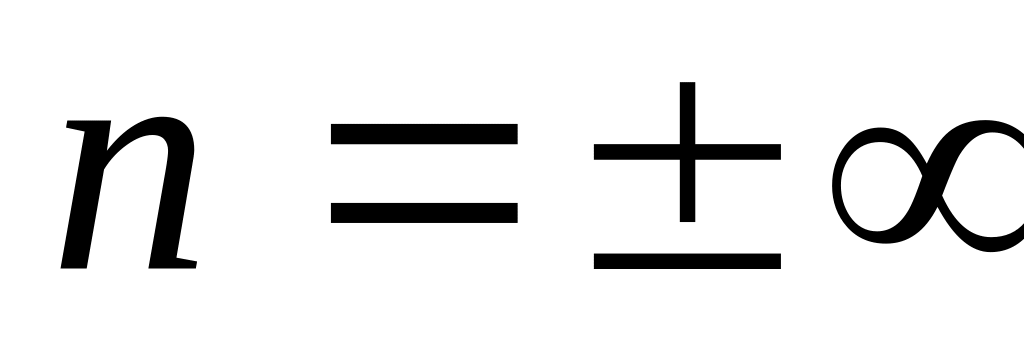
Изотермиялық
процесс кезінде жылу сыйымдылық шексіз
үлкен,
![]() бұл кезде
бұл кезде
![]() .
.
Адиабаталық
процесс кезінде жылу сыйымдылық нольге
тең.
![]() ,
бұл уақытта
,
бұл уақытта
![]() .
.
Дөңгелек процестер (немесе цикл деп) жүйе қатарынан бірнеше күйді өтіп бастапқы күйіне келетін процесті айтады. координатында цикл тұйық қисықпен берілген, мұндағы 1-2 ұлғаюға, 2-1 сығылуға сай келеді.
Ұлғаю
жұмысы
![]() фигура ауданы) оң таңбалы:
фигура ауданы) оң таңбалы:
![]() .
.
Сығылу
жұмысы
![]() фигура ауданы) теріс
фигура ауданы) теріс
![]() .
.
Ц икл
бойындағы А жұмыс тұйық қисық қамтитын
ауданмен анықталады:
икл
бойындағы А жұмыс тұйық қисық қамтитын
ауданмен анықталады:
![]() .
.
Сонымен жұмыс термодинамикалық жүйенің күйінің функциясы ғана емес, өтетін процестің түрінің де функциясы.
Сондықтан жұмыс күйдің бір мәнді функциясы ғана болып табылмайды (ішкі энергия сияқты).
Термодинамиканың бірінші бастамасынан жылу , сонымен бірге А жұмыс жүйемен жүретін процестің функциясы болып саналады.
Егер
цикл бойында оң жұмыс атқарылса, онда
цикл тура деп аталады (цикл сағат тілі
бағытымен жүреді А-сурет)
![]() .
.
Егер
циклде теріс таңбалы жұмыс жасаса, онда
![]() ( цикл сағат тілінің бағытына қарсы
өтеді, Б-сурет) цикл кері деп аталады.
( цикл сағат тілінің бағытына қарсы
өтеді, Б-сурет) цикл кері деп аталады.
Тура цикл жылу қозғалтқыштарында пайдаланылады (алынған жылу есебiнен жұмыс жасалынады. Керi процестер суытқыш машиналарда пайдаланылады (сыртқы күштің жұмысының есебінен жылу үлкен температурадағы денеге өтеді).
Дөңгелек процестердің П.Э.К.
Дөңгелек
процестің нәтижесінде жүйе бастапқы
күйіне оралады, сонымен ішкі энергияның
толық өзгеруі нольге тең. Сондықтан
![]() ,
яғни цикл бойында жасалған жұмыс, алынған
жылу мөлшеріне тең. Егер дөңгелек процесс
кезінде жүйе тек
жылу мөлшерін алып қоймай, сонымен қатар
,
яғни цикл бойында жасалған жұмыс, алынған
жылу мөлшеріне тең. Егер дөңгелек процесс
кезінде жүйе тек
жылу мөлшерін алып қоймай, сонымен қатар
![]() жылу
мөлшерін жоғалтатын (беретін) болса,
онда
жылу
мөлшерін жоғалтатын (беретін) болса,
онда
![]() .
.
Дөңгелек процесс үшін пайдалы әсер коэффициенті дегеніміз жүйенің циклдағы жасайтын жұмысының осы цикл бойында алған жылу мөлшеріне қатынасына тең шама.
![]() .
.
Қайтымды және қайтымсыз процестер.
Егер термодинамикалық процесс тура бағытта да, кері бағытта да өте алатын болса, онда ол қайтымды процесс деп аталады. Әрі, егер мұндай процесс алдымен тура бағытта, сосын кері бағытта өтсе және жүйе бастапқы орнына қайтып оралса, онда бұл жүйені қоршаған ортада ешқандай өзгеріс болмайды. Барлық осы шартты қанағаттандырмайтын процесс қайтымсыз болып есептелінеді.
Нақты процестер қайтымсыз, онда барлық уақытта энергияның диссипациясы (жоғалуы) (үйкелістен, жылуөткізгіштіктен т.б) болады. Қайтымды процесс –бұл физикалық модель – бұл нақты процестердің идеализациясы.
Энтропия.
Бір күйден екінші күйге өткенде жүйеге берілген немесе одан алынған жылу мөлшері бастапқы және соңғы күйлермен бір мәнді анықталмайды, бірақ осы өтудің өту тәсіліне елерліктей байланыста болады ( жүйенің күйінің функциясы болып табылмайды).
Бірақта, келтірілген жылу мөлшері - жүйенің күйінің шексіз аз өзгерісі кезінде жылу мөлшерінің Т температураға қатынасы – жүйенің күйінің функциясы болып табылады..
![]()
Сонымен, интеграл астындағы өрнек кейбір функцияның толық дифференциалы, осы күйге жүйе қандай жолмен келгеніне байланыссыз, ол жүйенің тек бастапқы және соңғы күйімен анықталады.
Энтропия
жүйе
күйінің функциясы деп аталады, оның
дифференциалы![]() болып саналады.
болып саналады.
![]()
Яғни термодинамиканың бірінші бастамасынмына түрде жазуға болады.
![]()
осыдан
![]() .
.
![]() функциясы,
жүйе күйінің функциясы болып табылады
және Гельмгольц
энергиясы
немесе еркін
энергия
деп аталады.
функциясы,
жүйе күйінің функциясы болып табылады
және Гельмгольц
энергиясы
немесе еркін
энергия
деп аталады.
Энтропия өзгерісі.
Тұйық
жүйеде қайтымды процестер үшін
![]() ;
қайтымсыз циклдар үшін
;
қайтымсыз циклдар үшін
![]() .
.
Клаузиус теңсіздігі: тұйық жүйенің энтропиясы не өсуі мүмкін (қайтымсыз процесс жағдайында) немесе тұрақты қалуы мүмкін (қайтымды процестер үшін).
![]() .
.
![]() пен
бірдей
таңбалы болғандықтан энтропияның
өзгерісін жылу алмасу процесінің бағыты
мен анықтауға болады. Денені қыздырғанда
оның энтропиясы артады
,
суытқанда
дене энтропиясы кемиді
пен
бірдей
таңбалы болғандықтан энтропияның
өзгерісін жылу алмасу процесінің бағыты
мен анықтауға болады. Денені қыздырғанда
оның энтропиясы артады
,
суытқанда
дене энтропиясы кемиді
![]() .
.
Изоэнтропиялық
процесс деп тұрақты энтропияда (![]() )
өтетін процесті айтамыз.
)
өтетін процесті айтамыз.
Қайтымды
адиабаталық процесте
![]() ,
,
![]() ,
,
сондықтан адиабаталық процесс
изоэнтропиялық болып табылады.
,
,
сондықтан адиабаталық процесс
изоэнтропиялық болып табылады.
Мысал үшін 1 күйден 2-ші күйге тепе-тең өтетін идеал газды қарастырайық. Оның энтропиясының өзгерісі
![]()
,
![]() ,
,
![]() және
және
![]() пайдаланып
пайдаланып
 .
.
Идеал газ процестеріндегі энтропия өзгерісі.
Изохоралық
|
Изобаралық |
Изотермиялық |
Адиабаталық |
|
|
|
|
