
- •2. Механизм действия тиреоидных гормонов.
- •2. Гормоны кальциевого обмена
- •Кальцитриол
- •Регуляция синтеза и секреции
- •Механизм действия
- •1. Ферменты
- •5. Регуляция действия ферментов
- •Ингибиторы ферментов
- •Гипервитаминоз
- •Гиповитаминоз
- •Гипервитаминоз
- •Вит.К(филлохинон)
- •Переизбыток
- •Вит. F( арахидоновая, линолевая, линоленовая к-ты)
- •Окислительное декарбоксилирование пировиноградной кислоты
- •Цитратный цикл
- •14 Разобщители тканевого дыхания (динитроортокрезол)
- •Всасывание углеводов
- •Нарушение переваривания и всасывания углеводов
- •18. Биологическая роль, синтез и распад гликогена. Особенности распада гликогена в печени и скелетных мышцах.
- •31. Мобилизация липидов из жировых депо
- •37. Синтез и использование кетоновых тел. Понятие и причины кетонемии и кетонурии.
- •38. Липопротеины сыворотки крови: биологическая роль, особенности состава и разновидности. Понятие атерогенных и антиатерогенных липопротеинов.
- •39. Нарушения липидного обмена:
- •Симптомы заболевания
- •40. Понятие и разновидности азотистого баланса.
- •41. Особенности переваривания белков. Нормальные и патологические компоненты желудочного сока.
- •42. Гниение белков в толстом кишечнике.
- •43. Реакции дезаминирования аминокислот и их биологическая роль.
- •44. Трансаминирование аминокислот: биологическая роль реакций, использование в диагностике.Глюкозо-аланиновый цикл.
- •45. Декарбоксилирование аминокислот. Образование и биологическая роль биогенных аминов: гамма-аминомасляной кислоты (гамк), гистамина, серотонина, дофамина. Инактивация биогенных аминов.
- •46. Использование безазотистых остатков аминокислот: понятие, биологическая роль и примерыгликогенных и кетогенных аминокислот.
- •47. Источники образования аммиака в организме. Причины токсичности аммиака. Понятие гипераммониемии.
- •Причины токсичности аммиака
- •48. Пути обезвреживания аммиака и их особенности в почках, печени, нервной ткани.
- •51. Биологическая роль и биосинтез креатина.
- •52. Энзимопатии аминокислотного обмена (метаболические блоки и клинические проявления) :
- •II. Синтез пуриновых нуклеотидов
- •56. Синтез пиримидиновых нуклеотидов dе novo его регуляция
- •58. Ингибиторы синтеза тимидиловых нуклеотидов
- •Секреция
- •Механизм
- •77. Медицинские показания и правило проведения теста «сахарной нагрузки» (теста толерантности к глюкозе).
- •78. Адреналин - гормон мозгового вещества надпочечников: схема синтеза и названия ферментов. Механизм действия адреналина и его влияние на обмен веществ.
- •Аденилатциклазный механизм
- •Кальций-фосфолипидный механизм
- •79. Гормоны коры надпочечников: классификация по химической структуре, схема основных этапов синтеза из холестерола, механизм действия.
- •1. Биосинтез йодтиронинов
- •2. Регуляция синтеза и секреции йодтиронинов
- •3. Механизм действия и биологические
- •4. Заболевания щитовидной железы
- •85. Биохимические характеристики гипо- и гиперфункции щитовидной железы.
- •86. Паратгормон: структура, механизм действия и роль в метаболизме кальция и фосфатов.
- •87. Кальцитонин: структура, механизм действия и роль в метаболизме кальция и фосфатов.
- •88. Кальцитриол: структура, этапы синтеза, механизм действия и роль в метаболизме кальция и фосфатов. Рахит.
- •90. Эйкозаноиды:классификация, этапы бисинтеза, примеры соединений. Биологические эффекты эйкозаноидов. Механизм действия нестероидных противовоспалительных препаратов на примере аспирина.
- •94. Ферменты сыворотки крови: их происхождение и значение для диагностики заболеваний.
- •95. Буферные системы крови. Нарушения кислотно-щелочного равновесия крови.
- •109. Изменения в соединительной ткани при старении, коллагенозах, мукополисахаридозах. Роль соединительной ткани в заживлении ран
- •Ситуационные задачи по биохимии для студентов лечебного факультета
- •Эталон ответа
- •Эталон ответа
- •Эталон ответа
- •Задача №42
- •Эталон ответа
- •Задача №43
- •Эталон ответа
- •Задача №44
- •Эталон ответа
- •Задача №45
- •Эталон ответа
- •Ситуационные задачи по биохимии для студентов лечебного факультета
- •Эталон ответа
- •Эталон ответа
- •Эталон ответа
- •Задача №42
- •Эталон ответа
- •Задача №43
- •Эталон ответа
- •Задача №44
- •Эталон ответа
- •Задача №45
- •Эталон ответа
95. Буферные системы крови. Нарушения кислотно-щелочного равновесия крови.
Гидрокарбонатный буфер. В крови существует целый ряд буферных систем. Рассмотрим гидрокарбонатную систему. Она состоит из относительно слабой угольной кислоты, образующей при гидратации СО2 сопряженногооснования - гидрокарбоната СО2 +Н2О - Н2СО3 - Н+ + НСО3¯ Уравнение Гендерсона-Гассельбаха для этой реакции имеет вид : РН = рК' + lg При ионной силе плазмы рК' составляет 6,1. Казалось бы, при таком различии между рК ' и рН крови (7,4) емкость гидрокарбонатного буфера должна быть невелика. Однако, на самом деле, гидрокарбонатная система играет большую роль в создании общей буферной емкости крови, т.к. буферный эффект этой системы существенно увеличивается благодаря ее тесной связи с дыханием. Механизмы, направленные на поддержание напряжения СО2 в артериальной крови способствуют созданию высокой концентрации НСО3¯ в плазме. Поддерживая напряжение СО2 в крови, дыхательная система обеспечивает высокое содержание буферных соединений. Фосфатный буфер Фосфатная буферная система образована неорганическими фосфатами в крови. Состоит из слабой кислоты Н2РО4¯ сопряженного основания НРО2¯. В основе ее действия лежит КЩР : Н2РО4¯ - Н+ + НРО4¯ . Эта буферная система способна сопротивляться изменению рН в интервале 6,2- 8,2, т.е. обеспечивает значительную долю буферной емкости крови. рК' фосфатного буфера (6,8). сравнительно близка к рН крови, однако, емкость данного буфера невелика в связи с низким содержанием фосфата в крови. Белковый буфер Особенное значение гемоглобиновой буферной системы заключается в том, что кислотность гемоглобина зависит от степени его оксигенации. Эта зависимость отражена на рис.2 На этом рисунке приведены буферные кривые недиффундирующих буферных систем эритроцитов, красная кривая соответствует оксигенированному, а черная - дезоксигенированному состоянию гемоглобина. Видно, что при нормальных пределах рН оксигемоглобина является более сильной кислотой, чем дезоксигемоглобин. Такая разница обусловлена влиянием О2 , связанного с Fe, на сродство ближайших имидазольных групп гистидина к Н+. Благодаря этому гемоглобин, освобождаясь в тканях от О2 , приобретает большую способность к связыванию ионов Н+, а в венозной крови в результате выделения СО2 тканями происходит накопление в крови этих ионов. При поглощении О2 в легких происходят обратные процессы. Т.о. обмен О2 потенциирует буферный эффект гемоглобина Буферные основания Буферные свойства крови обусловлены анионами всех слабых кислот, важнейшими из них являются гидрокарбонаты и анионные группы белков. Все эти анионы, вместе взятые, называются буферными основаниями. На рис.3 приведены концентрации различных ионов в плазме, эритроцитах и цельной крови. Высота различных столбиков пропорциональна содержанию ионов. Из рисунка видно, что в плазме бо'льшая часть буферных оснований приходиться на долю ионов НСО3 ¯ , а в эритроцитах на долю анионных групп белков. Содержание ВВ ( буферных оснований ) в артериальной крови составляет примерно 48 ммоль/ л. Очень важно, что эта величина не изменяется при сдвигах напряжения СО2 . Так, если последнее возрастает, образуются эквивалентные количества Н+ и НСО3¯ . Ионы Н+ почти полностью связываются протеинатами, переходящими при этом в недиссоциированную форму. В результате содержание протеинатов снижается настолько, насколько увеличивается концентрация гидрокарбонатов. Поскольку общее количество буферных оснований крови не зависит от Р(СО2); по величине ВВ можно судить о сдвигах КЩР, связанных с увеличением или уменьшением содержания кислот в крови.
Ацидоз и алкалоз При ряде патологических состояний в крови накапливаются такие большие количества кислот или оснований, что описанные выше регуляторные системы (буферные системы крови, дыхательная и выделительная системы) уже не могут поддерживать рН на постоянном уровне. В зависимости от того, в какую сторону изменяется реакция крови, различают 2 типа нарушений КЩР. Понижение рН крови по сравнению с нормальным уровнем (рН ‹ 7,37) называется ацидозом, а повышение (рН › 7,43) - алкалозом. Каждый из этих двух типов подразделяется еще на несколько разновидностей в зависимости от причины сдвига рН. Такие сдвиги могут наступать при изменениях вентиляции легких (поражения легких могут сопровождаться увеличением напряжения СО2 в крови, и гипервентиляции приводят к снижению этого напряжения. Подобные состояния называют дыхательным (респираторным) ацидозом или алкалозом.
96. Биохимия свертывающей системы крови: компоненты, механизм активации и функционирование каскадной системы свертывания крови. Роль витамина К в процессе свертывания крови. Калликреин - кининовая система. Гемофилии как врожденные нарушения светывания крови.
Компоненты системы свертывания крови принято называть "факторами". Факторы бывают тканевыми, плазменными и тромбоцитарными. Тканевые и плазменные факторы обозначаются римскими цифрами, а тромбоцитарные - арабскими. Большинство белков системы свертывания крови обладает ферментативной активностью. Все факторы свертывания крови, кроме фXIII, являются сериновыми протеиназами, которые катализируют реакции ограниченного протеолиза.В ходе реакций свертывания крови все белки-ферменты сначала выступают в роли субстрата, а затем - в роли фермента. Среди белков, участвующих в свертывании крови, есть такие, которые не обладают ферментативной активностью, но специфически ускоряют протекание ферментативной реакции. Они называются параферментами. .Есть 2 механизма свертывания крови - внешний и внутренний.Внешний механизм запускается с участием внешних (тканевых) факторов, внутренний - при участии факторов, источником которых служит сама кровь, плазма, собственно ферменты и форменные элементы крови. Различаются внешний и внутренний механизмы только начальными стадиями до активации протромбина (Фii). последующие стадии протекают одинаково и в том, и в другом случаях. Процесс свертывания крови совершается в виде каскадной реакции при последовательной активации белков-предшественников, или факторов свертывания,находящихся в крови или тканях. На этом основании различают внутреннюю (кровь) и внешнюю (ткань) свертывающие системы.Помимо системы свертывания, существует и противосвертывающая система, что обеспечивает регуляцию системы гемостаза - жидкое состояние крови в сосудистом русле в нормальных условиях. Исходя из этого, тромбоз представляет собой проявление нарушенной регуляции системы гемостаз
Хорошо известна роль витамина К в процессе свертывания крови. В образование кровяного сгустка вовлечены по крайней мере 13 различных белков, а витамин К необходим для синтеза шести из них, особенно для белка протромбина. Если хотя бы один из этих необходимых белков отсутствует, то кровь не сможет свернуться, что приводит к геморрагической болезни. Другими словами, при порезе артерии или вены кровь невозможно остановить.Причиной геморрагической болезни является недостаточность витамина К, который в свою очередь является результатом малабсорбции жиров (при болезни печени, болезни Крона или язвенном колите) или разрушением бактериальной флоры после длительного приема антибиотиков. Перед хирургической операцией пациентам часто дают витамин К для профилактики избыточного кровотечения, но только при недостаточности витамина К.
Калликреин - кининовая система (ККС) является ключевой протеолитической системой, участвующей в регуляции широкого спектра физиологических функций организма и развитии многих патологических состояний.Интерес к калликреин - кининовой системе (ККС) обусловлен ее участием в регуляции многообразных функций организма. Так, хорошо известно о центральной роли ККС в регуляции активности каскадных протеолитических систем плазмы крови: кининогенеза , гемокоагуляции , фибринолиза , комплемента и ренин - ангиотензиновой системы , обеспечивающих процессыадаптации и защиты организма . ККС тканей контролирует различные стадии морфогенеза клеток некоторых тканей, реакции иммунного ответа, развитие воспаления, шока различной этиологии, тромбозов, геморрагий, злокачественных новообразований и других патологических состояний. Участие ККС в широком спектре биологических функций организма определяется прежде всего полифункциональностью отдельных компонентов этой системы, их структурно - функциональными особенностями.
Гемофилия – врожденная болезнь. Гемофилия обычно передается по наследству, то есть, через гены родителей. Гены несут сведения о развитии клеток тела в период роста ребенка. В частности, они определяют цвет волос или глаз. Иногда гемофилия встречается у людей, в семьях оторых не известны случаи этой болезни. Это называется спорадической гемофилией. Около 30% больных гемофилией получают ее не через гены родителей. Болезнь у них вызвана изменениями в генах самого больного. Женщины, имеющие ген гемофилии, называются носители. У них могут проявляться симптомы гемофилии, и они могут передавать заболевание своим детям. Вероятность того, что их сыновья будут больны гемофилией, а дочери станут носители ее гена, составляет 50%.
Три степени тяжести заболевания.Тяжесть заболевания означает, насколько серьезно состояние больного. Степень тяжести заболевания зависит от того, насколько больному не хватает фактора свертываемости крови.Норма = 50% - 150% обычной активности фактора свертываемости VIII (8) или IX (9) в крови.

Каковы симптомы гемофилии? • большие синяки;• внутримышечные и внутрисуставные кровотечения, особенно в коленных, локтевых и голеностопных суставах; • единичные кровотечения (внезапные внутренние кровотечения без видимой причины);• длительные кровотечения после пореза, удаления зуба или операции;• длительное кровотечение после несчастного случая, особенно при ранении головы.
108
Биосинтез коллагена
Предшественник коллагена (препропептид) синтезируется на рибосомах на поверхности гранул ШЭР. Прежде чем превратиться в зрелую форму белок-предшественник подвергается значительнойпосттрансляционной модификации в эндоплазматическом ретикулуме и аппарате Гольджи (см. рис.225). Отщепление сигнального пептида (1) приводит к образованию проколлагена. Молекула проколлагена все еще несет на одном конце длинный пропептид. Далее следует гидроксилирование многих остатков пролина и ряда остатков лизина (2). Некоторые остатки гидроксилизина дополнительно гликозилируются (3). Окисление остатков цистеина приводит к образованию внутри- и межмолекулярных дисульфидных связей (4), которые обеспечивают правильное скручивание полипептидных цепей в тройную спираль (5). Прежде чем секретироваться в межклеточное пространство, молекула проколлагена должна пройти стадии модификации и правильной сборки. В процессе транспорта через плазматическую мембрану отщепляются N- и С-концевые пропептиды (6). Коллаген выходит из клетки и в результате ступенчатой сборки образует микрофибриллы (7). Наконец, ε-аминогруппы некоторых остатков лизина подвергаются ферментативному окислению с образованием альдегидных групп (8). Последний этап — конденсация (9) с образованием внутри- и межмолекулярных поперечных связей, в результате чего фибриллы коллагена приобретают окончательную структуру, характеризующуюся прочностью на разрыв и высокой устойчивостъю к действию протеиназ.
В организме коллагены выполняют разнообразные биологические функции (см. с. 336). О важной роли коллагенов убедительно свидетельствует множество наследственных генетических дефектов,связанных с мутациями в молекулах коллагенов или ферментов, принимающих участие в их биосинтезе. Такие дефекты могут оказывать влияние на структуру и функцию цитоскелета, связок, сухожилий, кожи, глаз, кровеносных сосудов, волос и даже размеров тела (примером служит синдром Элера-Данлоса).
Гидроксилирование остатков пролина и лизина в молекуле проколлагена катализируется проколлаген-гидроксилазами, имеющими в активном центре атомы железа. В качестве кофермента используется аскорбат (витамин С, см. с. 356). Симптомы дефицита витамина С, такие, как выпадение зубов, кровоточивость десен или повреждения кожи (цинга), объясняются нарушением биосинтеза коллагенов.
Гидроксилирование пролина и лизина начинается в период трансляции коллагеновой мРНК на рибосомах и продолжается на растущей полипептидной цепи вплоть до её отделения от рибосом. После образования тройной спирали дальнейшее гидроксилирование пролиловых и лизиловых остатков прекращается.
Реакции гидроксилирования катализируют ок-сигеназы, связанные с мембранами микросом. Пролиловые и лизиловые остатки в Y-положении пептида (Гли-х-у)n подвергаются действию, соответственно, пролил-4-гидроксилазы и лизил-5-гидроксилазы. Пролил-3-гидроксилаза действует на некоторые остатки пролина в Х-положениях. Необходимыми компонентами этой реакции являются оскетоглутарат, О2 и витамин С (аскорбиновая кислота). Донором атома кислорода, который присоединяется к С-4 пролина, является молекула О2, второй атом О2 включается в сукцинат, который образуется при декарбоксилировании α-кетоглутарата, а из карбоксильной группы а-кетоглутарата образуется СО2 (см. схему А на с. 691).

Гидроксилазы пролина и лизина содержат в активном центре атом железа Fe2+. Для сохранения атома железа в ферроформе необходим восстанавливающий агент. Роль этого агента выполняет кофермент гидроксилаз - аскорбиновая кислота, которая легко окисляется в дегидроаскорбиновую кислоту. Обратное превращение происходит в ферментативном процессе за счёт восстановленного глутатиона (см. схему Б на с. 691).

Фибриллы коллагена образуются спонтанно, путём самосборки. Но эти фибриллы ещё не являются зрелыми, так как не обладают достаточной прочностью (известно, что зрелое коллагеновое волокно толщиной в 1 мм выдерживает нагрузку до 10 кг).
Образовавшиеся коллагеновые фибриллы укрепляются внутри- и межцепочечными ковалентными сшивками (они встречаются только в коллагене и эластине). Эти сшивки образуются следующим образом:
-
внеклеточный медьсодержащий фермент ли-зилоксидаза осуществляет окислительное дезаминирование ε-аминогрупп в некоторых остатках лизина и гидроксилизина с образованием реактивных альдегидов (аллизина и гидроксиаллизина). Для этих реакций необходимо присутствие витаминов РР и В6 (рис. 15-4).
-
образовавшиеся реактивные альдегиды участвуют в формировании ковалентных связей между собой, а также с другими остатками лизина или гидроксилизина соседних молекул тропоколлагена, и в результате возникают поперечные "Лиз-Лизсшивки", стабилизирующие фибриллы коллагена (рис. 15-5).
Количество поперечных связей в фибриллах коллагена зависит от функции и возраста ткани. Например, между молекулами коллагена

Рис. 15-3. Схема ступенчатого расположения молекул коллагена в коллагеновой фибрилле.
693
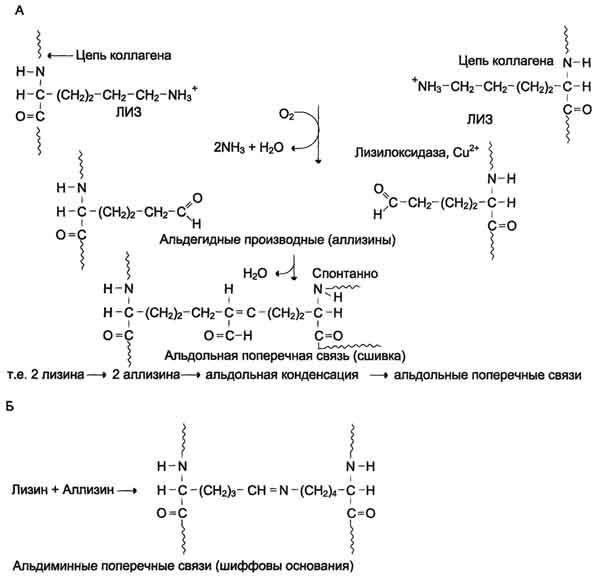
Рис. 15-4. Образование поперечных связей в коллагене. А - образование альдольной поперечной сшивки из двух боковых цепей лизина; Б - образование шиффовых оснований из боковых цепей лизина и аллизина.
ахиллова сухожилия сшивок особенно много, так как для этой структуры важна большая прочность. С возрастом количество поперечных связей в фибриллах коллагена возрастает, что приводит к замедлению скорости его обмена у пожилых и старых людей.
При снижении активности лизилоксидазы, а также при недостатке меди или витаминов РР или В6 нарушается образование поперечных сшивок и, как следствие, снижаются прочность и упругость коллагеновых волокон. Такие структуры, как кожа, сухожилия, кровеносные сосуды, становятся хрупкими, легко разрываются. Подробнее эти вопросы рассматриваются ниже в подразделе, посвящённом эластину.
