
- •2. Механизм действия тиреоидных гормонов.
- •2. Гормоны кальциевого обмена
- •Кальцитриол
- •Регуляция синтеза и секреции
- •Механизм действия
- •1. Ферменты
- •5. Регуляция действия ферментов
- •Ингибиторы ферментов
- •Гипервитаминоз
- •Гиповитаминоз
- •Гипервитаминоз
- •Вит.К(филлохинон)
- •Переизбыток
- •Вит. F( арахидоновая, линолевая, линоленовая к-ты)
- •Окислительное декарбоксилирование пировиноградной кислоты
- •Цитратный цикл
- •14 Разобщители тканевого дыхания (динитроортокрезол)
- •Всасывание углеводов
- •Нарушение переваривания и всасывания углеводов
- •18. Биологическая роль, синтез и распад гликогена. Особенности распада гликогена в печени и скелетных мышцах.
- •31. Мобилизация липидов из жировых депо
- •37. Синтез и использование кетоновых тел. Понятие и причины кетонемии и кетонурии.
- •38. Липопротеины сыворотки крови: биологическая роль, особенности состава и разновидности. Понятие атерогенных и антиатерогенных липопротеинов.
- •39. Нарушения липидного обмена:
- •Симптомы заболевания
- •40. Понятие и разновидности азотистого баланса.
- •41. Особенности переваривания белков. Нормальные и патологические компоненты желудочного сока.
- •42. Гниение белков в толстом кишечнике.
- •43. Реакции дезаминирования аминокислот и их биологическая роль.
- •44. Трансаминирование аминокислот: биологическая роль реакций, использование в диагностике.Глюкозо-аланиновый цикл.
- •45. Декарбоксилирование аминокислот. Образование и биологическая роль биогенных аминов: гамма-аминомасляной кислоты (гамк), гистамина, серотонина, дофамина. Инактивация биогенных аминов.
- •46. Использование безазотистых остатков аминокислот: понятие, биологическая роль и примерыгликогенных и кетогенных аминокислот.
- •47. Источники образования аммиака в организме. Причины токсичности аммиака. Понятие гипераммониемии.
- •Причины токсичности аммиака
- •48. Пути обезвреживания аммиака и их особенности в почках, печени, нервной ткани.
- •51. Биологическая роль и биосинтез креатина.
- •52. Энзимопатии аминокислотного обмена (метаболические блоки и клинические проявления) :
- •II. Синтез пуриновых нуклеотидов
- •56. Синтез пиримидиновых нуклеотидов dе novo его регуляция
- •58. Ингибиторы синтеза тимидиловых нуклеотидов
- •Секреция
- •Механизм
- •77. Медицинские показания и правило проведения теста «сахарной нагрузки» (теста толерантности к глюкозе).
- •78. Адреналин - гормон мозгового вещества надпочечников: схема синтеза и названия ферментов. Механизм действия адреналина и его влияние на обмен веществ.
- •Аденилатциклазный механизм
- •Кальций-фосфолипидный механизм
- •79. Гормоны коры надпочечников: классификация по химической структуре, схема основных этапов синтеза из холестерола, механизм действия.
- •1. Биосинтез йодтиронинов
- •2. Регуляция синтеза и секреции йодтиронинов
- •3. Механизм действия и биологические
- •4. Заболевания щитовидной железы
- •85. Биохимические характеристики гипо- и гиперфункции щитовидной железы.
- •86. Паратгормон: структура, механизм действия и роль в метаболизме кальция и фосфатов.
- •87. Кальцитонин: структура, механизм действия и роль в метаболизме кальция и фосфатов.
- •88. Кальцитриол: структура, этапы синтеза, механизм действия и роль в метаболизме кальция и фосфатов. Рахит.
- •90. Эйкозаноиды:классификация, этапы бисинтеза, примеры соединений. Биологические эффекты эйкозаноидов. Механизм действия нестероидных противовоспалительных препаратов на примере аспирина.
- •94. Ферменты сыворотки крови: их происхождение и значение для диагностики заболеваний.
- •95. Буферные системы крови. Нарушения кислотно-щелочного равновесия крови.
- •109. Изменения в соединительной ткани при старении, коллагенозах, мукополисахаридозах. Роль соединительной ткани в заживлении ран
- •Ситуационные задачи по биохимии для студентов лечебного факультета
- •Эталон ответа
- •Эталон ответа
- •Эталон ответа
- •Задача №42
- •Эталон ответа
- •Задача №43
- •Эталон ответа
- •Задача №44
- •Эталон ответа
- •Задача №45
- •Эталон ответа
- •Ситуационные задачи по биохимии для студентов лечебного факультета
- •Эталон ответа
- •Эталон ответа
- •Эталон ответа
- •Задача №42
- •Эталон ответа
- •Задача №43
- •Эталон ответа
- •Задача №44
- •Эталон ответа
- •Задача №45
- •Эталон ответа
1. Ферменты
а) Химическая природа ферментов:
Ферменты(энзимы) — биологические катализаторы белковой природы, которые обеспечивают необходимые скорость и координацию биохимических реакций, составляющих обмен веществ(метаболизм).
б) Ферменты могут быть:
-
простыми
-
сложными (холоферменты) — имеют небелковую часть (белковая — апофермент, небелковая — простетическая группа (кофермент или кофактор)
Кофакторы — низкомолекулярные небелковые вещества, необходимые для реализации каталитической активности ферментов (биоорганические соединения разной химической природы или ионы металлов).
Ионы металлов либо связаны с апоферментом, либо входят в состав небелковой простетической группы — чаще всего порфиринового кольца геминовых ферментов (цитохромов, пероксидаз, каталазы).
Коферменты (коэнзимы) — биоорганические соединения небелковой природы, которые необходимы для действия фермента, а именно превращения субстрата в каталитическом акте.
Они могут соединяться с апоферментом нековалентными или ковалентными связями (в последнем случае они являются простетическими группами ферментного белка — флавиновые коферменты, перидоксальфосфат, липоевая кислота). Иногда коферменты образуют комплексы с апоферментом только в ходе каталитического процесса (НАД, НАДФ).
Классификация
-
по химической природе:
- производные витаминов (В1 — тиаминдифосфат, В2 — флавинмононуклеотид (ФМН), В6 — перидоксальфосфат (ПАЛФ), перидоксаминфосфат (ПАМФ), В3 — КоА, В12 — метилкобаламин (метил-В12), дезоксиаденозилкобаламин (DA-B12), Н (биотина) — карбоксибиотитн, В9 — тетрагидрофолиевая кислота(ТГФК)
- динуклеотиды (производные В2 — ФАД, В5 — НАД+, НАДФ+)
-нуклеотиды (производные пуринов и пиримидинов — АТФ, АДФ, ЦТФ, ЦДФ, УТФ, УДФ)
-комплексы порфиринов с ионами металлов
-
по типу катализируемой реакции:
-переносчики атомов водорода и электронов
-переносчики разных химических групп
-коферменты синтеза, изомеризации, расщепления углеродных связей
Самые распространенные:
НАД+, НАДФ+ входят в состав дегидрогеназ
ФАД, ФМН входят в состав дегидрогеназ и оксидаз
ПАЛФ, ПАМФ входят в состав аминотрансфераз и декарбоксилаз
КоА входит в состав ферментов ацилирования
Металлопрорфирины — компоненты цитохромов (Fe в цитохромах b, Cu в цитохромах а)
ТГФК участвует в переносе и оксидоредукции одноуглеводных радикалов
Липоевая кислота — окислительное декарбоксилирование
Карбоксибиотин — карбоксилирование
Тиаминдифосфат - окислительное декарбоксилирование, транскеталазные реакции
метил-В12 — метилирование
DA-В12 — изомеризация
в) Проферменты — функционально неактивные предшественники ферментов, подвергающиеся тем или иным преобразованиям (обычно расщеплению специфическими эндо- или экзопептидазами или гидролизу), в результате чего образуется каталитически активный продукт — фермент. Относятся к группе протеиназ. К ним относятся пепсиноген, активной формой которого является пепсин, трипсиноген — трипсин, химотрипсиноген — химотрипсин, прокарбоксилепептидазы — карбоксипептидазы (ферменты поджелудочной железы) и др. К зимогенам относятся ферменты свёртывания крови(факторы свёртывания крови), компоненты и факторы системы комплемента.
г) Изоферменты — множественные молекулярные формы одного и того же фермента. Катализируют одну и ту же реакцию, но отличаются по их физико-химическим (молекулярной массой, подвижностью при электрофорезе и тд) и каталитическим (разным сродством фермента с субстратом) свойствам. Разные изоферменты могут располагаться в разных органах и тканях.
Одним из самых ярких представителей является лактатдегидрогеназа (ЛДГ), катализирующая превращение пирувата в лактат. Есть 5 изоферментов ЛДГ. Их колличество в крови имеет диагностическое значение. Так ЛДГ1 может указывать на инфаркт миокарда, а ЛДГ5 на гепатит.
д) Мультиферментные комплексы катализируют последовательности спряженных биохимических реакций. Эти комплексы состоят из нескольких физически ассоциированных ферментов, каждый из которых катализирует определенную реакцию. Например, пируватдегидрогеназный комплекс.
Различают:
-
Растворимые мультиферментные системы, в которых отсутствует постоянная ассоциация между ферментами
-
Системы в которых отдельные ферменты соединены между собой, образуя комплексы, которые облегчают передачу субстратов между отдельными ферментами
-
Мембранно-связанные системы, в которых отдельные ферменты ассоциированы с липидным бислоем субклеточных органелл.
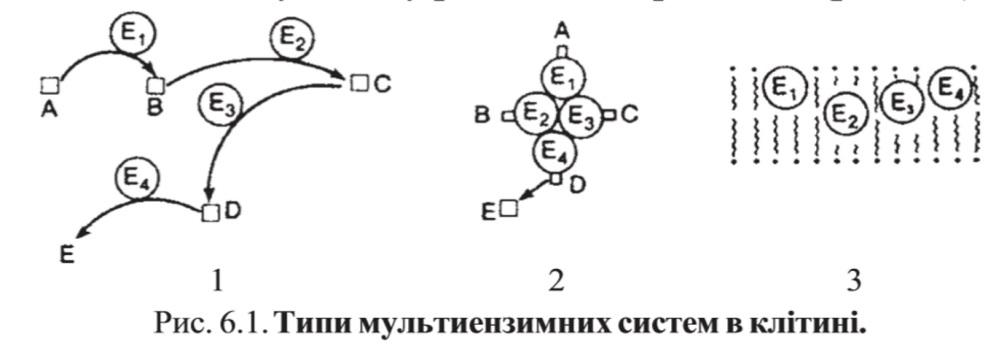
2. Классификация ( номенклатура) ферментов
А) принцип классификации
В) краткая характеристика основных классов ферментов, примеры
Классификация ферментов. В настоящее время известно более 2000 ферментов. Все ферменты разделены на шесть классов, каждый из которых имеет строго определенный номер.
-
Оксидоредуктазы катализируют окислительно-восстановительные процессы.
-
Трансферазы катализируют реакции переноса функциональных групп и молекулярных остатков с одной молекулы на другую.
-
Гидролазы катализируют реакции гидролиза.
-
Лиазы катализируют реакции отщепления (кроме атомов водорода) с образованием двойной связи либо присоединения по двойной связи, а также негидролитический распад органических соединений либо синтез без участия макроэргических веществ.
-
Изомеразы катализируют процессы изменения геометрической или пространственной конфигурации молекул.
-
Лигазы катализируют реакции синтеза, сопровождающиеся гидролизом богатой энергией связи (как правило, АТФ).
Классы ферментов делятся на подклассы, а подклассы, в свою очередь, на подподклассы. Подкласс уточняет действие фермента, так как указывает в общих чертах на природу химической группы субстрата. Подподкласс еще более конкретизирует действие фермента, уточняя природу атакуемой связи субстрата или природу акцептора, который участвует в реакции.
Система классификации предусматривает для каждого фермента специальный шифр, состоящий из четырех кодовых чисел, разделенных точками. Первая цифра в шифре обозначает номер класса, вторая - номер подкласса, третья - подподкласса и четвертая - порядковый номер в данном подподклассе. Так, лактатдегидрогеназа имеет шифр КФ 1.1.1.27, т.е. относится к первому классу, первому подклассу, первому подподклассу и занимает 27-е место в перечне ферментов упомянутого подподкласса.
Приведем конкретные примеры биохимических процессов, катализируемых ферментами, относящимися к определенному классу и подклассу.
1. Оксидоредуктазы. Общая схема процессов, катализируемых оксидоредуктазами, может быть выражена следующим образом:

55
Наиболее часто мы будем встречать оксидоредуктазы подкласса оксидаз и дегидрогеназ, поэтому рассмотрим их подробнее.
Оксидазы - это оксидоредуктазы, которые переносят атомы водорода или электроны непосредственно на атомы кислорода либо внедряют в молекулу субстрата атом кислорода:
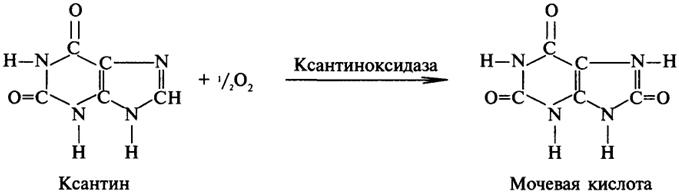
Дегидрогеназы - это оксидоредуктазы, катализирующие процесс отщепления атомов водорода.
Все дегидрогеназы являются холоферментами, коферментами которых служат следующие соединения: никотинамидаденинди-нуклеотид (НАД), никотинамидадениндинуклеотид (НАДФ), флавинмононуклеотид (ФМН), флавинадениндинуклеотид (ФАД), хиноны.
Наиболее распространены в природе дегидрогеназы, содержащие в качестве кофермента НАД:

Как видно из схемы, присоединение снятого с субстрата атома водорода происходит по ядру никотинамида. Механизм действия НАДФ такой же, как и НАД. НАД- и НАДФ-зависимые дегидрогеназы способны отщеплять атомы водорода от субстратов (спиртов, альдегидов,гидроксикислот, аминов и др.) в виде гидрид-ионов (Н-) и протонов (Н+), окисляя таким образом указанные соединения.
Примером процесса, катализируемого НАД-зависимой дегидрогеназой, может служить окисление молочной кислоты (лактата) до пировиноградной кислоты (пирувата):

Коферменты ФМН и ФАД содержат в своем составе фосфорилированный витамин В2 (рибофлавинфосфат), который способен отщеплять от субстрата два атома водорода:
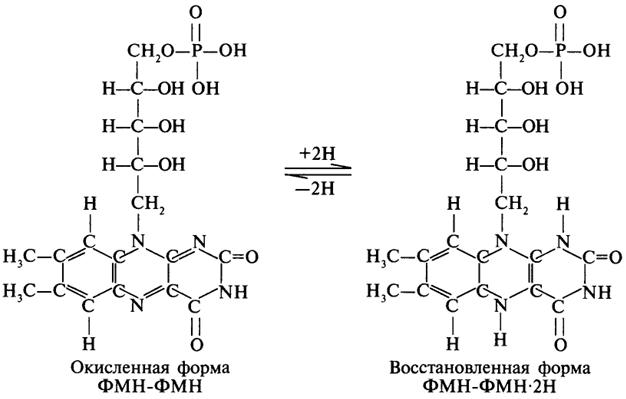
Пример реакции, катализируемой ФАД-зависимой дегидрогеназой:

2. Трансферазы. Это один из самых многочисленных классов ферментов. В зависимости от характера переносимых групп выделяют фосфотрансферазы, аминотрансферазы, гликозилтрансферазы, ацилтрансферазы и др.
Фосфотрансферазы - это ферменты, катализирующие перенос остатка фосфорной кислоты. В результате действия фосфотрансфераз образуются фосфорные эфиры различных органических соединений, многие из которых обладают повышенной реакционной способностью и более легко вступают в последующие реакции. Следовательно, фосфорилирование органических соединений можно считать процессом их активации. Чаще всего донором фосфатных групп является молекула аденозинтрифосфорной кислоты (АТФ). Фосфотрансферазы, использующие в качестве донора фосфатной группы молекулу АТФ, называются киназами. К киназам относится, например, глицеролкиназа, ускоряющая перенос остатка фосфорной кислоты от молекулы АТФ к молекуле глицерина:

Аминотрансферазы ускоряют перенос аминогруппы. Аминотрансферазы - двухкомпонентные ферменты, коферментом которых служит пиридоксальфосфат (фосфорилированный витамин В6).
Гликозилтрансферазы ускоряют реакции переноса гликозильных остатков, обеспечивая, главным образом, реакции синтеза и распада олиго- и полисахаридов. Если гликозильный остаток переносится на молекулу фосфорной кислоты, то процесс называетсяфосфоролизом, а ферменты, обеспечивающие этот процесс, называются фосфорилазами. В качестве примера приведем схему фосфоролиза мальтозы:

Донором гликозильных остатков в процессах синтеза олиго- и полисахаридов служат нуклеозиддифосфатсахара (НДФ-сахара), одним из представителей которых является уридиндифосфатглюкоза (УДФ-глюкоза):
 УДФ-глюкоза
УДФ-глюкоза
Ацилтрансферазы катализируют процессы переноса ацилов (радикалов карбоновых кислот) на спирты, амины, аминокислоты и другие соединения. Источником ацилов является ацил-КоА, который можно рассматривать в качестве кофактора в реакциях переноса ацильных групп. Примером реакции трансацилирования может служить реакция синтеза фосфатидной кислоты, в которой участвует фосфоглицерин и две молекулы ацил-КоА:

3. Гидролазы. Эти ферменты ускоряют реакции гидролиза органических соединений; обязательным участником этих процессов является вода. В зависимости от характера гидролизуемой связи гидролазы подразделяют на ряд подклассов: эстеразы, гликозидазы, пептидгидролазы и др. Отличительной чертой всех гидролаз является то, что они являются однокомпонентными ферментами.
59
Эстеразы катализируют реакции гидролиза сложноэфирных связей. Приведем примеры:
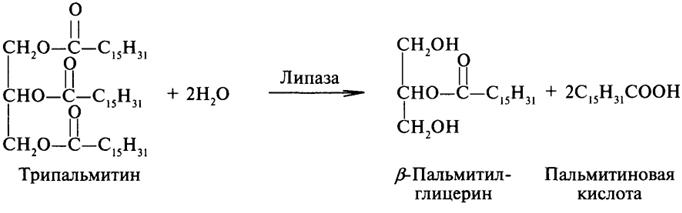
Липаза ускоряет гидролиз внешних сложноэфирных связей в молекуле триглицерида. Особенно широко распространены эстеразы, катализирующие гидролиз сложных эфиров фосфорной кислоты и углеводов. Эти ферменты называются фосфатазами:

Гликозидазы ускоряют реакции гидролиза гликозидных связей. Примером гликозидазы может служить мальтаза (α-глюкозидаза).
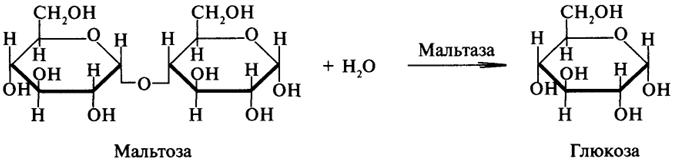
Из гликозидаз, действующих на полисахариды, наиболее распространены амилазы.
Пептид-гидролазы. Ферменты этого подкласса катализируют гидролиз пептидных связей в молекулах пептидов и белков, что можно выразить следующей схемой:
60

Пептид-гидролазы гидролизуют не все пептидные связи в молекулах белков и пептидов, а только определенные. О специфичности действия пептид-гидролаз речь пойдет в главе "Обмен белков".
Амидазы ускоряют гидролиз амидов дикарбоновых аминокислот - аспарагина и глутамина.

4. Лиазы. Ферменты этого класса катализируют разнообразные реакции распада и синтеза. В зависимости от того, какая связь расщепляется или, наоборот, образуется, выделяют углерод-углерод, углерод-кислород, углерод-азот лиазы. Приведем примеры процессов, катализируемых ферментами указанных подклассов.
Углерод-углерод лиазы. В природе широко представлены ферменты, ускоряющие декарбоксилирование кето- и аминокислот. Декарбоксилазы или карбокси-лиазы - двухкомпонентные ферменты, коферментом которых является фосфорный эфир витамина B1 - в случае декарбоксилирования кетокислот и витамина В6 - в случае декарбоксилирования аминокислот. Схемы процессов представлены ниже:

61
Углерод-кислород лиазы (гидролиазы). Ферменты этого подкласса ускоряют реакции гидратации и дегидратации органических соединений.
Эти реакции постоянно идут при распаде и синтезе углеводов и жирных кислот, поэтому гидратазы играют большую роль в жизнедеятельности организмов. Примером может служить фумаратгидратаза, присоединяющая молекулу воды к кратной связи фумаровой кислоты:

Углерод-азот лиазы катализируют реакции прямого дезаминирования некоторых аминокислот; примером может служить аспартат-аммиак-лиаза:

5. Изомеразы. Изомеразы ускоряют процессы превращений одних изомеров органических соединений в другие. Приведем два примера:

6. Лигазы (синтетазы). Ферменты этого класса обеспечивают синтез различных органических соединений. Характерной чертой ферментов этого класса является использование соединений, способных поставлять энергию для осуществления биосинтеза. Одним из таких соединений является аденозинтрифосфорная кислота - АТФ. В качестве примера действия лигазы можно привести синтез щавелевоуксусной кислоты из пировиноградной путем ее карбоксилирования:

Следует обратить внимание на тот факт, что молекула АТФ не участвует в образовании продуктов реакции, а просто распадается до АДФ и Н3РО4; при этом освобождается энергия, необходимая для осуществления биосинтеза.
Важной реакцией является образование ацил-коэнзима А (ацил-КоА), которая тоже ускоряется ферментом, относящимся к рассматриваемому классу:
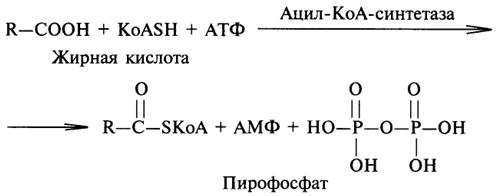
4. Механизм действия ферментов
Ферме́нты, или энзи́мы — обычно белковые молекулы или молекулы РНК (рибозимы) или их комплексы, ускоряющие (катализирующие) химические реакции в живых системах. Реагенты в реакции, катализируемой ферментами, называются субстратами, а получающиеся вещества — продуктами.
-
КФ 1: Оксидоредуктазы, катализирующие перенос электронов, то есть окисление или восстановление. Пример: каталаза, алкогольдегидрогеназа.
-
КФ 2: Трансферазы, катализирующие перенос химических групп с одной молекулы субстрата на другую. Среди трансфераз особо выделяют киназы, переносящие фосфатную группу, как правило, с молекулы АТФ.
-
КФ 3: Гидролазы, катализирующие гидролиз химических связей. Пример: эстеразы, пепсин, трипсин, амилаза, липопротеинлипаза.
-
КФ 4: Лиазы, катализирующие разрыв химических связей без гидролиза с образованием двойной связи в одном из продуктов, а также обратные реакции.
-
КФ 5: Изомеразы, катализирующие структурные или геометрические изменения в молекуле субстрата с образованием изомерных форм.
-
КФ 6: Лигазы, катализирующие образование химических связей C—C, C—S, C—O и C—N между субстратами за счёт реакций конденсации, сопряжённых с гидролизом АТФ. Пример: лигаза
А) понятие энергии активации ферментативных реакций:
Ферменты, действуя как катализаторы, снижают энергию активации. Они повышают общую скорость реакции, не изменяя в сколько-нибудь значительной степени температуру, при которой эта реакция протекает.
Б) активный центр ферментов: определение и структура:
Активный центр — это особая часть молекулы фермента, определяющая её специфичность и каталитическую активность. Активный центр непосредственно осуществляет взаимодействие с молекулой субстрата или с теми её частями, которые непосредственно участвуют в реакции. Характер взаимодействия фермента и субстрата говорит о наличии в активном центре ряда структурных групп, соединяющихся с различными участками субстрата.
В активном центре условно выделяют:
-
каталитический центр — непосредственно химически взаимодействующий с субстратом;
-
связывающий центр (контактная или «якорная» площадка) — обеспечивающий специфическое сродство к субстрату и формирование комплекса фермент-субстрат.
В)
теории образования фермент-субстратного
комплекса по Э. Фишеру и Д. Кошланду: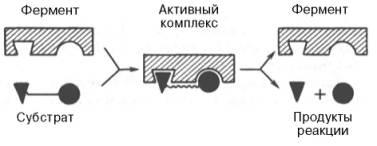
Образование нестойкого фермент-субстратного комплекса согласно теории Э. Фишера «ключ-замок».

Изменения структуры активного центра фермента, вызванные субстратом, согласно модели «индуцированного соответствия» Д. Кошленда.
Г) уравнение скорости ферментативной реакции, график зависимости скорости ферментативной реакции от концентрации субстрата (кривая субстратного насыщения), константа Михаэлиса и ее биологический смысл:
Уравне́ние Михаэ́лиса — Ме́нтен — основное уравнение ферментативной кинетики, описывает зависимость скорости реакции, катализируемой ферментом, от концентрации субстрата. Уравнение названо в честь физикохимиков Леонора Михаэлиса и Мод Леоноры Ментен. Простейшая кинетическая схема, для которой справедливо уравнение Михаэлиса:
![]()
Уравнение имеет вид:
![]() ,
,
где
-
 —
максимальная
скорость реакции, равная
—
максимальная
скорость реакции, равная  ;
; -
 —
константа
Михаэлиса. По определению,
—
константа
Михаэлиса. По определению,  ,
где
,
где 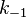 есть
константа скорости реакции распада
фермент-субстратного комплекса на
фермент и исходный субстрат,
есть
константа скорости реакции распада
фермент-субстратного комплекса на
фермент и исходный субстрат,  есть
константа скорости реакции образования
фермент-субстратного комплекса и
есть
константа скорости реакции образования
фермент-субстратного комплекса и  есть
константа скорости реакции распада
фермент-субстратного комплекса на
фермент и продукт (см. ниже вывод
уравнения для скорости реакции).
Константа Михаэлиса численно равна
концентрации субстрата, при которой
скорость реакции составляет половину
от максимальной[1];
есть
константа скорости реакции распада
фермент-субстратного комплекса на
фермент и продукт (см. ниже вывод
уравнения для скорости реакции).
Константа Михаэлиса численно равна
концентрации субстрата, при которой
скорость реакции составляет половину
от максимальной[1]; -
 —
концентрация
субстрата.
—
концентрация
субстрата.

график зависимости скорости ферментативной реакции от концентрации субстрата (кривая субстратного насыщения)
Константа Михаэлиса, Км (Michaelis constant, Km) — кинетический параметр ферментативной реакции, численно равный концентрации субстрата, при которой скорость реакции составляет половину максимальной; К.М. характеризует сродство фермента к субстрату: чем меньше значение К.М., тем сильнее связывание фермента с субстратом.
