
- •2. Механизм действия тиреоидных гормонов.
- •2. Гормоны кальциевого обмена
- •Кальцитриол
- •Регуляция синтеза и секреции
- •Механизм действия
- •1. Ферменты
- •5. Регуляция действия ферментов
- •Ингибиторы ферментов
- •Гипервитаминоз
- •Гиповитаминоз
- •Гипервитаминоз
- •Вит.К(филлохинон)
- •Переизбыток
- •Вит. F( арахидоновая, линолевая, линоленовая к-ты)
- •Окислительное декарбоксилирование пировиноградной кислоты
- •Цитратный цикл
- •14 Разобщители тканевого дыхания (динитроортокрезол)
- •Всасывание углеводов
- •Нарушение переваривания и всасывания углеводов
- •18. Биологическая роль, синтез и распад гликогена. Особенности распада гликогена в печени и скелетных мышцах.
- •31. Мобилизация липидов из жировых депо
- •37. Синтез и использование кетоновых тел. Понятие и причины кетонемии и кетонурии.
- •38. Липопротеины сыворотки крови: биологическая роль, особенности состава и разновидности. Понятие атерогенных и антиатерогенных липопротеинов.
- •39. Нарушения липидного обмена:
- •Симптомы заболевания
- •40. Понятие и разновидности азотистого баланса.
- •41. Особенности переваривания белков. Нормальные и патологические компоненты желудочного сока.
- •42. Гниение белков в толстом кишечнике.
- •43. Реакции дезаминирования аминокислот и их биологическая роль.
- •44. Трансаминирование аминокислот: биологическая роль реакций, использование в диагностике.Глюкозо-аланиновый цикл.
- •45. Декарбоксилирование аминокислот. Образование и биологическая роль биогенных аминов: гамма-аминомасляной кислоты (гамк), гистамина, серотонина, дофамина. Инактивация биогенных аминов.
- •46. Использование безазотистых остатков аминокислот: понятие, биологическая роль и примерыгликогенных и кетогенных аминокислот.
- •47. Источники образования аммиака в организме. Причины токсичности аммиака. Понятие гипераммониемии.
- •Причины токсичности аммиака
- •48. Пути обезвреживания аммиака и их особенности в почках, печени, нервной ткани.
- •51. Биологическая роль и биосинтез креатина.
- •52. Энзимопатии аминокислотного обмена (метаболические блоки и клинические проявления) :
- •II. Синтез пуриновых нуклеотидов
- •56. Синтез пиримидиновых нуклеотидов dе novo его регуляция
- •58. Ингибиторы синтеза тимидиловых нуклеотидов
- •Секреция
- •Механизм
- •77. Медицинские показания и правило проведения теста «сахарной нагрузки» (теста толерантности к глюкозе).
- •78. Адреналин - гормон мозгового вещества надпочечников: схема синтеза и названия ферментов. Механизм действия адреналина и его влияние на обмен веществ.
- •Аденилатциклазный механизм
- •Кальций-фосфолипидный механизм
- •79. Гормоны коры надпочечников: классификация по химической структуре, схема основных этапов синтеза из холестерола, механизм действия.
- •1. Биосинтез йодтиронинов
- •2. Регуляция синтеза и секреции йодтиронинов
- •3. Механизм действия и биологические
- •4. Заболевания щитовидной железы
- •85. Биохимические характеристики гипо- и гиперфункции щитовидной железы.
- •86. Паратгормон: структура, механизм действия и роль в метаболизме кальция и фосфатов.
- •87. Кальцитонин: структура, механизм действия и роль в метаболизме кальция и фосфатов.
- •88. Кальцитриол: структура, этапы синтеза, механизм действия и роль в метаболизме кальция и фосфатов. Рахит.
- •90. Эйкозаноиды:классификация, этапы бисинтеза, примеры соединений. Биологические эффекты эйкозаноидов. Механизм действия нестероидных противовоспалительных препаратов на примере аспирина.
- •94. Ферменты сыворотки крови: их происхождение и значение для диагностики заболеваний.
- •95. Буферные системы крови. Нарушения кислотно-щелочного равновесия крови.
- •109. Изменения в соединительной ткани при старении, коллагенозах, мукополисахаридозах. Роль соединительной ткани в заживлении ран
- •Ситуационные задачи по биохимии для студентов лечебного факультета
- •Эталон ответа
- •Эталон ответа
- •Эталон ответа
- •Задача №42
- •Эталон ответа
- •Задача №43
- •Эталон ответа
- •Задача №44
- •Эталон ответа
- •Задача №45
- •Эталон ответа
- •Ситуационные задачи по биохимии для студентов лечебного факультета
- •Эталон ответа
- •Эталон ответа
- •Эталон ответа
- •Задача №42
- •Эталон ответа
- •Задача №43
- •Эталон ответа
- •Задача №44
- •Эталон ответа
- •Задача №45
- •Эталон ответа
56. Синтез пиримидиновых нуклеотидов dе novo его регуляция
Субстраты из простых предшественников: СО2, глутамина, и аспарагиновой кислоты и затем связывается с рибозо-5-фосфатом, полученным от ФРДФ.
Процесс протекает в цитозоле клеток. Синтез ключевого пиримидинового нуклеотида - УМФ идёт с участием 3 ферментов, 2 из которых полифункциональны.
Медленный,многостадийный,энергозатратный (13реак., -6АТФ), контролируется регул. ферментами ( ГМФ, ИМФ-дегидрогеназа, АМФ-аденилосукцинатсинтетаза, ФРПФ-синтаза,амидотрасфераза).
Образование дигидрооротата
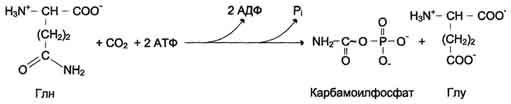
У млекопитающих ключевой, регуляторной реакцией в синтезе пирймидиновых нуклеотидов является синтез карбамоилфосфата из глутамина, СО2 и АТФ, в реакции катализируемой кар-бамоилфосфатсинтетазой II (КФС II), которая протекает в цитозоле клеток (рис. 10-12). В реакции NH 2-гpyппa карбамоилфосфата образуется за счёт амидной группы глутамина, что отличает эту реакцию от реакции синтеза карбамоилфосфата в митохондриях в процессе синтеза мочевины из СО 2, NH 3 и АТФ с участием КФС I.
Карбамоилфосфат, использующийся на образование пирймидиновых нуклеотидов, является продуктом полифункционального фермента, который наряду с активностью КФС II содержит каталитические центры аспартаттранскарбамоилазы и дигидрооротазы. Этот фермент назвали
"КАД-фермент" - по начальным буквам ферментативных активностей, которыми обладают отдельные каталитические домены этого белка. Объединение первых трёх ферментов метаболического пути в единый полифункциональный комплекс позволяет использовать почти весь синтезированный в первой реакции карбамоилфос-фат на взаимодействие с аспартатом и образование карбамоиласпартата, от которого отщепляется вода и образуется циклический продукт - дигидрооротат.
Отщепляясь от КАД-фермента, дигидрооротат подвергается дегидрированию NAD-зависимой дигидрооротатдегидрогеназой и превращается в свободное пиримидиновое основание - оротовую кислоту, или оротат.
Образование УМФ
В цитозоле оротат становится субстратом бифункционального фермента - УМФ-синтазы, которая обнаруживает оротатфосфорибозилтранс-феразную и ОМФ-декарбоксилазную активности. Первоначально фосфорибозильный остаток от ФРДФ переносится на оротат и образуется нук-леотид - оротидин-5'-монофосфат (ОМФ), декарбоксилирование которого даёт уридин-5-монофосфат (УМФ).
Таким образом, шесть последовательных реакций синтеза пиримидиновых нуклеотидов осуществляются тремя ферментами, которые кодируются в геноме человека тремя различными структурными генами.
Биосинтез УДФ, УТФ и иитидиловых нуклеотидов
УМФ под действием специфических нуклео-зидмонофосфат (НМФ) и нуклеозиддифосфат (НДФ) киназ превращается в УДФ и УТФ в результате переноса γ-фосфатного остатка АТФ на соответствующий субстрат.
НМФ-киназа катализирует следующую реакцию:
УМФ + АТФ → УДФ + АДФ,
а НДФ-киназа:
УДФ + АТФ → УТФ + АДФ.
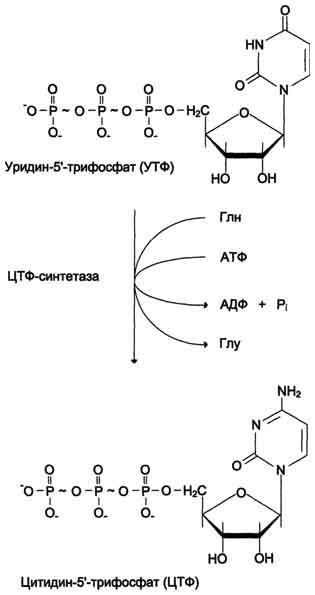
ЦТФ синтетаза катализирует амидирование УТФ (рис, 10-14), осуществляя АТФ-зависимое замещение кетогругшы урацила на амидную группу глутамина с образованием цитидин-5'-трифосфата (ЦТФ).
"Запасные" пути синтеза пиримидиновых нуклеотидов
Субстраты свободные азот. основ. из путей катаболизма пуринов.
Образование АМФ из аденина с пом. фер. аденинфосфорибозинтранс-за, ГМФ из гуанина с таким же фер., ИМФ из гипоксина с таким же фер.
Процесс намного быстрее, но энергосберегающий.
Отклонения: с-м Леша-Нихана- отсут. фермента, харак. умств. отсталость с опред. аутоагрессией.
Использование пиримидиновых оснований и нуклеозидов в реакциях реутилизации препятствует катаболизму этих соединений до конечных продуктов с расщеплением пиримидинового кольца. В ресинтезе пиримидинов участвуют некоторые ферменты катаболизма нуклеотидов. Так, уридинфосфорилаза в обратимой реакции может рибозилироватъ урацил с образованием уридина.
Урацил + Рибозо-1-фосфат → Уридин + Н3РО4 .
Превращение нуклеозидов в нуклеотиды катализирует уридин-цитидинкиназа.
Часть ЦМФ может превращаться в УМФ под действием цитидиндезаминазы и пополнять запасы уридиловых нуклеотидов.
ЦМФ + Н 2О → УМФ + NH3 .
Регуляция синтеза пиримидиновых НУКЛЕОТИДОВ
Регуляторным ферментом в синтезе пиримидиновых нуклеотидов является полифункциональный
Биосинтез УМФ de novo.

Синтез ЦТФ из УТФ
КАД-фермент. УМФ и пуриновые нуклеотиды аллостерически ингибируют, а ФРДФ активирует его карбамоилсинтетазную активность, тогда как активность аспартаттранскарбамоилазного домена ингибирует ЦТФ, но активирует АТФ.
Этот способ регуляции позволяет предотвратить избыточный синтез не только УМФ, но и всех других пиримидиновых нуклеотидов и обеспечить сбалансированное образование всех четырёх основных пуриновых и пиримидиновых нуклеотидов, необходимых для синтеза РНК.
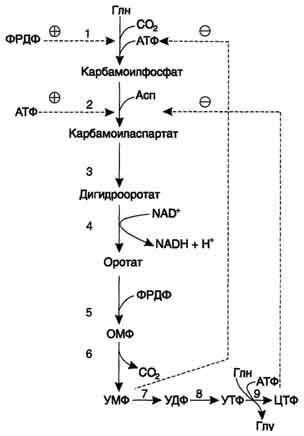
Регуляция синтеза пиримидиновых нуклеотидов. КАД-фермент катализирует реакции 1, 2, 3; дигидрооротатдегидрогеназа - реакцию 4; УМФ синтетаза - реакции 5 и 6; НМФ киназа - реакцию 7; НДФ киназа - реакцию 8; ЦТФ синтетаза - реацию 9.
