
- •2. Механизм действия тиреоидных гормонов.
- •2. Гормоны кальциевого обмена
- •Кальцитриол
- •Регуляция синтеза и секреции
- •Механизм действия
- •1. Ферменты
- •5. Регуляция действия ферментов
- •Ингибиторы ферментов
- •Гипервитаминоз
- •Гиповитаминоз
- •Гипервитаминоз
- •Вит.К(филлохинон)
- •Переизбыток
- •Вит. F( арахидоновая, линолевая, линоленовая к-ты)
- •Окислительное декарбоксилирование пировиноградной кислоты
- •Цитратный цикл
- •14 Разобщители тканевого дыхания (динитроортокрезол)
- •Всасывание углеводов
- •Нарушение переваривания и всасывания углеводов
- •18. Биологическая роль, синтез и распад гликогена. Особенности распада гликогена в печени и скелетных мышцах.
- •31. Мобилизация липидов из жировых депо
- •37. Синтез и использование кетоновых тел. Понятие и причины кетонемии и кетонурии.
- •38. Липопротеины сыворотки крови: биологическая роль, особенности состава и разновидности. Понятие атерогенных и антиатерогенных липопротеинов.
- •39. Нарушения липидного обмена:
- •Симптомы заболевания
- •40. Понятие и разновидности азотистого баланса.
- •41. Особенности переваривания белков. Нормальные и патологические компоненты желудочного сока.
- •42. Гниение белков в толстом кишечнике.
- •43. Реакции дезаминирования аминокислот и их биологическая роль.
- •44. Трансаминирование аминокислот: биологическая роль реакций, использование в диагностике.Глюкозо-аланиновый цикл.
- •45. Декарбоксилирование аминокислот. Образование и биологическая роль биогенных аминов: гамма-аминомасляной кислоты (гамк), гистамина, серотонина, дофамина. Инактивация биогенных аминов.
- •46. Использование безазотистых остатков аминокислот: понятие, биологическая роль и примерыгликогенных и кетогенных аминокислот.
- •47. Источники образования аммиака в организме. Причины токсичности аммиака. Понятие гипераммониемии.
- •Причины токсичности аммиака
- •48. Пути обезвреживания аммиака и их особенности в почках, печени, нервной ткани.
- •51. Биологическая роль и биосинтез креатина.
- •52. Энзимопатии аминокислотного обмена (метаболические блоки и клинические проявления) :
- •II. Синтез пуриновых нуклеотидов
- •56. Синтез пиримидиновых нуклеотидов dе novo его регуляция
- •58. Ингибиторы синтеза тимидиловых нуклеотидов
- •Секреция
- •Механизм
- •77. Медицинские показания и правило проведения теста «сахарной нагрузки» (теста толерантности к глюкозе).
- •78. Адреналин - гормон мозгового вещества надпочечников: схема синтеза и названия ферментов. Механизм действия адреналина и его влияние на обмен веществ.
- •Аденилатциклазный механизм
- •Кальций-фосфолипидный механизм
- •79. Гормоны коры надпочечников: классификация по химической структуре, схема основных этапов синтеза из холестерола, механизм действия.
- •1. Биосинтез йодтиронинов
- •2. Регуляция синтеза и секреции йодтиронинов
- •3. Механизм действия и биологические
- •4. Заболевания щитовидной железы
- •85. Биохимические характеристики гипо- и гиперфункции щитовидной железы.
- •86. Паратгормон: структура, механизм действия и роль в метаболизме кальция и фосфатов.
- •87. Кальцитонин: структура, механизм действия и роль в метаболизме кальция и фосфатов.
- •88. Кальцитриол: структура, этапы синтеза, механизм действия и роль в метаболизме кальция и фосфатов. Рахит.
- •90. Эйкозаноиды:классификация, этапы бисинтеза, примеры соединений. Биологические эффекты эйкозаноидов. Механизм действия нестероидных противовоспалительных препаратов на примере аспирина.
- •94. Ферменты сыворотки крови: их происхождение и значение для диагностики заболеваний.
- •95. Буферные системы крови. Нарушения кислотно-щелочного равновесия крови.
- •109. Изменения в соединительной ткани при старении, коллагенозах, мукополисахаридозах. Роль соединительной ткани в заживлении ран
- •Ситуационные задачи по биохимии для студентов лечебного факультета
- •Эталон ответа
- •Эталон ответа
- •Эталон ответа
- •Задача №42
- •Эталон ответа
- •Задача №43
- •Эталон ответа
- •Задача №44
- •Эталон ответа
- •Задача №45
- •Эталон ответа
- •Ситуационные задачи по биохимии для студентов лечебного факультета
- •Эталон ответа
- •Эталон ответа
- •Эталон ответа
- •Задача №42
- •Эталон ответа
- •Задача №43
- •Эталон ответа
- •Задача №44
- •Эталон ответа
- •Задача №45
- •Эталон ответа
Всасывание углеводов
Моносахариды всасываются эпителиальными клетками тощей и подвздошной кишок. Транспорт моносахаридов в клетки слизистой оболочки кишечника может осуществляться путём диффузии (рибоза, ксилоза, арабиноза), облегчённой диффузии с помощью белков переносчиков (фруктоза, галактоза, глюкоза), и путем вторично-активного транспорта (галактоза, глюкоза). Вторично-активный транспорт галактозы и глюкозы из просвета кишечника в энтероцит осуществляется симпортом с Na+. Через белок-переносчик Na+ двигается по градиенту своей концентрации и переносит с собой углеводы против их градиента концентраций. Градиент концентрации Na+ создаётся Nа+/К+-АТФ-азой.
При низкой концентрации глюкозы в просвете кишечника она транспортируется в энтероцит только активным транспортом, при высокой концентрации - активным транспортом и облегчённой диффузией. Скорость всасывания: галактоза > глюкоза > фруктоза > другие моносахариды. Моносахариды выходят из энтероцитов в направлении кровеносного капилляра с помощью облегченной диффузии через белки-переносчики.
Нарушение переваривания и всасывания углеводов
Недостаточное переваривание и всасывание переваренных продуктов называют мальабсорбцией. В основе мальабсорбции углеводов могут быть причины двух типов:
1). Наследственные и приобретенные дефекты ферментов, участвующих в переваривании. Известны наследственные дефекты лактазы, α-амилазы, сахаразно-изомальтазного комплекса. Без лечения эти патологии сопровождаются хроническим дисбактериозом и нарушениями физического развития ребёнка.
Приобретённые нарушения переваривания могут наблюдаться при кишечных заболеваниях, например гастритах, колитах, энтеритах, после операций на ЖКТ.
Дефицит лактазы у взрослых людей может быть связан со снижением экспрессии гена лактазы, что проявляться непереносимостью молока - наблюдается рвота, диарея, спазмы и боли в животе, метеоризм.
2). Нарушение всасывания моносахаридов в кишечнике.
Нарушения всасывания могут быть следствием дефекта какого-либо компонента, участвующего в системе транспорта моносахаридов через мембрану. Описаны патологии, связанные с дефектом натрийзависимого белка переносчика глюкозы.
Синдром мальабсорбции сопровождается осмотической диареей, усилением перистальтики, спазмами, болями, а также метеоризмом. Диарею вызывают нерасщеплённые дисахариды или невсосавшиеся моносахариды в дистальных отделах кишечника, а также органические кислоты, образованные микроорганизмами при неполном расщеплении углеводов.

18. Биологическая роль, синтез и распад гликогена. Особенности распада гликогена в печени и скелетных мышцах.
Многие ткани синтезируют в качестве резервной формы глюкозы гликоген. Синтез и распад гликогена обеспечивают постоянство концентрации глюкозы в крови и создают депо для её использования тканями по мере необходимости.
Синтез гликогена. Глюкоза, поступающая в клетку, фосфорилируется при участии АТФ (реакция 1). Затем глюкозо-6-фосфат в ходе обратимой реакции превращается в глюкозо-1 -фосфат (реакция 2) под действием фермента фосфоглюкомутазы. Реакция 3 - стадия образования уридинди-фосфатглюкозы из УТФ и глюкозо-1-фосфата. Фермент, катализирующий эту реакцию, назван по обратной реакции: УДФ-глюкопирофосфорилаза. Однако в клетке обратная реакция не протекает, потому что образовавшийся в ходе прямой реакции пирофосфат очень быстро расщепляется пирофосфатазой на 2 молекулы фосфата. Образованная УДФ-глюкоза далее используется как донор остатка глюкозы при синтезе гликогена (реакция 4). Эту реакцию катализирует фермент гликогенсинтаза (глюкозилтрансфераза). Так как гликоген в клетке никогда не расщепляется полностью, синтез гликогена осуществляется путём удлинения уже имеющейся молекулы полисахарида, называемой "затравка", или "праймер". К "затравке" последовательно присоединяются молекулы глюкозы. Строением молекулы "затравки" как бы предопределяется тип связи, который возникает в реакции трансгли-козилирования. Таким образом, синтезируется полисахарид, аналогичный по строению с "затравочным". В состав "затравки" может входить белок гликогенин, в котором к ОН-группе одного из тирозиновых остатков присоединена олигосахаридная цепочка (примерно 8 остатков глюкозы). Глюкозные остатки переносятся гликогенсинтазой на нередуцирующий конец олигосахарида и связываются α-1,4-гликозидными связями. По окончании синтеза гликогенин остаётся включённым в гранулу гликогена. Разветвлённая структура гликогена образуется при участии амило-1,4 →1,6-глюкозилтрансферазы, называемой ферментом "ветвления"
19.
Гликолиз — это сложный ферментативный процесс расщепления глюкозы до двух молекул пирувата (аэробный гликолиз) или двух молекул лактата (анаэробный гликолиз, протекающий без потребления кислорода).
Биологическая роль гликолиза: 1. Генерирование АТФ. Гликолиз — единственный процесс в клетках, продуцирующий АТФ без потребления кислорода. Клетки, имеющие мало или не имеющие вообще митохондрий, получают АТФ только в ходе гликолиза. Значение гликолиза для эритроцитов. Гликолиз — единственный процесс, продуцирующий АТФ в эритроцитах и поддерживающий их целостность и функции. 2. Является источником углеводородных радикалов для процессов биосинтеза в клетках Уравнения реакций
1.
2.
3.
4.
5.
6.
7.
8.

9.

10.

11.


20. Биологическая роль аэробного окисления глюкозы, его основные этапы и расчет энергии окисления глюкозы в аэробных условиях.
Аэробным называется окисление биологических субстратов с выделением энергии, протекающее при использовании кислорода в качестве конечного акцептора водорода в дыхательной цепи. В качестве доноров водорода выступают восстановленные формы коферментов (НАДН, ФАДН2 и НАДФН), образующиеся в промежуточных реакциях окисления субстратов.
Аэробное дихотомическое окисление глюкозы является основным путём катаболизма глюкозы в организме человека и может происходить во всех органах и тканях. В результате этих реакций глюкоза расщепляется до СО2 и Н2О, а выделяющаяся энергия аккумулируется в АТФ.
1. Аэробный путь окисления глюкозы и его энергетика.
Аэробный путь окисления глюкозы происходит в 3 этапа:
1. окисление молекулы глюкозы до 2 молекул пирувата;
2. окислительное декарбоксилирование пирувата (с образованием 2 молекул ацетил-КоА);
3. реакции цикла Кребса, где каждая молекула ацетил-КоА сгорает с образованием 12 АТФ.
1-ый этап. Окисление молекулы глюкозы до 2 молекул пирувата - это первые 10 реакций гликолиза. Суммарная реакция 1 этапа: Глюкоза + 2 НАД+ + 2 АДФ ^ 2 пирувата + 2 НАДН + Н+ + 2 АТФ
2-ой этап. Окислительное декарбоксилирование пирувата (с образованием 2 молекул ацетил-КоА) происходит в матриксе митохондрий и осуществляется мультиферментным комплексом пируватдегидрогеназой. В его состав входят 3 фермента и 5 коферментов:
1. Пируватдекарбоксилаза - кофермент тиаминпирофосфат (активная форма витамина В1).
2. Дегидролипоилацетилтрансфераза - кофермента: в активном центре - липоевая кислота (витаминоподобное вещество), из матрикса митохондрий используется Коэнзим А (КоА~8Н).
3. Дигидролипоилдегидрогеназа - коферменты: в активном центре - ФАД, из матрикса митохондрий используется - НАД.
Суммарная реакция: 2 Пируват + 2 НАД+ + КоА ^ 2 ацетил-КоА + 2 НАДН + Н+
Каждый восстановленный НАД в митохондриях отдает протоны и электроны в полную ц.п.э., где образуется 2 х 3 АТФ = 6 АТФ. Таким образом, ценность второго этапа - 6 АТФ. Эти реакции происходят только в аэробных условиях!
3-ий этап. Реакции цикла Кребса, где каждая молекула ацетил-КоА сгорает с образованием 12 АТФ. Следовательно, энергетический выход третьего этапа (в расчете на молекулу глюкозы) - 2 х 12 АТФ = 24 АТФ
2. Челночные механизмы переноса НАДН из цитозоля в матрикс митохондрий.
Образующийся в ходе аэробного окисления каждый НАДН отдает протоны и электроны в митохондриальную цепь переноса электронов с помощью челночных механизмов (см. наглядный материал): малат-аспартатного. В случае малат-аспартатного челнока митохондриальным акцептором протонов и электронов является НАД+. При работе малат-аспартатного челнока в результате реакций окислительного фосфорилирования, сопряженного с цепью переноса электронов, образуется 3 АТФ (в полной ц.п.э.) . Следовательно, в результате первого этапа окисления глюкозы образуется 2 АТФ (7-ая и 10-ая реакции гликолиза -субстратное фосфорилирование) + 2 х [3 (или 2)] АТФ при окислении каждого НАДН в ц.п.э. = 8 (или 6) АТФ.

3. Энергетическая ценность аэробного окисления глюкозы:
1 этап - 8 (6) АТФ
2 этап - 6 АТФ
3 этап - 24 АТФ Итого: 38 (36) АТФ
(разница в 2 АТФ зависит от челнока, который переносит протоны и электроны из цитозоля от НАДН, образованного в 6-ой реакции гликолиза в митохондрии в ц.п.э.).
Аэробное окисление глюкозы является главным источником энергии для большинства клеток организма.
22
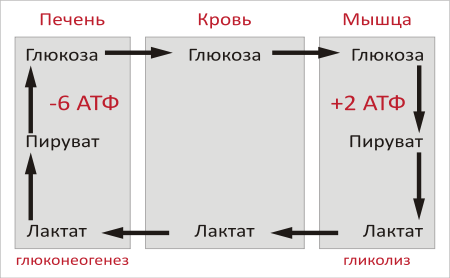
Глюкозо-лактатный цикл (цикл Кори) – это циклический процесс, объединяющий реакции глюконеогенеза и реакции анаэробного гликолиза. Глюконеогенез происходит в печени, субстратом для синтеза глюкозы является лактат, поступающий в основном из эритроцитов или мышечной ткани. В эритроцитах молочная кислота образуется непрерывно, так как для них анаэробный гликолиз является единственным способом образования энергии. В скелетных мышцах высокое накопление молочной кислоты (лактата) является следствием гликолиза при интенсивной работе. Убрать молочную кислоту можно только одним способом – превратить ее в пировиноградную кислоту. Клеточная мембрана высоко проницаема для лактата и он движется по градиенту концентрации наружу, малая часть молочной кислоты выводится с мочой, большая часть лактата крови захватывается гепатоцитами, окисляется в пировиноградную кислоту и вступает на путь глюконеогенеза. Глюкоза, образованная в печени используется самим гепатоцитом или возвращается обратно в мышцы, восстанавливая во время отдыха запасы гликогена.

23.
Регуляторный «эффект Пастера» - торможение гликолиза дыханием - объясняется энергозависимой конкуренцией за АДФ и фосфат между системами фосфорилирования в дыхательной цепи(окислительное фосфорилирование) и на уровне субстрата(субстратное фосфорилирование). Хорошо известно, что факультативно анаэробные клетки, растущие в анаэробных условиях, потребляют сравнительно очень большие количества глюкозы (и образуют большие количества продуктов брожения). Если же ввести в среду кислород, то клетки начнут немедленно его поглощать и уровень потребления глюкозы резко снизится. Это снижение скорости гликолитического расщепления глюкозы с началом дыхания и носит название эффекта Пастера.
Эффект Пастера обусловлен подавлением активности фермента фосфофруктокиназы, который катализирует реакцию, лимитирующую общую скорость гликолиза, а именно фосфорилирование фруктозо-6-фосфата с образованием фруктозо-1,6-дифосфата. Фосфофруктокиназа представляет собой поливалентно регулируемый аллостерический фермент, который активируется АДФ и подавляется АТФ и цитратом. Знание аллостерических свойств фосфофруктокиназы позволяет сделать следующий вывод: если аэробно растущие дрожжевые клетки лишить кислорода и приостановить таким образом окислительное фосфорилирование, то в клетке снизится соотношение концентраций АТФ/АМФ, что приведет к повышению активности фермента и соответственно к ускорению реакции. Таким образом, снижение активности фосфофруктокиназы связано с ускорением образования АТФ и началом функционирования ЦТК при переходе к аэробному окислению глюкозы.
Регуляторный «эффект Кребтри» - торможение дыхания гликолизом - явление, обратное «эффекту Пастера», также объясняется энергозависимыми конкурентными взаимоотношениями систем окислительного и субстратного фосфорилирования за АДФ и фосфат. Одна из точек зрения состоит в том, что эффект Кребтри обусловлен активацией гликолиза высокими концентрациями глюкозы, что приводит к избытку продуктов гликолиза, которые, главным образом в виде ацетата, экскретируются в среду. Другая точка зрения заключается в том, что
можно моделировать, применяя довольно низкие (миллимолярные) концентрации глюкозы, регистрируя при этом явление «дыхательного контроля» у бактерий. Обе точки зрения сходятся в одном - в основе механизма эффекта Кребтри лежит регуляторная способность факультативных анаэробов модулировать в широких пределах поток через гликолиз, чтобы компенсировать при необходимости нефункционирующий ЦТК усилением субстратного фосфорилирования и по той же причине иметь механизм сброса избытка продуктов гликолиза при анаэробиозе.
24.
Открытие пути прямого окисления углеводов, или, как его называют,пентозофосфатного цикла, принадлежит О. Варбургу, Ф. Липману, Ф. Дикенсу и В.А. Энгельгарду. Расхождение путей окисления углеводов – классического (цикл трикарбоновых кислот, или цикл Кребса) и пентозофосфатного – начинается со стадии образования гексозомонофосфата. Если глюкозо-6-фосфат изомеризуется во фруктозо-6-фосфат, который фосфорилируется второй раз и превращается во фруктозо-1,6-бисфосфат, то в этом случае дальнейший распад углеводов происходит по обычному гликолитическому пути с образованием пировиноградной кислоты, которая, окисляясь до ацетил-КоА, затем «сгорает» в цикле Кребса.
Если второго фосфорилирования гексозо-6-монофосфата не происходит, то фосфорилированная глюкоза может подвергаться прямому окислению до фосфопентоз. В норме доля пентозофосфатного пути в количественном превращении глюкозы обычно невелика, варьирует у разных организмов и зависит от типа ткани и ее функционального состояния.
У млекопитающих активность пентозофосфатного цикла относительно высока впечени, надпочечниках, эмбриональной ткани и молочной железе в период лактации. Значение этого пути в обмене веществ велико. Он поставляет восстановленный НАДФН, необходимый для биосинтеза жирных кислот,холестерина и т.д. За счет пентозофосфатного цикла примерно на 50% покрывается потребность организма в НАДФН.
Другая функция пентозофосфатного цикла заключается в том, что он поставляет пентозофосфаты для синтеза нуклеиновых кислот и многихкоферментов. При ряде патологических состояний удельный вес пенто-зофосфатного пути окисления глюкозы возрастает. Механизм реакцийпентозофосфатного цикла достаточно расшифрован.

Пентозофосфатный цикл начинается с окисления глюкозо-6-фосфата и последующего окислительногодекарбоксилирования продукта (в результате от гексозофосфата отщепляется первый атом углерода). Это первая, так называемая окислительная, стадия пентозофосфатного цикла. Вторая стадия включает неокислительные превращения пентозофосфатов с образованием исходного глюкозо-6-фосфата (рис. 10.12). Реакции пен-тозофосфатного цикла протекают в цитозоле клетки.
Первая реакция – дегидрирование глюкозо-6-фосфата при участии фермента глюкозо-6-фосфатдегидрогеназы икофермента НАДФ+. Образовавшийся в ходе реакции 6-фосфоглюконо-δ-лактон – соединение нестабильное и с большой скоростью гидролизуется либо спонтанно, либо с помощью фермента 6-фосфоглюконолактоназы с образованием 6-фос-фоглюконовой кислоты (6-фосфоглюконат):
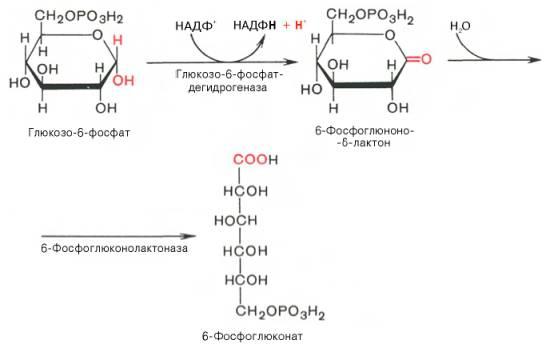
Во второй – окислительной – реакции, катализируемой 6-фосфоглюко-натдегидрогеназой (декарбоксилирующей), 6-фосфоглюконат дегидрируется и декарбоксилируется. В результате образуется фосфорилированная кетопентоза – D-рибулозо-5-фосфат и еще 1 молекула НАДФН:

Под действием соответствующей эпимеразы из рибулозо-5-фосфата может образоваться другая фосфопентоза – ксилулозо-5-фосфат. Кроме того, рибулозо-5-фосфат под влиянием особой изомеразы легко превращается в рибозо-5-фосфат. Между этими формами пентозофосфатов устанавливается состояние подвижного равновесия:

При определенных условиях пентозофосфатный путь на этом этапе может быть завершен. Однако при других условиях наступает так называемый неокислительный этап (стадия) пентозофосфатного цикла. Реакции этого этапа не связаны с использованием кислорода и протекают в анаэробных условиях. При этом образуются вещества, характерные для первой стадии гликолиза (фруктозо-6-фосфат, фруктозо-1,6-бисфосфат, фосфотрио-зы), а другие – специфические для пентозофосфатного пути (седогептулозо-7-фосфат, пентозо-5-фосфаты, эритрозо-4-фосфат).
Основными реакциями неокислительной стадии пентозофосфатного цикла являются транскетолазная и трансальдолазная. Эти реакции катализируют превращение изомерных пентозо-5-фосфатов:

Коферментом в транскетолазной реакции служит ТПФ, играющий роль промежуточного переносчика гликольальдегидной группы от ксилулозо-5-фосфата к рибозо-5-фосфату. В результате образуется семиуглеродныймоносахарид седогептулозо-7-фосфат и глицеральдегид-3-фосфат.
Транскетолазная реакция в пентозном цикле встречается дважды, второй раз – при образовании фруктозо-6-фосфата и триозофосфата в результате взаимодействия второй молекулы ксилулозо-5-фосфата с эритрозо-4-фосфатом:

Фермент трансальдолаза катализирует перенос остатка диоксиацетона (но не свободного диоксиацетона) от седогептулозо-7-фосфата на гли-церальдегид-3-фосфат:
 Шесть молекул глюкозо-6-фосфата,
вступая в пентозофосфатный
цикл,
образуют 6 молекул рибулозо-5-фосфата
и 6молекул СО2,
после чего из 6 молекул рибулозо-5-фосфата
снова регенерируется 5 молекул глюко-зо-6-фосфата
(см. рис. 10.12). Однако это не означает,
что молекула глюкозо-6-фосфата,
вступающая в цикл, полностью окисляется.
Все 6 молекул СО2 образуются
из С-1-атомов 6 молекул глюкозо-6-фосфата.
Шесть молекул глюкозо-6-фосфата,
вступая в пентозофосфатный
цикл,
образуют 6 молекул рибулозо-5-фосфата
и 6молекул СО2,
после чего из 6 молекул рибулозо-5-фосфата
снова регенерируется 5 молекул глюко-зо-6-фосфата
(см. рис. 10.12). Однако это не означает,
что молекула глюкозо-6-фосфата,
вступающая в цикл, полностью окисляется.
Все 6 молекул СО2 образуются
из С-1-атомов 6 молекул глюкозо-6-фосфата.
Валовое уравнение окислительной и неокислительной стадий пенто-зофосфатного цикла можно представить в следующем виде:
![]() или
или
![]()
Образовавшийся НАДФН используется в цитозоле на восстановительные синтезы и, как правило, не участвует в окислительном фосфори-лировании, протекающем в митохондриях.
В последние годы появились работы, которые дают основание предполагать, что в некоторых тканях схема пентозофосфатного превращения углеводов сложнее, чем это представлено на рис. 10.12. Согласно этой более полной схеме пентозофосфатного пути, первые этапы превращения совпадают с прежней схемой, однако после первой транскетолазной реакции начинаются некоторые отклонения (рис. 10.13).
Считают, что пентозофосфатный путь и гликолиз, протекающие в цитозоле, взаимосвязаны и способны переключаться друг на друга в зависимости от соотношения концентраций промежуточных продуктов, образовавшихся в клетке
Биологическая роль Как отмечалось выше, пентозофосфатный путь имеется у животных, растений и микроорганизмов. У всех клеток этот путь служит для образования восстановленного NADPH, который используется как донор водорода в реакциях восстановления и гидроксилирования[en], а также обеспечивает клетки рибозо-5-фосфатом[13]. Хотя NADPH образуется также при окислении малата до пирувата и углекислого газа, а также при дегидрировании изоцитрата, в большинстве случаев потребности клеток в восстановительных эквивалентах удовлетворяются именно за счёт пентозофосфатного пути[3]. Впрочем, в некоторых случаях образование рибозо-5-фосфата является единственным назначением пентозофосфатного пути[4]. Рибозо-5-фосфат служит предшественником 5-фосфорибозил-1-пирофосфата (PRPP), который участвует в биосинтезе нуклеотидов и нуклеиновых кислот, аминокислот гистидина и триптофана. Другой интермедиат пентозофосфатного пути, эритрозо-4-фосфат, конденсируясь сфосфоенолпируватом, даёт начало общей части пути биосинтеза триптофана, фенилаланина и тирозина[14].
Пентозофосфатный путь может функционировать в печени, жировой ткани, молочной железе при лактации, семенниках[3], коре надпочечников, эритроцитах. В этих тканях и органах активно протекают реакции гидроксилирования и восстановления, например, при синтезе жирных кислот[en], холестерола, обезвреживания ксенобиотиков в печени и активных форм кислорода в эритроцитах и других тканях, поэтому у них велика потребность в восстановительных эквивалентах, в том числе,
25.

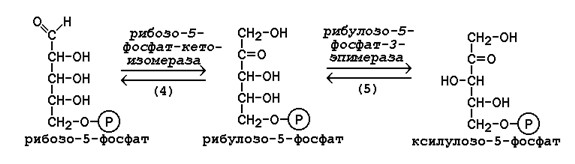
![]()
![]()
Посредством пентозофосфатного пути может происходить полное окисление глюкозо-6-фосфата до шести молекул СО2. Все эти молекулы образуются из С-1-атомов шести молекул глюкозо-6-фосфата, а из образовавшихся при этом шести молекул рибулозо-5-фосфата снова регенерируются пять молекул глюкозо-6-фосфата:

![]()
Таким образом, полное окисление 1 молекулы глюкозы в пентозофосфатном пути сопровождается восстановлением 12 молекул НАДФ.
ПФП называют шунтом из-за его связи с гликолизом. В процессе ПФП образуется фруктозо-6 фосфат и глицеральдегид -3-фосфат , которые могут использоваться в качестве субстратов гликолиза.\
26. Метаболизм фруктозы и галактозы.
Метаболизм фруктозы и галактозы включает пути использования их для синтеза других веществ (гетерополисахаридов, лактозы и др.) и участие в энергообеспечении организма. В последнем случае фруктоза и галактоза превращаются в печени либо в глюкозу, либо в промежуточные продукты её метаболизма. Таким образом, в результате фруктоза и галактоза наряду с глюкозой могут быть окислены до СО2 и Н2О или использованы на синтез гликогена и триацилглицеролов.
Значительное количество фруктозы, образующееся при расщеплении сахарозы, прежде чем поступить в систему воротной вены, превращается в глюкозу уже в клетках кишечника. Другая часть фруктозы всасывается с помощью белка-переносчика, т.е. путём облегчённой диффузии.

Значительное количество фруктозы, образующееся при расщеплении сахарозы, прежде чем поступить в систему воротной вены, превращается в глюкозу уже в клетках кишечника. Другая часть фруктозы всасывается с помощью белка-переносчика, т.е. путём облегчённой диффузии.
Галактоза образуется в кишечнике в результате гидролиза лактозы. Чтобы превратить галактозу в глюкозу, необходимо изменить оптическую конфигурацию Н- и ОН-групп С4 атома в галактозе, т.е. провести реакцию эпимеризации. Эта реакция в клетке возможна только с УДФ-произ-водным галактозы. УДФ-галактоза образуется из УДФ-глюкозы (метаболит в синтезе гликогена) в ходе реакции, катализируемой уридилфосфат-4-эпимеразой


|
заболевание |
Дефектный фермент |
Нарушение метаболического процесса |
уравнение |
|
Непереносимость лактозы |
лактаза |
Нарушение усвоения лактозы |
Лактоза=глюкоза+галактоза |
|
Эссенциальная фруктозурия |
фруктокиназа |
Фруктоза не участвует в углеводном обмене, а накапливается в моче |
Фруктоза+АТФ=фруктозо-1-фосфат+ АДФ |
|
Непереносимость фруктозы |
Фруктозофосфат альдолаза |
Не усваивается фруктоза |
Фруктозо-1-фосфат= диоксиацетонфосфат + глицеральдегид |
|
галактоземия |
Галактоза-1-фосфат УДФ |
Накопление галактоза-1-фосфата |
Галл.-1-ф+ УДФ-глюкоза =глюкоза-1 фосфат + УДФ-галактоза |
29
Биологические мембраны – сложные надмолекулярные структуры, окружающие все живые клетки и образующие в них замкнутые, специализированные компартменты – органеллы.
Плазматическая мембрана – ограничивает содержимое клетки от внешней среды; осуществляет контакт с другими клетками, получение, обработку и передачу информации внутрь клетки, поддержание постоянства внутренней среды.
Ядерные мембраны (внешняя и внутренняя) – образуют ядерную оболочку, которая отделяет хромосомный материал от цитоплазматических органелл; через поры ядерной оболочки происходит транспорт белков и нуклеиновых кислот в ядро и из ядра.
Митохондриальные мембраны – осуществляют преобразование энергии в ходе окислительного фосфорилирования, синтез АТФ.
Лизосомальные мембраны – ограничивают гидролитические ферменты от цитоплазмы клетки, препятствуют самоперевариванию (аутолизу) клеток, способствуют поддержанию постоянства рН среды в лизосомах.
Мембраны эндоплазматического ретикулума – принимают участие в образовании новых мембран, осуществляют синтез белков, липидов, полисахаридов, окисление гидрофобных метаболитов и ксенобиотиков.
Все мембраны по своей организации и составу обнаруживают ряд общих свойств. Они:
-
состоят из липидов, белков и углеводов;
-
являются плоскими замкнутыми структурами;
-
имеют внутреннюю и внешнюю поверхности (асимметричны);
-
избирательно проницаемы.
-
Основу мембраны составляет липидный бислой – двойной слой молекул липидов, которые обладают свойствомамфифильности (содержат как гидрофильные, так и гидрофобные функциональные группы). В липидном бислое гидрофобные участки молекул взаимодействуют между собой, а гидрофильные участки обращены в окружающую водную среду.
-
Мембранные липиды выполняют роль растворителя мембранных белков, создавая жидкую среду, в которой они могут функционировать. По степени влияния на структуру бислоя и по силе взаимодействия с ним мембранные белки делят на интегральные и периферические
Характеристика мембранных белков
|
Интегральные белки |
Периферические белки |
|
Глубоко внедрены в мембранную структуру и не могут быть удалены из мембраны без её разрушения. |
Локализованы на поверхности бислоя и экстрагируются растворами солей или просто водой. |
|
Амфифильные глобулярные структуры, центральная погружённая часть – гидрофобна, концевые участки – гидрофильны. |
Глобулярные гидрофильные структуры. |
|
Удерживаются в липидном бислое за счёт гидрофобных взаимодействий с углеводородными цепочками жирных кислот. |
Удерживаются на поверхности бислоя за счёт ионных взаимодействий с полярными участками фосфолипидов и интегральных белков. |
По выполняемым функциям белки в составе мембран делятся на
-
структурные;
-
каталитические;
-
рецепторные;
-
транспортные.
Количество белков в мембранах могут существенно отличаться. Например, в миелиновой мембране, предназначенной для изоляции нервных волокон, белки составляют только 25% массы мембраны, а в мембранах митохондрий, связанных с процессами окислительного фосфорилирования, на долю белков приходится около 75% массы. В плазматической мембране доля белков и липидов примерно одинаковы.
Углеводы в составе мембран не представлены самостоятельными соединениями, а обнаруживаются только в соединении с белками (гликопротеины) или липидами (гликолипиды). Длина углеводных цепей колеблется от двух до восемнадцати остатков моносахаридов. Большая часть углеводов расположена на наружной поверхности плазматической мембраны. Функции углеводов в биомембранах – контроль за межклеточными взаимодействиями, поддержание иммунного статуса, рецепция, обеспечение стабильности белковых молекул в мембране.
Большинство липидов в мембранах млекопитающих представлены фосфолипидами, гликосфинголипидами и холестеролом.
Фосфолипиды в составе мембран подразделяются на две группы: глицерофосфолипиды и сфингомиелины.
Глицерофосфолипиды – представляют собой сложные эфиры трёхатомного спирта глицерола, двух остатков жирных кислот и фосфорилированного аминоспирта..
Наиболее распространённым глицерофосфолипидом мембран является фосфатидилхолин:
Сфингофосфолипиды (сфингомиелины) являются производными аминоспирта сфингозинаСоединение сфингозина и жирной кислоты получило название церамид. Гликолипиды также являются производными церамида, содержащими один или несколько остатков моносахаридов. Например, цереброзиды содержат в первом положении остаток глюкозы или галактозы,а ганглиозиды содержат цепочку из нескольких остатков сахаров, одним из которых обязательно является сиаловая кислота.
Холестерол – одноатомный циклический спирт. Это один из главных компонентов плазматической мембраны клеток млекопитающих, в меньшем количестве может присутствовать также в митохондриях, мембранах комплекса Гольджи, ядерных мембранах. Особенно много его в нервной ткани.
характерной особенностью мембранных липидов является их амфифильность – наличие в молекуле одновременно гидрофобных и гидрофильных участков. Гидрофобная часть молекулы представлена остатками жирных кислот и боковой цепью сфингозина.
Гидрофильные участки представлены в фосфолипидах фосфорилированным спиртом, а в гликолипидах – остатками сахаров. Амфифильность холестерола выражена слабо – циклическая структура и боковой радикал гидрофобны, и только гидроксильная группа гидрофильна.
Амфифильность мембранных липидов определяет характер их поведения в водной среде. Слипание гидрофобных участков молекул приводит к образованию упорядоченных замкнутых структур – мицелл, в которых гидрофобные области защищены от воды, а гидрофильные обращены в водную среду.
Молекулы холестерола встраиваются между радикалами жирных кислот гидрофобной части бислоя, а его гидроксильная группа примыкает к гидрофильным головкам фосфолипидов. Такая структура, стабилизированная нековалентными гидрофобными взаимодействиями, термодинамически очень устойчива и лежит в основе формирования биологических мембран.
Замкнутый липидный бислой определяет основные свойства мембран:
1) текучесть – зависит от соотношения насыщенных и ненасыщенных жирных кислот в составе мембранных липидов. Гидрофобные цепочки насыщенных жирных кислот ориентированы параллельно друг другу и образуют жёсткую кристаллическую структуру). Ненасыщенные жирные кислоты, имеющие изогнутую углеводородную цепь, нарушают компактность упаковки и придают мембране бóльшую жидкостность Холестерол, встраиваясь между жирными кислотами, уплотняет их и повышает жёсткость мембран.
2) латеральная диффузия – свободное перемещение молекул относительно друг друга в плоскости мембран
3) ограниченная способность к поперечной диффузии (переходу молекул из наружного слоя во внутренний и наоборот,что способствует сохранению асимметрии – структурно-функциональных различий наружного и внутреннего слоёв мембраны.
4) непроницаемость замкнутого бислоя для большинства водорастворимых молекул
. Одна из главных функций мембран – участие в переносе веществ. Этот процесс обеспечивается при помощи трёх основных механизмов: простой диффузией, облегчённой диффузией и активным транспортом
Механизмы транспорта молекул через мембрану
Простая диффузия - перенос веществ через мембрану без участия специальных механизмов. Транспорт происходит по градиенту концентрации без затраты энергии. Путём простой диффузии транспортируются малые биомолекулы – Н2О, СО2, О2, мочевина, гидрофобные низкомолекулярные вещества. Скорость простой диффузии пропорциональна градиенту концентрации.
Облегчённая диффузия - перенос веществ через мембрану при помощи белковых каналов или специальных белков-переносчиков. Осуществляется по градиенту концентрации без затраты энергии. Транспортируются моносахариды, аминокислоты, нуклеотиды, глицерол, некоторые ионы. Характерна кинетика насыщения – при определённой (насыщающей) концентрации переносимого вещества в переносе принимают участие все молекулы переносчика и скорость транспорта достигает предельной величины.
Активный транспорт – также требует участия специальных белков-переносчиков, но перенос происходит против градиента концентрации и поэтому требует затраты энергии. При помощи этого механизма через клеточную мембрану транспортируются ионы Na+, K+, Ca2+, Mg2+, через митохондриальную – протоны. Для активного транспорта веществ характерна кинетика насыщения.
Примером транспортной системы, осуществляющей активный транспорт ионов, является Na+,K+-аденозинтрифосфатаза (Na+,K+-АТФаза или Na+,K+-насос). Этот белок находится в толще плазматической мембраны и способен катализировать реакцию гидролиза АТФ. Энергия, выделяемая при гидролизе 1 молекулы АТФ, используется для переноса 3 ионов Na+ из клетки во внеклеточное пространство и 2 ионов К+ в обратном направлении В результате действия Na+,K+-АТФазы создаётся разность концентраций между цитозолем клетки и внеклеточной жидкостью. Поскольку перенос ионов неэквивалентен, то возникает разность электрических потенциалов. Таким образом, возникает электрохимический потенциал, который складывается из энергии разности электрических потенциалов Δφ и энергии разности концентраций веществ ΔС по обе стороны мембраны.
Перенос через мембраны частиц и высокомолекулярных соединений
Наряду с транспортом органических веществ и ионов, осуществляемым переносчиками, в клетке существует совершенно особый механизм, предназначенный для поглощения клеткой и выведения из неё высокомолекулярных соединений при помощи изменения формы биомембраны. Такой механизм называют везикулярным транспортом.
При переносе макромолекул происходит последовательное образование и слияние окружённых мембраной пузырьков (везикул). По направлению транспорта и характеру переносимых веществ различают следующие типы везикулярного транспорта:
Эндоцитоз — перенос веществ в клетку. В зависимости от размера образующихся везикул различают:
а) пиноцитоз — поглощение жидкости и растворённых макромолекул (белков, полисахаридов, нуклеиновых кислот) с помощью небольших пузырьков (150 нм в диаметре);
б) фагоцитоз — поглощение крупных частиц, таких, как микроорганизмы или обломки клеток. В этом случае образуются крупные пузырьки, называемые фагосомами диаметром более 250 нм.
Пиноцитоз характерен для большинства эукариотических клеток, в то время как крупные частицы поглощаются специализированными клетками - лейкоцитами и макрофагами. На первой стадии эндоцитоза вещества или частицы адсорбируются на поверхности мембраны, этот процесс происходит без затраты энергии. На следующей стадии мембрана с адсорбированным веществом углубляется в цитоплазму; образовавшиеся локальные впячивания плазматической мембраны отшнуровываются от поверхности клетки, образуя пузырьки, которые затем мигрируют внутрь клетки. Этот процесс связан системой микрофиламентов и является энергозависимым. Поступившие в клетку пузырьки и фагосомы могут сливаться с лизосомами. Содержащиеся в лизосомах ферменты расщепляют вещества, содержащиеся в пузырьках и фагосомах до низкомолекулярных продуктов (аминокислот, моносахаридов, нуклеотидов), которые транспортируются в цитозоль, где они могут быть использованы клеткой.
Экзоцитоз — перенос частиц и крупных соединений из клетки. Этот процесс, как и эндоцитоз, протекает с поглощением энергии. Основными разновидностями экзоцитоза являются:
а) секреция - выведение из клетки водорастворимых соединений, которые используются или воздействуют на другие клетки организма. Может осуществляться как неспециализированными клетками, так и клетками эндокринных желёз, слизистой желудочно-кишечного тракта, приспособленными для секреции производимых ими веществ (гормонов, нейромедиаторов, проферментов) в зависимости от определённых потребностей организма.
Секретируемые белки синтезируются на рибосомах, связанных с мембранами шероховатого эндоплазматического ретикулума. Затем эти белки транспортируются к аппарату Гольджи, где они модифицируются, концентрируются, сортируются, и затем упаковываются в пузырьки, которые отщепляются в цитозоль и в дальнейшем сливаются с плазматической мембраной, так что содержимое пузырьков оказывается вне клетки.
В отличие от макромолекул, секретируемые частицы малых размеров, например, протоны, транспортируются из клетки при помощи механизмов облегчённой диффузии и активного транспорта.
б) экскреция - удаление из клетки веществ, которые не могут быть использованы (например, удаление в ходе эритропоэза из ретикулоцитов сетчатой субстанции, представляющей собой агрегированные остатки органелл). Механизм экскреции, по-видимому, состоит в том, что вначале выделяемые частицы оказываются в цитоплазматическом пузырьке, который затем сливается с плазматической мембраной.
30
Расщепление жиров в желудочно-кишечном тракте. Слюна не содержит расщепляющих жиры ферментов. Следовательно, в полости рта жиры не подвергаются никаким изменениям. У взрослых людей жиры проходят через желудок также без особых изменений, поскольку содержащаяся в небольшом количестве в желудочном соке взрослого человека и млекопитающих липаза малоактивна. Величина pH желудочного сока около 1,5, а оптимальное значение pH для желудочной липазы находится в пределах 5,5-7,5. Кроме того, липаза может активно гидролизовать только предварительно эмульгированные жиры, в желудке же отсутствуют условия для эмульгирования жиров.
Переваривание жиров в полости желудка играет важную роль в процессе пищеварения у детей, особенно грудного возраста. Известно, что pH желудочного сока у детей грудного возраста около 5,0, что способствует перевариванию эмульгированного жира молока желудочной липазой. К тому же есть основания полагать, что при длительном употреблении молока в качестве основного продукта питания у детей грудного возраста наблюдается адаптивное усиление синтеза желудочной липазы.
Хотя в желудке взрослого человека не происходит заметного переваривания жиров пищи, все же в желудке отмечается частичное разрушение липопротеидных комплексов мембран клеток пищи, что делает жиры более доступными для последующего воздействия на них липазы панкреатического сока. Кроме того, незначительное расщепление жиров в желудке приводит к появлению свободных жирных кислот, которые, поступая в кишечник, способствуют эмульгированию там жиров.
Расщепление жиров, входящих в состав пищи, происходит у человека и млекопитающих преимущественно в верхних отделах тонкого кишечника, где имеются весьма благоприятные условия для эмульгирования жиров.
После того как химус попадает в двенадцатиперстную кишку, здесь прежде всего происходит нейтрализация соляной кислоты желудочного сока, попавшей в кишечник с пищей, бикарбонатами, содержащимися в панкреатическом и кишечном соках. Выделяющиеся при разложении бикарбонатов пузырьки углекислого газа способствуют хорошему перемешиванию пищевой кашицы с пищеварительными соками. Одновременно начинается эмульгирование жира. Наиболее мощное эмульгирующее действие на жиры, несомненно, оказывают соли желчных кислот, попадающие в двенадцатиперстную кишку с желчью в виде натриевых солей, большая часть которых конъюгирована с глицином или таурином. Желчные кислоты представляют собой основной конечный продукт обмена холестерина.
Главные стадии образования из холестерина желчных кислот, в частности холевой кислоты, можно представить в следующем виде. Процесс начинается с гидроксилирования холестерина в 7-м α-положении, т. е. с включения гидроксильной группы в положении 7 и образования 7-гидроксихолестерина. Затем через ряд стадий образуется 3,7,12-тригидроксикопростановая кислота, боковая цепь которой подвергается β-окислению. В завершающей стадии отделяется пропионовая кислота (в виде пропионил-КоА) и боковая цепь укорачивается. Во всех этих реакциях принимает участие большое количество ферментов и коферментов печени.
По своей химической природе желчные кислоты являются производными холановой кислоты. В желчи человека в основном содержится холевая (3,7,12-триоксихолановая), дезоксихолевая (3,12-дигидроксихолано- и хенодеэоксихолевая (3,7-дигидроксихолановая) кислоты.
Кроме того, в желчи человека в малых (следовых) количествах содержится литохолевая (3-гидроксихолановая) кислота, а также аллохолевая и уреодезоксихолевая кислоты - стереоизомеры холевой и хенодезоксихолевой кислот.
Как уже отмечалось, желчные кислоты присутствуют в желчи в конъюгированной форме, т. е. в виде гликохолевой, гликодезоксихолевой, гликохенодезоксихолевой (около 2/3-4/3 всех желчных кислот) или таурохолевой, тауродезоксихолевой и таурохенодезоксихолевой (около 1/5-1/3 всех желчных кислот). Эти соединения иногда называют парными, так как они состоят из двух компонентов - из желчной кислоты и глицина или же желчной кислоты и таурина.
Заметим, что соотношения между конъюгатами этих двух видов могут меняться в зависимости от характера пищи: в случае преобладания в ней углеводов увеличивается относительнее содержание глициновых конъюгатов, а при высокобелковой диете - тауриновых конъюгатов. Строение этих конъюгатов может быть представлено в следующем виде:

Считается, что только комбинация: соль желчной кислоты + ненасыщенная жирная кислота + моноглицерид способна дать необходимую степень эмульгирования жира. Соли желчных кислот резко уменьшают поверхностное натяжение на поверхности раздела жир/вода, благодаря чему они не только облегчают эмульгирование, но и стабилизируют уже образовавшуюся эмульсию.
Желчные кислоты выполняют также важную роль в качестве своеобразного активатора панкреатической липазы1, под влиянием которой происходит расщепление жира в кишечнике. Вырабатываемая в поджелудочной железе липаза расщепляет триглицериды, находящиеся в эмульгированном состоянии. Считают, что активирующее влияние желчных кислот на липазу выражается в смещении оптимума действия данного фермента с pH 8,0 до 6,0, т. е. до той величины pH, которая более постоянно поддерживается в двенадцатиперстной кишке в ходе переваривания жирной пищи. Конкретный же механизм активации липазы желчными кислотами пока неясен.
1Однако существует мнение, что активация липазы происходит не под влиянием желчных кислот. В соке поджелудочной железы присутствует предшественник липазы, который активируется в просвете кишки путем образования комплекса с колипазой (кофактором) в молярном соотношении 2: 1. Это способствует сдвигу оптимума pH с 9,0 до 6,0 и предотвращению денатурации фермента. Установлено также, что на скорость катализируемого липазой гидролиза не оказывает существенного влияния ни степень ненасыщенности жирных кислот, ни длина углеводородной цепи (от С12 до С18). Ионы кальция ускоряют гидролиз главным образом потому, что они образуют нерастворимые мыла с освобождающимися жирными кислотами, т. е. практически сдвигают реакцию в направлении гидролиза.
Есть основания считать, что существует панкреатическая липаза двух типов: одна из них специфична в отношении эфирных связей в положениях 1 и 3 триглицерида, а другая - гидролизует связи в положении 2. Полный гидролиз триглицеридов происходит постадийно: сначала быстро гидролизуются связи 1 и 3, а потом уже медленно идет гидролиз 2-моноглицерида
Необходимо отметить, что в расщеплении жиров участвует также кишечная липаза, однако активность ее невысока. К тому, же эта липаза катализирует гидролитическое расщепление моноглицеридов и не действует на ди- и триглицериды. Таким образом, практически основными продуктами, образующимися в кишечнике при расщеплении пищевых жиров, являются жирные кислоты, моноглицериды и глицерин.
Всасывание жиров в кишечнике. Всасывание происходит в проксимальной части тонкого кишечника. Тонко эмульгированные жиры (величина жировых капелек эмульсии не должна превышать 0,5 мкм) частично могут всасываться через стенку кишечника без предварительного гидролиза. Однако основная часть жира всасывается лишь после расщепления его панкреатической липазой на жирные кислоты, моноглицериды и глицерин. Жирные кислоты с короткой углеродной цепью (менее 10 С-атомов) и глицерин, будучи хорошо растворимыми в воде, свободно всасываются в кишечнике и поступают в кровь воротной вены, оттуда - в печень, минуя какие-либо превращения в кишечной стенке. Сложнее дело обстоит с жирными кислотами с длинной углеродной цепью и моноглицеридами. Всасывание этих соединений происходит при участии желчи и главным образом желчных кислот, входящих в ее состав. В желчи соли желчных кислот, фосфолипиды и холестерин содержатся в соотношении 12,5:2,5:1,0. Жирные кислоты с длинной цепью и моноглицериды в просвете кишечника образуют с этими соединениями устойчивые в водной среде мицеллы (мицеллярный раствор). Структура этих мицелл такова, что их гидрофобное ядро (жирные кислоты, глицериды и др.) оказывается окруженным снаружи гидрофильной оболочкой из желчных кислот и фосфолипидов. Мицеллы примерно в 100 раз меньше самых мелких эмульгированных жировых капель. В составе мицелл высшие жирные кислоты и моноглицериды переносятся с места гидролиза жиров к всасывающей поверхности кишечного эпителия. Относительно механизма всасывания жировых мицелл единого мнения нет. Одни исследователи считают, что в результате так называемой мицеллярной диффузии, а возможно и пиноцитоза, мицеллы целой частицей проникают в эпителиальные клетки ворсинок. Здесь происходит распад жировых мицелл; при этом желчные кислоты сразу же поступают в ток крови и через систему воротной вены попадают в печень, откуда они вновь секретируются в составе желчи. Другие исследователи допускают возможность перехода в клетки ворсинок только липидного компонента жировых мицелл. А соли желчных кислот, выполнив свою физиологическую роль, остаются в просвете кишечника. И лишь потом в подавляющем большинстве они всасываются в кровь (в подвздошной кишке), попадают в печень и затем выделяются с желчью. Таким образом, и те и другие исследователи признают, что происходит постоянная циркуляция желчных кислот между печенью и кишечником. Этот процесс получил название печеночно-кишечной (энтерогепатической) циркуляции.
С помощью метода меченых атомов было показано, что в желчи содержится лишь небольшая часть желчных кислот (10-15% от общего количества), вновь синтезированных печенью, т. е. основная масса желчных кислот желчи (85-90%)- это желчные кислоты, реабсорбированные в кишечнике и повторно секретируемые в составе желчи. Установлено, что у человека общий пул желчных кислот - примерно 2,8-3,5 г; при этом они совершают 5-6 оборотов в сутки.
Ресинтез жиров в стенке кишечника. В стенке кишечника синтезируются жиры, в значительной степени специфичные для данного вида животного и отличающиеся по своей природе от пищевого жира. В известной мере это обеспечивается тем, что в синтезе триглицеридов (а также фосфолипидов) в кишечной стенке принимают участие наряду с экзогенными и эндогенные жирные кислоты. Однако способность к осуществлению в станке кишечника синтеза жира, специфичного для данного вида животного, все же ограничена. А. Н. Лебедевым показано, что при скармливании животному, особенно предварительно голодавшему, больших количеств чужеродного жира (например, льняного масла или верблюжьего жира) часть его обнаруживается в жировых тканях животного в неизмененном виде. Жировые депо скорее всего являются единственной тканью, где могут откладываться чужеродные жиры. Липиды, входящие в состав протоплазмы клеток других органов и тканей, отличаются высокой специфичностью, их состав и свойства мало зависят от пищевых жиров.
Механизм ресинтеза триглицеридов в клетках стенки кишечника в общих чертах сводится к следующему: первоначально из жирных кислот образуется их активная форма - ацил-КоА, после чего происходит ацилирование моноглицеридов с образованием сначала диглицеридов, а затем триглицеридов
Таким образом, в клетках кишечного эпителия высших животных моноглицериды, образующиеся в кишечнике при переваривании пищи, могут ацилироваться непосредственно, без промежуточных стадий.
Однако в эпителиальных клетках тонкого кишечника содержатся ферменты - моноглицеридлипаза, расщепляющая моноглицерид на глицерин и жирную кислоту, и глицеролкиназа, способная превращать глицерин (образовавшийся из моноглицерида или всосавшийся из кишечника) в глицерол-3-фосфат. Последний, взаимодействуя с активной формой жирной кислоты - ацил-КоА, дает фосфатидную кислоту, которая затем используется для ресинтеза триглицеридов и особенно глицерофосфолипидов (подробно см. ниже).
Переваривание и всасывание глицерофосфолипидов и холестерина. Вводимые с пищей глицерофосфолипиды подвергаются в кишечнике воздействию специфических гидролитических ферментов, разрывающих эфирные связи между компонентами, входящими в состав фосфолипидов. Принято считать, что в пищеварительном тракте распад глицерофосфолипидов происходит при участии фосфолипаз, выделяемых с панкреатическим соком. Ниже приведена схема гидролитического расщепления фосфатидилхолина:
Различают несколько типов фосфолипаз.
-
Фосфолипаза A1 гидролизует эфирную связь в положении 1 глицерофосфолипида, в результате чего отщепляется одна молекула жирной кислоты и, например, при расщеплении фосфатидилхолина образуется 2-ацилглицерилфосфорилхолин.
-
Фосфолипаза А2, ранее называемая просто фосфолипазой А, катализирует гидролитическое отщепление жирной кислоты в положении 2 глицерофосфолипида. Образующиеся при этом продукты носят название лизофосфатидилхолина и лизофосфатидилэтаноламина. Они токсичны и вызывают разрушение мембран клеток. Высокая активность фосфолипазы А2 в яде змей (кобра и др.) и скорпионов приводит к тому, что при их укусе гемолизируются эритроциты.
Фосфолипаза А2 поджелудочной железы поступает в полость тонкого кишечника в неактивной форме и только после воздействия трипсина, приводящего к отщеплению от нее гептапептида, приобретает активность. Накопление лизофосфолипидов в кишечнике может быть устранено, если одновременно на глицерофосфолипиды действуют обе фосфолипазы: А1 и А2. В результате образуется нетоксичный для организма продукт (например, при расщеплении фосфотидилхолина - глицерилфосфорилхолин).
-
Фосфолипаза С вызывает гидролиз связи между фосфорной кислотой и глицерином, а фосфолипаза D расщепляет эфирную связь между азотистым основанием и фосфорной кислотой с образованием свободного основания и фосфатидной кислоты.
Итак, в результате действия фосфолипаз глицерофосфолипиды расщепляются с образованием глицерина, высших жирных кислот, азотистого основания и фосфорной кислоты.
Необходимо отметить, что подобный механизм расщепления глицерофосфолипидов существует и в тканях организма; катализируется этот процесс тканевыми фосфолипазами. Заметим, что последовательность реакций расщепления глицерофосфолипидов на отдельные компоненты еще неизвестна.
Механизм всасывания высших жирных кислот и глицерина нами был уже рассмотрен. Фосфорная кислота всасывается кишечной стенкой главным образом в виде натриевых или калиевых солей. Азотистые основания (холин и этаноламин) всасываются в виде своих активных форм .
Как уже отмечалось, в кишечной стенке происходит ресинтез глицерофосфолипидов. Необходимые компоненты для синтеза: высшие жирные кислоты, глицерин, фосфорная кислота, органические азотистые основания (холин или этаноламин) поступают в эпителиальную клетку при всасывании из полости кишечника, поскольку они образуются при гидролизе пищевых жиров и липидов; частично эти компоненты доставляются в эпителиальные клетки кишечника с током крови из других тканей. Ресинтез глицерофосфолипидов идет через стадию образования фосфатидной кислоты.
Что касается холестерина, то он попадает в пищеварительные органы человека преимущественно с яичным желтком, мясом, печенью, мозгом. В организм взрослого человека ежедневно поступает 0,1-0,3 г холестерина, содержащегося в пищевых продуктах либо в виде свободного холестерина, либо в виде его эфиров (холестеридов). Эфиры холестерина расщепляются на холестерин и жирные кислоты при участии особого фермента панкреатического и кишечного соков - холестеролэстеразы. Нерастворимый в воде холестерин, подобно жирным кислотам, всасывается в кишечнике лишь в присутствии желчных кислот.
Образование хиломикронов и транспорт липидов. Ресинтезированные в эпителиальных клетках кишечника триглицериды и фосфолипиды, а также поступивший в эти клетки из полости кишечника холестерин (здесь он может частично этерифицироваться) соединяются с небольшим количеством белка и образуют относительно стабильные комплексные частицы - хиломикроны (ХМ). Последние содержат около 2% белка, 7% фосфолипидов, 8% холестерина и его эфиров и свыше 80% триглицеридов. Диаметр ХМ колеблется от 100 до 5000 нм. Благодаря большим размерам частиц ХМ не способны проникать из эндотелиальных клеток кишечника в кровеносные капилляры и диффундируют в лимфатическую систему кишечника, а из нее - в грудной лимфатический проток. Затем из грудного лимфатического протока ХМ попадают в кровяное русло, т. е. с их помощью осуществляется транспорт экзогенных триглицеридов, холестерина и частично фосфолипидов из кишечника через лимфатическую систему в кровь. Уже через 1-2 ч после приема пищи, содержащей липиды, наблюдается алиментарная гиперлипемия. Это физиологическое явление, характеризующееся в первую очередь повышением концентрации триглицеридов в крови и появлением в ней ХМ. Пик алиментарной гиперлипемии приходится на 4-6 ч после приема жирной пищи. Обычно через 10-12 ч после приема пищи содержание триглицеридов возвращается к нормальным величинам, а ХМ полностью исчезают из кровяного русла.
Известно, что печень и жировая ткань играют наиболее существенную роль в дальнейшей судьбе ХМ. Последние свободно диффундируют из плазмы крови в межклеточные пространства печени (синусоиды). Допускается, что гидролиз триглицеридов ХМ происходит как внутри печеночных клеток, так и на их поверхности. Что же касается жировой ткани, то хиломикроны не способны (из-за своих размеров) проникать в ее клетки. В связи с этим триглицериды ХМ подвергаются гидролизу на поверхности эндотелия капилляров жировой ткани при участии фермента липопротеидлипазы, который тесно связан с поверхностью эндотелия капилляров. В результате образуются жирные кислоты и глицерин. Часть жирных кислот проходит внутрь жировых клеток, а часть связывается с альбуминами сыворотки крови и уносится с ее током. С током крови может покидать жировую ткань и глицерин.
Расщепление триглицеридов ХМ в печени и в кровеносных капиллярах жировой ткани фактически приводит к прекращению существования ХМ.
Промежуточный обмен липидов. Включает следующие основные процессы: расщепление триглицеридов в тканях с образованием высших жирных кислот и глицерина, мобилизацию жирных кислот из жировых депо и их окисление, образование ацетоновых тел (кетоновых тел), биосинтез высших жирных кислот, триглицеридов, глицерофосфолипидов, сфинголипидов, холестерина и т. д.
Внутриклеточный липолиз
Главным эндогенным источником жирных кислот, используемых в качестве "топлива", служит резервный жир, содержащийся в жировой ткани. Принято считать, что триглицериды жировых депо выполняют в обмене липидов такую же роль, как гликоген печени в обмене углеводов, а высшие жирные кислоты по своей роли напоминают глюкозу, которая образуется в процессе фосфоролиза гликогена. При физической работе и других состояниях организма, требующих повышенной затраты энергии, потребление триглицеридов жировой ткани как энергетического резерва увеличивается.
Поскольку в качестве источников энергии могут использоваться только свободные, т. е. неэтерифицированные, жирные кислоты, то триглицериды сначала гидролизуются при помощи специфических тканевых ферментов - липаз - до глицерина и свободных жирных кислот. Последние из жировых депо могут переходить в плазму крови (мобилизация высших жирных кислот), после чего они используются тканями и органами тела в качестве энергетического материала.
В жировой ткани содержится несколько липаз, из которых наибольшее значение имеют триглицеридлипаза (так называемая гормоночувствительная липаза), диглицеридлипаза и моноглицеридлипаза. Активность двух последних ферментов в 10-100 раз превышает активность первого. Триглицеридлипаза активируется рядом гормонов (например, адреналином, норадреналином, глюкагоном и др.), тогда как диглицеридлипаза и моноглицеридлипаза нечувствительны к их действию. Триглицеридлипаза является регуляторным ферментом.
Установлено, что гормоночувствительная липаза (триглицеридлипаза) находится в жировой ткани в неактивной форме и активируется цАМФ. В результате воздействия гормонов первичный клеточный рецептор модифицирует свою структуру, и в такой форме он способен активировать фермент аденилатциклазу, что в свою очередь стимулирует образование цАМФ из АТФ. Образовавшийся цАМФ активирует фермент протеинкиназу, который путем фосфорилирования неактивной триглицеридлипазы превращает ее в активную форму (рис. 96). Активная триглицеридлипаза расщепляет триглицерид (ТГ) на диглицерид (ДГ) и жирную кислоту (ЖК). Затем при действии ди- и моноглицеридлипаз образуются конечные продукты липолиза - глицерин (ГЛ) и свободные жирные кислоты, которые поступают в кровяное русло.
Связанные с альбуминами плазмы в виде комплекса свободные жирные кислоты с током крови попадают в органы и ткани, где комплекс распадается, а жирные кислоты подвергаются либо β-окислению, либо часть их используется на синтез триглицеридов (которые затем идут на образование липопротеидов), глицерофосфолипидов, сфинголипидов и других соединений, а также на этерификацию холестерина.
Другой источник жирных кислот - фосфолипиды мембран. В клетках высших животных непрерывно происходит метаболическое обновление фосфолипидов, в процессе которого образуются свободные жирные кислоты (продукт действия тканевых фосфолипаз).
