
- •Г. М. Бутов, г. Р. Гаджиев, к. Р. Саад
- •Введение
- •Показатели химико - технологического процесса
- •Выход продукта - отношение фактически полученного количество продукта к максимально возможному количеству, которое теоретически можно получить в соответствии со стехиометрией химической реакции.
- •Материальный баланс дегидрирования изопропилбензола
- •Селективность:
- •Задачи для самостоятельного решения
- •2. Стехиометрия реакций и материальные расчеты
- •Материальный баланс процесса получения диэтилового эфира
- •Стехиометрическая матрица реакции этилирования бензола
- •Материальный баланс процесса получения этилбензола
- •Задачи для самостоятельного решения
- •Составьте стехиометрическую матрицу, найдите число независимых реакций, выберите независимые реакции и ключевые вещества.
- •3. Составление материальных балансов
- •Теоретический материальный баланс синтеза оксида углерода
- •Исходные данные для расчета материального баланса
- •Материальный баланс синтеза оксида углерода
- •Исходные данные для расчета материального баланса
- •8 Количество кислорода, пошедшего на основную реакцию:
- •Материальный баланс синтеза ацетальдегида
- •Материальный баланс кристаллизации аммиачной селитры
- •Решение
- •Результаты расчетов сводим в таблицу.
- •Материальный баланс электролиза поваренной соли
- •Задачи для самостоятельного решения
- •4. Тепловые расчеты химико-технологических процессов и принципы составления энергетического баланса
- •Тепловой баланс стадии синтеза
- •Исходные данные для расчета теплового баланса.
- •Термодинамические параметры веществ участников реакции
- •Рассчитанные значения теплоемкостей для веществ участников реакции при заданных температурах.
- •Приход тепла
- •Расход тепла
- •5.3. Количество тепла, которое выходит из реактора с оксидом углерода:
- •Тепловой баланс стадии синтеза
- •Задачи для самостоятельного решения
- •5. Термодинамический анализ основной реакции и расчет константы равновесия
- •Исходные данные
- •Термодинамические свойства веществ
- •Задачи для самостоятельного решения
- •6. Расчёт равновесной степени превращения и равновесного состава реагирующих веществ
- •Задачи для самостоятельного решения.
- •7. Кинетика гомогенных химических процессов Основной закон кинетики.
- •Пример 6.1
- •Экспериментальные данные константы скорости реакции
- •Значения константы скоростей для различных порядков
- •Графический метод определения энергии активации
- •Задачи для самостоятельного решения
- •8. Расчет реакторов для проведения
- •Зависимость скорости реакции от степени превращения
- •Пример 8.2
- •Уравнение скорости реакции в соответствии со стехиометрическим уравнением запишется в виде
- •Задачи для самостоятельного решения
- •2. Необратимая реакция третьего порядка
- •Приложение Термодинамические свойства веществ
- •Продолжение приложения
- •Расчеты химико-технологических процессов
- •Темплан 2009г., поз. №_2в (з)
- •400131 Волгоград, просп. Им. В.И. Ленина, 28. Рпк “политехник”
- •400131 Волгоград, ул. Советская, 35.
Теоретический материальный баланс синтеза оксида углерода
Сырье |
Приход |
|||
кмоль/час |
% моль. |
кг/час |
% масс |
|
Метан |
35,71 |
50,00 |
571,43 |
47,06 |
Водяной пар |
35,71 |
50,00 |
642,85 |
52,94 |
Итого |
71,42 |
100 |
1214,82 |
100 |
Продукты реакции |
Расход |
|||
Оксид углерода |
35,71 |
25,00 |
1000 |
82,40 |
Водород |
107,14 |
75,00 |
214,2 |
17,60 |
Итого |
142,85 |
100 |
1214,28 |
100 |
Пример 3.2
Составить практический материальный баланс химико-технологического процесса.
Основная реакция:
СН4 + Н2О = СО + 3Н2; (1)
(А) (В) (С) (Д)
первая побочная реакция;
СН4 + 2Н2О = СО2 + 4 Н2; (2)
(А1) (В1) (Е) (Д1)
вторая побочная реакция;
СН4 = С + 2 Н2; (3)
(А2) (F) (Д2)
Таблица 3.2
Исходные данные для расчета материального баланса
Производительность реактора, т/г Число дней работы реактора в году, n Технологический выход продукта, f, % Молярное соотношение исходных реагентов, А : В |
8200 345 94,7
1:2,8 |
Окончание таблицы. 3.2.
Степень превращения ХА, % |
85 |
|
Селективность реакций, % |
Основной (1) |
64 |
побочной (2) |
34 |
|
Состав исходного реагента А, % (об.) |
метан |
99 |
примесь - этан |
1,0 |
|
Состав исходного реагента В, (% об.) |
водяной пар |
98,0 |
СО2 |
2,0 |
|
Решение.
При составлении материального баланса целесообразно использовать мольные потоки веществ. Переведем производительность оксида углерода, выраженную в единицах массового потока, в мольную производительность.
Молекулярные массы веществ, участвующих в реакции, равны:
МrА=16; МrВ=18; МrС =28; МrД =2; МrE = 44; МrF =12;
Стехиометрические коэффициенты веществ, участвующих в реакции, равны: А = 1; В = 1; С =1;Д = 3; А1= 1В1 = 2; Е = 1; Д1 = 4; А2= 1; F = 1; Д2 =2.
Переведем производительность реактора, выражаемую в единицах массового потока, в мольную:
![]() ,
,
где Мr – молекулярная масса целевого продукта (оксида углерода); n – число работы дней реактора в году; Gm – производительность реактора, т/год.
![]() .
.
Пересчитаем это количество с учетом технологического выхода продукта:
![]() .
.
Приход
Так как метан в реакционной массе находится в недостатке, то требуемый расход смеси рассчитывается по метану.
1. Количество метана, требуемое для получения 0,62 кмоль/мин оксида углерода:
![]() .
.
2. Количество метана, требуемое для получения оксида углерода с учетом селективности;
![]() .
.
3. Количество метана, требуемое для получения оксида углерода с учетом степени превращения:
![]() .
.
4. Количество метана, пошедшего на побочные реакции:
Gn,4 = Gn,2 – Gn,1 = 0,97 – 0,62 = 0,35 кмоль/мин.
5. Определим селективность второй побочной реакции:
![]() .
.
5.1. Определим количество метана, пошедшего на первую побочную реакцию:
![]()
5.2. Определим, сколько метана прореагировало во второй побочной реакции:
![]() .
.
6. Определим количество непрореагировавшего метана:
Gn,7 = Gn,3 – Gn,2 = 1,08 – 0,97 = 0,11 кмоль/мин.
7. Количество метана с учетом его состава:
![]() или
1,09 кмоль/мин или 17,54 кг/мин;
или
1,09 кмоль/мин или 17,54 кг/мин;
где Vн.у. –объем газа при нормальных условиях.
8. Определим количество примеси (этана), поступающего с метаном:
Gn,9 = Gn,8∙0,01 = 24,56 0,01 = 0,24 м3/мин или 0,01 кмоль/мин или 0,33 кг/мин.
9. Количество водяного пара, поступающего с метаном с учетом мольного соотношения:
Gn,10 = Gn,3∙2,8 = 1,08∙2,8 = 3,04 кмоль/мин или 54,71 кг/мин.
10. Количество водяного пара с учетом его состава:
![]() или
3,10 кмоль/мин или 55,82 кг/мин.
или
3,10 кмоль/мин или 55,82 кг/мин.
11. Количество примеси (диоксид углерода), поступающей с водяным паром:
Gn,12 = Gn,11 ∙ iCO2 = 69,47∙0,02 = 1,38 м3/мин или 0,06 кмоль/мин или 2,73 кг/мин.
12. Количество водяного пара, пошедшего на основную реакцию:
![]() .
.
13. Количество водяного пара, пошедшего на первую побочную реакцию:
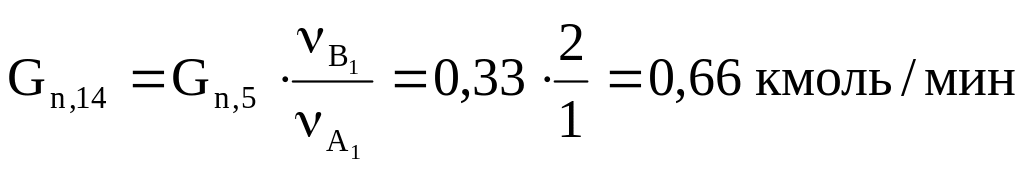 .
.
14. Количество непрореагировавшего водяного пара:
Gn,15 = Gn,10 – Gn,13 – Gn,14 = 3,04 – 0,62 – 0,66 = 1,75 кмоль/мин.
Расход
1. Количество оксида углерода (СО), образовавшегося в основной реакции:
![]() .
.
2. Количество водорода, образовавшегося в основной реакции:
.![]() .
.
3. Количество диоксида углерода (СО2), образовавшегося в первой побочной реакции:
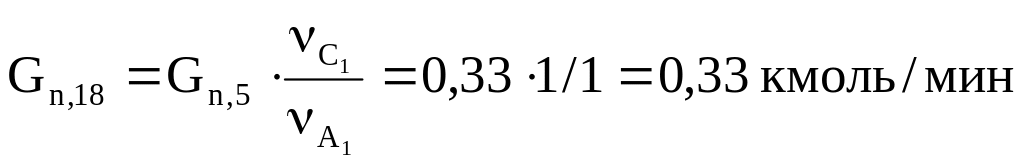 .
.
4. Количество водорода, образовавшегося в первой побочной реакции:
 .
.
5. Количество углерода, образовавшегося во второй побочной реакции:
 .
.
6. Количество водорода, образовавшегося во второй побочной реакции:
 .
.
7. Суммарное количество водорода, образовавшегося в процессе:
Gn,22 = Gn,17 + Gn,19 + Gn,21 = 1,86 + 1,32 + 0,04 = 3,22 кмоль/мин.
Результаты проведенных расчетов сводим в таблицу материального баланса.
Таблица 3.3
