
- •Г. М. Бутов, г. Р. Гаджиев, к. Р. Саад
- •Введение
- •Показатели химико - технологического процесса
- •Выход продукта - отношение фактически полученного количество продукта к максимально возможному количеству, которое теоретически можно получить в соответствии со стехиометрией химической реакции.
- •Материальный баланс дегидрирования изопропилбензола
- •Селективность:
- •Задачи для самостоятельного решения
- •2. Стехиометрия реакций и материальные расчеты
- •Материальный баланс процесса получения диэтилового эфира
- •Стехиометрическая матрица реакции этилирования бензола
- •Материальный баланс процесса получения этилбензола
- •Задачи для самостоятельного решения
- •Составьте стехиометрическую матрицу, найдите число независимых реакций, выберите независимые реакции и ключевые вещества.
- •3. Составление материальных балансов
- •Теоретический материальный баланс синтеза оксида углерода
- •Исходные данные для расчета материального баланса
- •Материальный баланс синтеза оксида углерода
- •Исходные данные для расчета материального баланса
- •8 Количество кислорода, пошедшего на основную реакцию:
- •Материальный баланс синтеза ацетальдегида
- •Материальный баланс кристаллизации аммиачной селитры
- •Решение
- •Результаты расчетов сводим в таблицу.
- •Материальный баланс электролиза поваренной соли
- •Задачи для самостоятельного решения
- •4. Тепловые расчеты химико-технологических процессов и принципы составления энергетического баланса
- •Тепловой баланс стадии синтеза
- •Исходные данные для расчета теплового баланса.
- •Термодинамические параметры веществ участников реакции
- •Рассчитанные значения теплоемкостей для веществ участников реакции при заданных температурах.
- •Приход тепла
- •Расход тепла
- •5.3. Количество тепла, которое выходит из реактора с оксидом углерода:
- •Тепловой баланс стадии синтеза
- •Задачи для самостоятельного решения
- •5. Термодинамический анализ основной реакции и расчет константы равновесия
- •Исходные данные
- •Термодинамические свойства веществ
- •Задачи для самостоятельного решения
- •6. Расчёт равновесной степени превращения и равновесного состава реагирующих веществ
- •Задачи для самостоятельного решения.
- •7. Кинетика гомогенных химических процессов Основной закон кинетики.
- •Пример 6.1
- •Экспериментальные данные константы скорости реакции
- •Значения константы скоростей для различных порядков
- •Графический метод определения энергии активации
- •Задачи для самостоятельного решения
- •8. Расчет реакторов для проведения
- •Зависимость скорости реакции от степени превращения
- •Пример 8.2
- •Уравнение скорости реакции в соответствии со стехиометрическим уравнением запишется в виде
- •Задачи для самостоятельного решения
- •2. Необратимая реакция третьего порядка
- •Приложение Термодинамические свойства веществ
- •Продолжение приложения
- •Расчеты химико-технологических процессов
- •Темплан 2009г., поз. №_2в (з)
- •400131 Волгоград, просп. Им. В.И. Ленина, 28. Рпк “политехник”
- •400131 Волгоград, ул. Советская, 35.
Материальный баланс дегидрирования изопропилбензола
Приход |
Расход |
||||||||
Сырье |
|
% моль. |
|
% масс |
Продукты реакции |
|
% моль. |
|
% масс |
Изопропибензол |
3,33 |
100 |
400 |
100 |
α – Метилстирол |
1,69 |
29,75 |
200,00 |
50,00 |
Изопропилбензол (непр.) |
0,97 |
16,90 |
114,84 |
28,71 |
|||||
Водород |
1,69 |
29,75 |
3,38 |
0,84 |
|||||
|
|
|
|
|
Толуол |
0,67 |
11,79 |
61,67 |
15,42 |
|
|
|
|
|
Этан |
0,67 |
11,55 |
20,11 |
5,03 |
Итого |
3,33 |
100 |
400 |
100 |
Итого |
5,68 |
100 |
400 |
100 |
Решение:
Стехиометрические коэффициенты равны:
А=-1; В=1; С =1, А1=-1; В1=1; С1 =1.
Молекулярные массы веществ, участвующих в реакции, равны:
МrА = 120; МrВ=118; МrС=2; МrВ1 = 92; МrС1 =30.
Количество изопропилбензола в кмоль/час:
Gn = 3,33 кмоль/час.
Количество не прореагировавшего изопропилбензола в кмоль/час:
Gn 1 = 0,97 кмоль/час.
Количество α – метилстирола в кмоль/час:
Gn 2 = 1,69 кмоль/час.
Степень превращения изопропилбензола:
![]() (71
%).
(71
%).
Выход α – метилстирола:
fВ = Gn2/Gn = 1,69/3,33 = 0,51 (51 %).
Селективность:
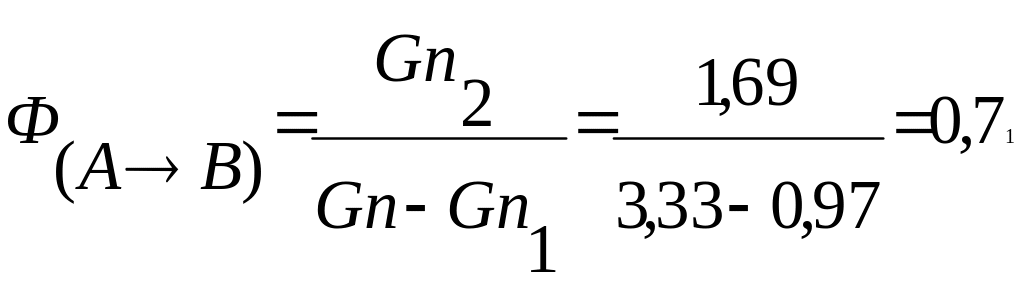 (71
%).
(71
%).
Пример 1.2
Рассчитать теоретические и практические расходные коэффициенты этанола и уксусной кислоты для получения 1000 кг этилацетата
С2Н5ОН
+ СН3СООН
= СН3СООС2Н5
+ Н2О
А В С Д
Исходные данные: степень превращения хА=0,72; селективность ФАС = 0,90; технологический выход fс = 0,86; молярное соотношение исходных реагентов А : В = 1:2. Состав исходного реагента А, (% масс): этанол (С2Н5ОН) -92,4; вода (Н2О )- 7,6 (примесь). Состав исходного реагента В, (% масс): уксусная кислота (СН3СООН) - 97,6; муравьиная кислота (НСООН) -2,4 (примесь).
Решение:
Стехиометрические коэффициенты равны:
А=-1; В=-1; С =1; Д =1;
Молекулярные массы веществ, участвующих в реакции, равны:
МrА = 46; МrВ=60; МrС=88; МrД = 18.
Теоретические расходные коэффициенты, согласно определению, равны:
для этанола (А):
![]() .
.
Для уксусной кислоты (В):
![]() .
.
Практический расходный коэффициент для этанола (А), согласно формуле (1.7), равен:
 или
или
![]() .
.
Так как в реакции используется технический этанол, то определяем его расход в смеси с водой (примесь):
![]() .
.
Количество воды в смеси составит:
![]() .
.
Исходя из молярного соотношения исходных реагентов, получим практический расходный коэффициент для уксусной кислоты (В) в кмоль:
![]() или
или
![]() .
.
Практический расходный коэффициент уксусной кислоты с примесью:
![]() .
.
Ответ: теоретические расходные коэффициенты для получения 1000 кг этилацетата (кг) составляют: этиловый спирт - 522, уксусная кислота - 681, а практические расходные коэффициенты (кг) - 1115, 2506 соответственно.
Пример 1.3
Рассчитать теоретические и практические расходные коэффициенты оксида углерода, метанола и этилена для получения 1000кг этилацетата по реакции:
СО + СН3ОН + С2Н4 = СН3СОО С2Н5
А В С Д
Исходные данные: степень превращения хВ=0,912; селективность ФАД = 0,87; технологический выход fд = 0,941; молярное соотношение реагентов А:В:С = 2 :1:2. Состав исходного реагента А, (% об): оксид углерода (СО)- 87,5; азота (N2) - 12,5. Состав исходного реагента В, (% масс): метанол (СН3ОН)- 93,8; вода (Н2О) - 6,2. Состав исходного реагента С, (% об): этилена (С2Н4) - 99,9; этана (С2Н6) - 0,1.
Решение.
Стехиометрические коэффициенты равны:
А=-1;В=-1; С =-1; Д =1.
Молекулярные массы веществ, участвующих в реакции, равны:
МrА = 28; МrВ=32; МrС=28; МrД = 88.
Теоретические расходные коэффициенты, согласно определению, равны:
для оксида углерода (А):
![]()
Для метанола (В):
![]() .
.
Для этилена (С)
![]() .
.
Практический расходный коэффициент определяем по метанолу т.к. метанол по отношению к другим исходным реагентам взят в недостатке.
Практический расходный коэффициент для метанола (В), согласно формуле (1.7), равен:
![]() или
или
![]()
Так как в реакции используется технический метанол, то определяем его расход с примесью:
![]()
Количество воды в метаноле составит:
![]() .
.
Исходя из молярного соотношения исходных реагентов, рассчитаем практический расходный коэффициент для оксида углерода (А) в кмоль:
![]() или
или
![]() ;
;
где 22.4 –объем газа при нормальных условиях.
Практический расходный коэффициент оксида углерода с учетом его состава:
![]() .
.
Количество азота в смеси составит:
![]() ;или
;или
![]()
Исходя из молярного соотношения исходных реагентов, рассчитаем практический расходный коэффициент для этилена (С) в кмоль:
![]() или
или
![]() .
.
Практический расходный коэффициент этилена с учетом ее состава:
![]() .
.
Количество этана в смеси составит:
![]() или
или
![]() .
.
Ответ: теоретические расходные коэффициенты для получения 1000 кг этилацетата составляют: оксида углерода – 318 кг (254 м3), метанола – 363 кг, этилена –318 кг (254 м3), а практические расходные коэффициенты: оксида углерода – 779 м3, метанола – 519 кг, этилена – (682, м3).
Пример 1.4
Определить практические расходные коэффициенты сырья в производстве карбида кальция (технического), имеющего по анализу следующий состав веществ, (%масс.): СаС2-78, СаО-15, С-3, прочие примеси - 4. Известь содержит, (%масс.): СаО-96.5; содержание в коксе золы - 4, летучих – 4, влаги –3.
СаО + 3С = СаС2+СО
А В С Д
Решение:
Стехиометрические коэффициенты равны:
А=-1;В=-3; С =1; Д =1.
Молекулярные массы веществ, участвующих в реакции, равны:
МrА = 56; МrВ = 12; МrС = 64; МrД = 28.
Определим количество карбида кальция в 1000 кг продукта:
![]() .
.
По уравнению реакции для получения 780 кг карбида кальция потребуется извести:
![]() .
.
В техническом продукте содержится 15% непрореагировавшей извести:
![]() .
.
Тогда общий расход извести равен:
![]() +
+![]() =
682,5+150=832,50 кг.
=
682,5+150=832,50 кг.
Расход технической извести тогда составит:
![]() .
.
Определим практический расходный коэффициент для кокса: процентное содержание углерода в коксе;
100% - (- iзолы + iлетуч. в-в + iвлаги )=100 - (4+4+3) = 89%.
По уравнению реакции для образования 780 кг карбида кальция расходуется углерода:
![]() .
.
В
готовом продукте в виде непрореагировавшего
углерода содержится:
![]() .
.
Тогда общий расход углерода составит:
![]()
![]() +
+![]() .
.
Расходный коэффициент по коксу с учетом процентного содержания углерода равен:
![]() .
.
Ответ: практические расходные коэффициенты для получения 1000 кг карбида кальция (кг) составляют: извести-862.7кг, углерода-468,8кг.
