
- •16.01.2017. Пгту. Химия. Вариант 1. Контрольная контрольная работа №2
- •1. Вычислите, какое количество теплоты выделится при восстановлении металлическим алюминием, если было получено 335,1 г железа.
- •2. Окисление серы и ее диоксида протекает по уравнениям: а) ; б) . Как изменятся скорости этих реакций, если объемы каждой из систем уменьшить в четыре раза?
- •3. Напишите выражение для константы равновесия гетерогенной системы . Как следует изменить концентрацию и давление, чтобы сместить равновесие в сторону обратной реакции – образования водяных паров?
- •4. Исходя из значений стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ, вычислите реакции, протекающей по уравнению
- •5. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) и NaOh; б) и hCl; в) и .
- •Контрольная работа №3
- •2. Какую массу нужно растворить в 400 г воды, чтобы приготовить 20%-ный раствор?
- •Контрольная работа №4
- •1. Реакции выражаются схемами:
- •2. Составьте схему, напишите электронные уравнения электродных процессов и вычислите эдс медно-кадмиевого гальванического элемента, в котором моль/л, а моль/л.
- •3. При электролизе раствора на аноде выделилось 168 газа (н.У.). Составьте электронные уравнения процессов, происходящих на электродах, и вычислите, какая масса меди выделилась на катоде.
Контрольная работа №4
1. Реакции выражаются схемами:


Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое – восстановителем; какое вещество окисляется, какое – восстанавливается.
Ответ.
Электронные уравнения:

Баланс реакции:

Окончательный вид уравнения реакции:

Электронные уравнения:

Баланс реакции:

Окончательный вид уравнения реакции:

2. Составьте схему, напишите электронные уравнения электродных процессов и вычислите эдс медно-кадмиевого гальванического элемента, в котором моль/л, а моль/л.
Ответ.
Электродный потенциал металла (φ) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:

где
 – стандартный электродный потенциал;
– стандартный электродный потенциал;
 – число электронов, принимающих участие
в процессе;
– концентрация ионов металла в растворе.
– число электронов, принимающих участие
в процессе;
– концентрация ионов металла в растворе.
По уравнению Нернста определяем потенциалы металлов:


Так как
 ,
то медный электрод является катодом,
на котором идет процесс восстановления:
,
то медный электрод является катодом,
на котором идет процесс восстановления:

Кадмиевый электрод является анодом, на котором протекает процесс окисления:

Схема данного медно-кадмиевого гальванического элемента имеет вид:
ЭДС (Е) элемента рассчитываем по разности электродных потенциалов катода и анода:

3. При электролизе раствора на аноде выделилось 168 газа (н.У.). Составьте электронные уравнения процессов, происходящих на электродах, и вычислите, какая масса меди выделилась на катоде.
Ответ.
Сульфат меди в растворе диссоциирует на ионы:

К катоду движутся катионы
меди
 ;
кроме того, около катода находятся
молекулы воды. Потенциал восстановления
катионов меди больше потенциала
восстановления воды в нейтральной
среде, поэтому на катоде будет происходить
электрохимическое восстановление
катионов меди:
;
кроме того, около катода находятся
молекулы воды. Потенциал восстановления
катионов меди больше потенциала
восстановления воды в нейтральной
среде, поэтому на катоде будет происходить
электрохимическое восстановление
катионов меди:
К аноду движутся
сульфат-анионы
 ;
кроме того, там находятся молекулы воды.
Анионы кислородосодержащих кислот,
имеющие в своем составе атом элемента
в высшей степени окисления (
,
;
кроме того, там находятся молекулы воды.
Анионы кислородосодержащих кислот,
имеющие в своем составе атом элемента
в высшей степени окисления (
,
 и др.), при электролизе водных растворов
на аноде не разряжаются. Следовательно,
на аноде происходит электрохимическое
окисление воды:
и др.), при электролизе водных растворов
на аноде не разряжаются. Следовательно,
на аноде происходит электрохимическое
окисление воды:

Количественные соотношения при электролизе определяют в соответствии с законами, открытыми М. Фарадеем. Обобщенный закон Фарадея связывает количество вещества, образовавшегося при электролизе, со временем электролиза и силой тока:

где – масса образовавшегося вещества; М – молярная масса вещества; – количество электронов, участвующих в электродном процессе; I – сила тока; t – время электролиза; F – постоянная Фарадея, равная 96500 Кл/моль.
Для газообразных веществ, выделяющихся при электролизе, формулу используют в виде:
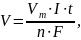
где V
– объем газа,
выделяющегося на электроде;
 – молярный объем газообразного вещества,
при нормальных условиях равный 22,4
л/моль.
– молярный объем газообразного вещества,
при нормальных условиях равный 22,4
л/моль.
Объединяя оба уравнения,
выражаем и рассчитываем массу выделившейся
на катоде меди, учитывая, что объем
выделившегося кислорода равен
 :
:

4. Железное изделие покрыли никелем. Какое это покрытие – анодное или катодное? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и в хлороводородной (соляной) кислоте. Какие продукты коррозии образуются в первом и во втором случаях?
Ответ.
Никель имеет более положительный потенциал, чем железо. Следовательно, никель – катодное покрытие для железа. При нарушении целостности никелевого покрытия образуется коррозионный микрогальванический элемент, в котором железо будет анодом, а никель – катодом. Подвергаться коррозии (окисляться) будет более активный металл – железо.
Уравнения анодного (А) и катодного (К) процессов запишутся следующим образом:

Таким образом, продуктом коррозии во влажном воздухе будет нерастворимый гидроксид железа(II), а в среде соляной кислоты ‒ растворимый хлорид железа(II) и газообразный водород:


