- •Доменная печь
- •3.2.2. Шихта доменной плавки
- •3.2 3 Общая схема доменного процесса
- •3.2.4 Чугуны, выплавляемые в доменных печах
- •Особенности движения шихты в доменной печи
- •3.3.2 Особенности движения газов в доменной печи
- •Стальная рабочая труба, 2- корпус печи с нагревателем, 3-стальные дымчатые диски,4- загрузочный бункер,5- привод,6- разгрузочный бункер,7- камера подачи водорода
Лекция 1.
Значение металлов и сплавов для промышленного комплекса страны. Классификация черных и цветных металлов и сплавов. Перспективы металлургии в связи с развитием новой техники и инновационных технологий. Общая характеристика процессов горения.
План лекции:
1. Металлургия в наше время
2. Классификация металлов и сплавов.
3. Общая характеристика процессов горения в металлургии.
Не утеряла своего важного значения металлургия и в наше время. Практически все современные отрасли науки и техники в той или иной мере связаны с металлургией. Без развития металлургии немыслимо развитие энергетики, реактивной техники, самолетостроения, ядерной технологии, химической промышленности, машиностроения, строительства и многих других отраслей. Успехи таких современных областей техники, как радиоэлектроника, вычислительная и лазерная техника всецело зависят от достижений прецизионной металлургии, получение особо чистых металлов и соединений со строго заданными свойствами. За последние 60-100 лет во много раз увеличилось производство цветных металлов, особенно, алюминия, однако доля черных металлов в мировом производстве продолжает оставаться преобладающей и почти неизменной -около 95% от общего производства металлов. Можно смело утверждать что металлы в ХХI в. останутся основными конструкционными материалами, так как по своим свойствам, экономичности производства и потребления не имеют себе равных в большинстве сфер применения. Объемы производства металлов составляют от млрд. т до килограммов. Так в 2009-2011гг. мировое производство стали составило 1,2-1,4млр.т, А1-36-42млн.т, Сu-18-19.млн.т, Zn-11-13 млн.т, Pb-8-10 млн. т, Ti, Mg, Ni, Со, Mo, W- тысячи тонн, Au, Rt, Se, Те, Hg, Cd, Bi-тонны, I2, Os, Ra-килограммы.

Рисунок 1. Рост населени Земли и производства металлов (металофонда)
Аналитические службы отмечают, что темпы роста металлопроизводства на Земле постоянно ускоряются. Достаточно отметить, что за последние 6000 лет человечество произвело ≈23 млр.т металлов, из них ≈18 млр.т, за последние 50 лет (рисунок 1). Прирост производства (металлофонда) металлов за последние 50 лет (1950-2000гг) увеличился в 3,6 раза. В то же время за последние 50 лет население Земли увеличивалось практически линейно от 5 млр. человек в 1950г до 6,1 млр. человек в 2000 г.
Из 118 элементов Периодической системы Менделеева (118 элемент был открыт в Дубне (Российская Федерация), и ему еще пока не дали название) 96 являются металлами. По сложившейся традиции все металлы принято разделять на два класса: черные и цветные. К черным относятся: железо (и его сплавы), а также марганец, ванадий и хром, которые используются в качестве легирующих добавок. Все остальные металлы относятся к группе цветных (рисунок 2).
Цветные металлы делят на следующие подгруппы:
Тяжелые цветные металлы. Основные - медь, свинец, никель, цинк, олово являются важнейшими по своему значению и по объему производства. К тяжелым цветным металлам относят также некоторые элементы, добыча которых заметно ниже основных. Это прежде всего кобальт, кадмий, мышьяк, сурьма, висмут, ртуть. Эти металлы нередко являются спутниками основных тяжелых металлов и их производят попутно в общем металлургическом цикле.
Легкие цветные металлы. Основные - алюминий, магний получают также в больших количествах и их значение в производственной сфере очень велико. К группе легких металлов относят обычно также щелочное (Li, Na, К, Al, Cs, Fr), щелочноземельные металлы (Са, Ва, Sr, Be), кремний и галлий.
Благородные металлы: золото, серебро, платина и платиноиды (осмий, иридий, родий, рутений, палладий).
Редкие металлы. Редкие металлы объединяют значительную группу элементов. Производство их относительно невелико, однако значение их в связи с развитием техники возрастает с каждым годом. Редкие металлы принято делить на следующие подгруппы:
Тугоплавкие — вольфрам, молибден, титан, тантал, ниобий,цирконий;
Редкоземельные - лантан, иттрий и лантаноиды ;
Радиоактивные - радий, уран, полоний, торий, актиний и актиноиды, трансурановые элементы;
Рассеянные - (галлий, индий, талий, германий, рений, теллур);
Благородные металлы: золото, серебро, платина и платиноиды (осмий, иридий, родий, рутений, палладий).
Редкие металлы. Редкие металлы объединяют значительную группу элементов. Производство их относительно невелико, однако значение их в связи с развитием техники возрастает с каждым годом. Редкие металлы принято делить на следующие подгруппы:
Тугоплавкие — вольфрам, молибден, титан, тантал, ниобий,цирконий;
Редкоземельные - лантан, иттрий и лантаноиды ;
Радиоактивные - радий, уран, полоний, торий, актиний и актиноиды, трансурановые элементы;
Рассеянные - (галлий, индий, талий, германий, рений, теллур);
В основу настоящей классификации положены, с одной стороны, общность физико-химических свойств, с другой - распространенность в природе и исторически сложившаяся общность методов их производства.
Общая характеристика процессов горения в металлургии.
Горением называется процесс взаимодействия топлива с окислителем, сопровождающийся выделением тепла, а иногда и света. Роль окислителя в подавляющем большинстве случаев выполняет кислород воздуха. Всякое горение предполагает прежде всего тесный контакт между молекулами топлива и окислителя. Поэтому, чтобы происходило горение, необходимо обеспечить этот контакт, т. е. необходимо смешать топливо с воздухом. Следовательно, процесс горения складывается из двух стадий: первая — смешение "топлива с воздухом и вторая, в течение которой происходит воспламенение, а затем уже и горение топлива. В процессе горения образуется пламя, в котором протекают реакции горения составляющих топлива и происходит выделение тепла.
Различают гомогенное и гетерогенное горение. При гомогенном горении тепло- и массообмен идут между телами, находящимися в одинаковом агрегатном состоянии. Гомогенное горение протекает в объеме топлива и свойственно газообразному топливу. При гетерогенном горении тепло- и массообмен происходят между телами, находящимися в разных агрегатных состояниях (в состоянии обмена находятся газ и поверхность частиц топлива). Такое горение свойственно жидкому и твердому топливам. Правда, при горении жидкого и твердого топлива благодаря испарению капель и выделению летучих есть элементы и гомогенного горения. Однако при гетерогенном горении в основном идет горение с поверхности.
Гомогенное горение может протекать в кинетической и диффузионной областях. При кинетическом горении полное перемешивание топлива с воздухом осуществляют предварительно, и в зону горения подают заранее подготовленную топливо-воздушную смесь. В этом случае основную роль играют химические процессы, связанные с протеканием реакций окисления топлива. При диффузионном гомогенном горении процессы смешения и горения не разделены и совершаются практически одновременно. В этом случае процесс горения определяется перемешиванием, так как время смешения много больше времени, необходимого для протекания химической реакции. Таким образом, полное время протекания процесса горения складывается из времени смесеобразования (τсм) и времени собственно горения (τг), т. е.τΣ= τсм + τг. При кинетическом горении, когда смесь приготовлена предварительно, τг » τсм и τΣ ≈ τг. При диффузионном горении, наоборот, время смешения неизмеримо больше времени протекания химической реакции, т.еτсм »τг и τΣ ≈ τсм. При гетерогенном горении твердого топлива также различают кинетическую и диффузионную области реагирования. Кинетическая область возникает в том случае, когда скорость диффузии в порах топлива значительно превосходит скорость химической реакции; диффузионная область возникает при обратном соотношении скоростей диффузии и горения.
Контрольные вопросы:
1. Рассказать значение металлургии в наше время.
2. Объяснить классификацию металлов и сплавов.
3. Объяснить общую характеристику процессов горения в металлургии.
Рисунок
2. Классификация металлов

Лекция 2. Теоретические основы процессов восстановления Общая характеристика процессов восстановления металлов и применяемых восстановителей. Термодинамика восстановления оксидов железа водородом и окисью углерода. Восстановление металлов из оксидов углеродом.
План лекции:
1. Восстановление газообразными восстановителями
2. Термодинамика восстановления оксидов железа водородом и окисью углерода.
3. Восстановление твердым углеродом
Восстановление газообразными восстановителями
В качестве газов-восстановителей используют водород, оксид углерода, их смеси, углеводороды. Углеводороды обычно предварительно подвергают конверсии для предотвращения при восстановлении выделения углерода и науглероживания металла.
Если
для восстановления используется водород,
то анализ термодинамической возможности
восстановления оксидов может быть
проведен с помощью диаграммы
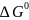 =
f(Т)
для реакций образования оксидов
металлов и водяного пара. Процесс
восстановления в этом случае можно
представить уравнением:
=
f(Т)
для реакций образования оксидов
металлов и водяного пара. Процесс
восстановления в этом случае можно
представить уравнением:
МеОк + Н2 = = Мек + Н2О.
Некоторые металлы, как например, железо, марганец, вольфрам, молибден и другие образуют несколько оксидов. Восстановление как и диссоциация в этом случае протекает в две или более стадий. Для оксидов железа, например, при температурах выше 840К восстановление протекает по трехстадийной схеме:
3Fе2О3 (т) + Н2→2Fе3О4 (т) + Н2О; (1)
2Fе3О4(Т) + 2Н2 → 6FеОт + 2Н2О; (2)
6FеОт + 6Н2 → 6Fет + 6Н2 (3)
При температурах ниже 840К Fе3О4 восстанавливается сразу до железа, поэтому процесс восстановления Fе2О3 двухстадийный:
3Fе2О3(т) + Н2→ 2Fе3О4(т) + Н2О; (4)
2Fе3О4 (т) + 8Н2 →6Fе + 8Н2О. (5)
На рисунке 1 линия равновесного состава газа для реакции (1) нанесена условно, вследствие необратимости этой реакции газовая фаза практически полностью состоит из паров воды. Используя рисунок 1, можно при заданной температуре, общем давлении и парциальном давлении одного из газов определить область существования конденсированной фазы (железа, вюстита, магнетита или гематита). Равновесные характеристики восстановления других оксидов могут быть рассчитаны подобным образом.

Рисунок 1. Диаграмма равновесий оксидов железа с газовой фазой СО—СО2 (1) и Н2— Н2О (2) (A — кривая газификации углерода)
Так же, как и для восстановления водородом при Т > 840К:
ЗFе2О3 + СО ↔ 2Fе3О4 + СО2; (6)
2Fе3О4 + 2СО ↔ 6FеО + 2СО2; (7)
6FеОт + 6СО ↔6Fет + 6СО2 (8)
и при Т < 840 К:
ЗFе2О3 (т) + СО ↔ 2Fе3О4 (т) + СО2; (9)
2Fе3О4 (Т) + 8СО↔ 6Fет + 8СО2. (10)
Сопоставление линий равновесного состава газовой фазы при восстановлении оксидов железа газами СО и Н2 (рис.2) показывает, что при температурах Т<1083К для восстановления оксидов железа требуется более высокое по сравнению с СО парциальное давление Н2 в газовой фазе. При Т>1083К соотношение обратное: для соответствующих оксидов равновесное парциальное давление Н2 ниже, чем равновесное парциальное давление СО.
Таким образом, при Т<1083К более сильным восстановителем является оксид углерода, а при Т>1083К — водород. Это изменение восстановительной способности СОи Н2 иллюстрируется рисунке 2 (пересечение линий равновесного состава смесей СО—СО2 и Н2-Н20).

Рисунок 2. Диаграмма науглероживания железа оксидом углерода: 1-0,01%, 2-0,02%; 3-0,03%; 4-0,02%; 5-0,04%; 6-0,10%; 7-0,30%; 8-0,60%; 9-0,01%; 10-0,014%.
При восстановлении оксидом углерода оксидов железа необходимо учитывать возможность науглероживания металла:
2СО↔[С]Ме + С02, (52)
где [С]Ме— углерод, растворенный в металле.
Если константа равновесия
Кр
=
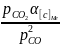 (11)
(11)
для этой реакции
известна, то можно определить активность
углерода в металлическом растворе,
находящимся в равновесии с газовой
фазой СО—СО2
при различных отношениях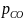 /
/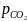 -
Для
раствора Fе—С
равновесное содержание углерода в
железе представлено на рисунке 2.
-
Для
раствора Fе—С
равновесное содержание углерода в
железе представлено на рисунке 2.
При восстановлении оксидов, находящихся в растворе или образующих химические соединения с другими оксидами, например, вюстит с МnО, Мg0, СаО, процессы восстановления имеют свои особенности, связанные с учетом активности оксида, находящегося в растворе. Равновесие реакции восстановления в общем виде можно представить уравнением:
п [Ме'О] • Ме"О + В = Ме' + (п - 1)[Ме'О] • Ме"О + ВО, (12)
где [Ме'0]-Ме"0— твердый раствор Ме'О в Ме"О; п — число молей Ме'О, растворенных в Ме"О.
Видно, что в процессе восстановления изменяется (уменьшается) концентрация Ме'О и Ме"О, что неизбежно приводит к изменению равновесного состава газовой фазы. При восстановлении, например, раствора вюстита в
МnО [FеО] • МnО + Н2 ↔ Fет + МnОт + Н2О (13)
константа равновесия зависит от активности FеО в растворе МnО
Кр
=
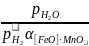 (14)
(14)
Восстановление твердым углеродом
Восстановление оксидов металлов твердым углеродом (углеродотермическое восстановление) можно представить уравнением:
МеОт + С = Мет + СО. (15)
Стандартное изменение энергии Гиббса для этой реакции:
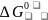 =
=
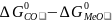 (16)
(16)
В зависимости от знака реакция может протекать в прямом направлении (в сторону восстановления металла) или в обратном. Например, восстановление вюстита происходит в случае:
≤ (17)
Известно,
что
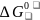 = 0 при
Т
= 0 при
Т 700°С. Следовательно, при температурах
выше 700°С в присутствии углерода вюстит
будет восстанавливаться до железа. При
более низких температурах реакция будет
идти влево и восстановление вюстита
углеродом не происходит.
700°С. Следовательно, при температурах
выше 700°С в присутствии углерода вюстит
будет восстанавливаться до железа. При
более низких температурах реакция будет
идти влево и восстановление вюстита
углеродом не происходит.
Однако эти рассуждения справедливы для случая, когда система находится в стандартных условиях, т. е. при рсо= 0,1 МПа. Положение кривой 4 (рис. 3), равновесие реакции газификации, зависит от давления в системе, поэтому при уменьшении давления кривая 4 (рис. 3) смещается влево и, следовательно, реакция (17) будет идти вправо при более низких температурах. Подобным образом можно рассмотреть и восстановление других оксидов.
В реальных условиях в большинстве случаев процесс усложняется. Так, углерод растворяется во многих металлах (Fе, Мn, Сr, W и др.), что приводит к образованию карбидов и изменяет величину и температуры равновесия реакции.
Если
температура восстановления оксидов
выше, чем температура испарения (или
кипения) металла, то процесс восстановления
можно представить уравнением:
МеОт
+ С =
Ме
+ СО.Для этой реакции
Кр
=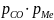
Характерным примером такой реакции является восстановление оксида цинка твердым углеродом. В зависимости от условий процесса образуется СО или СO2
ZnОт + С↔Znг + СО2; К1; (18)
2ZnОт + C ↔ 2Znг + СО2. K2 (19)
Равновесный состав газовой фазы можно определить в предположении, что в системе протекают независимые реакции:
ZnОт + СО ↔ 2Znг + С02; К3
= 334 609 — 439,ЗТ + 67,36 lg Т Дж; (20)
С + С02 ↔2СО; = 170821 — 174,58Г Дж; К4 (21) Znт↔Znг;
= 131214 — 181,28Т + 24,03lg Т Дж.
Используя уравнение баланса массы для оксида цинка
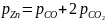 (22)
(22)
И константы равновесия
K3
=
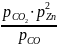
для реакции (20) и
К4
=
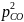 /
,
/
,
для
реакции (21) можно подставитьК3,
К4
например, в уравнение (22) для определения
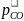
2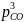 + К4
-
+ К4
-
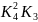 =
0.
=
0.
Состав газовой фазы как функции температуры представлен ниже
T, к |
|
К4 |
|
|
|
1200 |
4,96·10-3 |
48,4 |
0,49 |
5,0·10-3 |
0,500 |
1300 |
4,81·10-2 |
180 |
2,90 |
0,048 |
2,996 |
1400 |
0,331 |
556 |
12,93 |
0,328 |
13,586 |
Такой расчет требует уточнений, так как при давлении рZn выше упругости насыщенного пара цинка происходит его конденсация. Упругость насыщенного пара цинка можно определить,
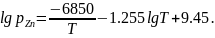 (24)
(24)
Величина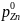 для
температур 1200, 1300 и 1400К составит 77,2;
192;
415 кПа соответственно. Поскольку при
температурах выше
1280К расчетные
значения давления пара цинка в равновесии
с
углеродом и ZnО
выше, чем упругость пара чистого цинка,
то
парообразный цинк конденсируется
до тех пор, пока его давление не будет
соответствовать равновесному с жидким
цинком
(
).
В
этой связи необходимо провести
корректировку рассчитанных
давлений
СО и СO2
при 1300 и 1400 К.
для
температур 1200, 1300 и 1400К составит 77,2;
192;
415 кПа соответственно. Поскольку при
температурах выше
1280К расчетные
значения давления пара цинка в равновесии
с
углеродом и ZnО
выше, чем упругость пара чистого цинка,
то
парообразный цинк конденсируется
до тех пор, пока его давление не будет
соответствовать равновесному с жидким
цинком
(
).
В
этой связи необходимо провести
корректировку рассчитанных
давлений
СО и СO2
при 1300 и 1400 К.
Используя константы равновесия К3, К1 для реакции (20) и К2 для реакции (21), можно получить
 = lg
К2
lg
- lg
К1
;
= lg
К2
lg
- lg
К1
;
lg = lg К1 lg ,
При подстановке в это выражениеК1, К2, для температур 1300 и 1400К определяются уточненные значения , и Робщ. Эти величины составляют 0,453; 4,44; 0,0114; 0,355; 0,656; 5,21 МПа, соответственно для , и Робщ. Для точных расчетов необходимо использовать летучесть вместо упругости пара металла.
При повышенных температурах может происходить восстановление оксидов углеродом, растворенным в металле (оксиды, как правило, в этом случае находятся в растворе). Такой вид восстановления имеет место, например, в горне доменной печи, где восстановление FеО оксидного расплава осуществляется углеродом, растворенным в чугуне. В этом случае процесс восстановления описывается уравнением: [С] + (МеО) = Ме + СО, для которого константа равновесия может быть выражена через активности растворенного углерода и оксида:
Кр
=
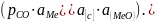
Контрольные вопросы:
1. Объяснить процесс восстановления газообразными восстановителями.
2. Объяснить термодинамику восстановления оксидов железа водородом и окисью углерода.
3. Объяснить процесс восстановление твердым углеродом
Лекция 3. Теоретические основы окислительной плавки Железоуглеродистые расплавы, их свойства и строение. Металлургические шлаки и их физические свойства. Взаимодействие фаз при окислительной плавке. Закономерности распределения кислорода между металлом и шлаком. Термодинамика окисления примесей металлического расплава.
План лекции:
1. Химический и минералогический состав шлаков.
2. Физико – химические свойства шлаков
3. Диаграмма плавкости шлаковых систем.
4. Термодинамика окисления примесей металлургического расплава (окислительное рафинирование)
Химический и минералогический состав шлаков.
В таблице 3 приведены составы шлаков некоторых процессов черной металлургии. В шлаках цветной металлургии, кроме SiO2, СаО, FеО, А1203, Мg0, имеется ZnО, например, при отражательной плавке медных концентратов, а также соединения ZnS, Ni3S2, МnS, Сu2S и др. В твердых шлаках встречается до 28 различных оксидов и элементов, образующих около 100 минералов, из которых наиболее часто встречаются оксиды, соединения типа шпинелей RО·R203, алюминаты, сульфиды, силикаты, алюмосиликаты, фосфаты и т. д.
Таблица 3. Химический состав шлаков черной металлургии.
Процесс |
Массовое содержание, % |
||||
SiO2 |
CaO |
Al2O3 |
MnO |
MgO |
|
Доменный |
36-42 |
40-46 |
8-18 |
2-3 |
2-10 |
Кислородно-конвентерный(в конце плавления) |
7.2-17.2 |
41.6-51.2 |
2.35-3.8 |
8.75-13.6 |
6.3-8.56 |
Электросталеплавильный основной (в конце плавления) |
15-25 |
35-45 |
3-6 |
5-10 |
5-8 |
Процесс |
Массовое содержание, % |
|||||
FeO |
Fe2O3 |
TiO2 |
CaF2 |
P2O5 |
S |
|
Доменный |
0.2-0.6 |
- |
- |
- |
- |
0,3-2,0 |
Кислородно-конвентерный(в конце плавления) |
9.4-16.2 |
3.7-5.0 |
- |
- |
2,1-3,6 |
- |
Электросталеплавильный основной (в конце плавления) |
5-20 |
- |
- |
- |
0,5-1,2 |
0,1-0,2 |
Часто ионные расплавы характеризуют по отношению суммы основных оксидов к сумме кислотных, которое называют основностью: основные оксиды — СаО, МgO, ВаО, FеО, МnО(RО); кислотные — SiO2, ТiO2, Р2O5, SnO2, В2O3, Аs2O5; амфотерные — А12O3, Fе2O3, Сr2O3,ZnO.В основных шлаках отношение RO/( SiO2+ТiO2+Р2O5)=1,5-2,5, в средних – 1-1,5, а в кислых ˂1.
Строение шлаков
Рентгеноструктурные исследования твердых оксидов и силикатов показали, что основные оксиды имеют решетку типа NаС1. Элементарной ячейкой различных модификаций SiO2 является тетраэдр, в центре которого расположен катион кремния, а по вершинам — четыре аниона кислорода. При малых концентрациях SiO2 в оксидных системах кремне- кислородные тетраэдры разделены катионами. С повышением доли SiO2 тетраэдры начинают объединяться вершинами, образуя цепочки, кольца и более сложные структуры.
Существование
различных комплексных анионов
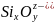 подтверждено
экспериментально. Например, обнаружены
анионы
подтверждено
экспериментально. Например, обнаружены
анионы
 ,
,
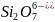 и др. Аналогично в фосфатах обнаружены
анионы
и др. Аналогично в фосфатах обнаружены
анионы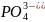 ,
Р2
,
Р2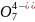 ,
Р3
,
Р3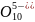 .
Рентгеноструктурные исследования
жидких оксидов SiO2, FеО, бинарных систем
СаО—SiO2, FеО—SiO2, МgO—SiO2 и других, показали,
что кремнекислородные тетраэдры
существуют как в жидком SiO2, так и в
силикатных расплавах более сложного
состава.
.
Рентгеноструктурные исследования
жидких оксидов SiO2, FеО, бинарных систем
СаО—SiO2, FеО—SiO2, МgO—SiO2 и других, показали,
что кремнекислородные тетраэдры
существуют как в жидком SiO2, так и в
силикатных расплавах более сложного
состава.
Эти
данные позволяют заключить, что жидкие
шлаки представляют собой ионные
расплавы, состоящие из одноатомных
катионов металлов, вносимых основными
оксидами, анионов кислорода О2- и
многоатомных кремнекислородных анионов
различной степени сложности: от
простейшего тетраэдра
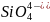 при малых концентрациях SiO2 до цепочек
большой протяженности и других
сложных структур, получающихся
полимеризацией тетраэдров при высоких
содержаниях SiO2.
при малых концентрациях SiO2 до цепочек
большой протяженности и других
сложных структур, получающихся
полимеризацией тетраэдров при высоких
содержаниях SiO2.
Катионы
алюминия, железа, ванадия как металлов,
дающих амфотерные оксиды, могут замещать
кремний в кремнекислородных тетраэдрах,
а могут находиться в октаэдрической
координации как катионы основных
металлов. Наряду с этим в шлаках допускают
наличие комплексных анионов
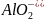 ;
А1O+; FеО2- , V02-;
;
А1O+; FеО2- , V02-;
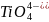 и др.
и др.
Фосфор
образует с кислородом, подобно кремнию,
устойчивые комплексные анионы,
простейшим из них является также тетраэдр
.
Эти простые анионы с повышением содержания
фосфора также могут быть полимеризованы
с образованием, например, Р2
,
Р3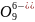 и
других более сложных комплексов.
и
других более сложных комплексов.
Сера находится в шлаках в форме одноатомного аниона, окруженного катионами основных металлов.
Электрическая проводимость большинства шлаков составляет 0,1 —1,0 Ом-1·см-1 и возрастает с повышением температуры, что характерно для ионных расплавов. Только при высокой концентрации ионов переменной валентности железа, марганца, хрома, ванадия, оксидные и оксисульфидные расплавы наряду с ионной обладают сравнительно высокой электронной проводимостью.
Физико – химические свойства шлаков
Плотность
Плотность объем является структурно-чувствительными свойством. Обычно изучают их зависимость от состава и температуры. Влияние состава определяется в основном изменением коэффициента упаковки или координационного числа и характеризуется изменением свободного объема. Зависимость от температуры связана с изменением межатомного расстояния вследствие увеличения амплитуды колебания атомов. Обе эти характеристики необходимы для расчетов кинетических свойств ионных расплавов, таких как вязкость, электрическая проводимость, коэффициенты диффузии.
В близи
температур плавления плотность FеО
составляет 4,8 (1673 К), SiO2—2,07 (2033 К) и МnО —
4,60 г/см3 (2123 К). Парциальные мольные
объемы компонентов в системе МnО—Si02
практически постоянны во всем диапазоне
составов, а в расплавах СаО—SiO2
иFеО—SiO2 они изменяются лишь вблизи
соединений (рис. 14, 15). Эти изменения
свидетельствуют о перестройке
структуры расплава вблизи составов,
соответствующих ортосиликатам.
близи
температур плавления плотность FеО
составляет 4,8 (1673 К), SiO2—2,07 (2033 К) и МnО —
4,60 г/см3 (2123 К). Парциальные мольные
объемы компонентов в системе МnО—Si02
практически постоянны во всем диапазоне
составов, а в расплавах СаО—SiO2
иFеО—SiO2 они изменяются лишь вблизи
соединений (рис. 14, 15). Эти изменения
свидетельствуют о перестройке
структуры расплава вблизи составов,
соответствующих ортосиликатам.
Рисунок 1. Изотермы мольных объемов квазибинарных расплавов МеО-Ме2SiO4 и Ме2SiO4- SiO2 при 1673К: 1- СаО—SiO2; 2- MnО—SiO2; 3- FeО—SiO2
Рисунок
12. Парциально-мольные объемы компоненты
в расплавах MеО—SiO2: 1,2-
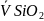 соответственно в расплавах FeО—SiO2 и
СаО—SiO2; 3-
соответственно в расплавах FeО—SiO2 и
СаО—SiO2; 3-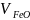
Рисунок 3. Влияние замены FeO на СаО в системе СаО-FeО—
SiO2 на плотность(1) и удельный объем(2) расплава.

Рисунок 4. Зависимость плотности расплавов системы СаО-SiO2-CaS от содержания CaS
Рисунок 5. Влияние содержания фторидов на плотность системы СаО-Al2O3 при 15500С
Парциальные
мольные объемы компонентов в тройных
и более сложных системах при данном
содержании SiO2 вдали от соединений
слабо изменяются при изменении состава.
Это позволяет использовать значения
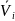 ,
полученные для бинарных сплавов, к
описанию концентрационной зависимости
объемов в более сложных системах:
,
полученные для бинарных сплавов, к
описанию концентрационной зависимости
объемов в более сложных системах:
Vшл
=
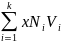 T=const
T=const
где Vшл – мольный объем шлака;
 – мольная
доля компонентов [индивидуальных оксидов
(Σ
– мольная
доля компонентов [индивидуальных оксидов
(Σ ]
]
 –
мольный
объем компонентов расплава.
–
мольный
объем компонентов расплава.
Мольные объемы квазибинарных систем МnО—Ме2SiO4 и SiO2 Ме2SiO4 линейно изменяются при изменении состава (рис. 1).
Влияние замены FеО на СаО в системе СаО—FеО—SiO2 на плотность ρ и удельный объем расплава, содержащего 21 — 25 % SiO2 приведены на рисунке 1. На рисунке 2 показано влияние СаS на плотность шлака при основности 1,0. На рисунке 3 приведено влияние фторидов на плотность расплавов системы СаО—А1203—MeF.
Плотность шлака определяется по формуле
ρшл=
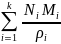
где
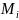 и
и
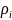 –
молекулярная масса и плотность компонента
шлака.
–
молекулярная масса и плотность компонента
шлака.
Поверхностные свойства
Значения поверхностного натяжения чистых оксидов вблизи точек плавления довольно высоки, мДж/м2: SiO2—390, МnО — 620, FеО — 630, А1203 — 670. В большинстве бинарных систем поверхностное натяжение линейно изменяется с концентрацией, причем замена одного основного оксида другим мало сказывается на значениях 0, а добавление SiO2 вызывает его линейное снижение (рис. 19, 20). Сравнительно слабые изменения σ при изменении состава обусловлены особенностями строения оксидных расплавов, состоящих из сравнительно крупных анионов кислорода, между которыми размещаются катионы металлов: Fе2+, Са2+, Мn2+, Мg2+, Si4+, Р5+. При введении в оксидный расплав сульфидов даже в случае близких значений энергии связи Ме-О и Ме—S поверхностное натяжение снижается, так как радиус аниона серы больше, чем кислорода и на каждой единице поверхности разместится меньше молей сульфида, чем молей оксида (рис. 21).

Рисунок 19. Изотермы поверхностного натяжения бинарных расплавов МеО ((Ме2О)-SiO2 вблизи ликвидуса
FеО—SiO2; 2- Mn—SiO2; 3- CaО—SiO2; 4- Mg—SiO2; 5- BaО—SiO2; 6- Li2О—SiO2; 7- Na2О—SiO2; 8- PbО—SiO2; 9- K2О—SiO2
Рисунок 20. Поверхностное натяжение расплавов, содержащих оксиж желеха, при 14000С

Рисунок 21. Влияние содержания CaS на поверхностное натяжение расплавов: 1,2,3-основность шлака соответственно 1,2; 1,0; 0,8.
С повышением температуры поверхностное натяжение уменьшается практически линейно.
Вязкость
Вязкость — структурно-чувствительное свойство, являющееся важной характеристикой расплавов, имеющей теоретическое и практическое значение. Вязкость шлаков находится, как правило, в пределах 0,1—1,0 Па·с, что на два порядка и более выше вязкости жидких металлов. Это объясняется наличием в шлаках сравнительно крупных единиц течения в виде кремне- кислородных комплексов различной степени сложности. Зависимость вязкости от температуры описывается уравнением Френкеля Я.И:
η = А ехр (Еη/RТ),
где Еη – энергия активации вязкого течения, необходимая для
Кроме того вязкость может быть описана уравнением Ле-Шателье:
ln·lnη=a-b·T;
и уравнением:
lnη=А-В/Т2
На рисунке 22 приведена зависимость вязкости от температуры основных (2) и кислых (3) шлаков. Влияние температуры на вязкость алюмосиликатных расплавов в зависимости от их состава приведено на рисунке 22. Вязкость системы СаО—SiO2—FеО—А1203 при 10 % А1203 и 1300°С представлена на рисунке 23.

Рисунок 22. Зависимость вязкости от температуры кислых (1) и основных (2) шлаков

Рисунок 23. Зависимость вязкости алюмосиликатных расплавов от температуры и состава

Рисунок 24. Диаграмма вязкости шлаков системы СаО—SiO2—FеО—А1203 при 10 % А1203 и 1300°С
Диффузия и электропроводимость в ионных расплавах
Знание коэффициентов диффузии Di необходимо при анализе кинетики высокотемпературных гетерогенных реакций с участием шлака: скорости этих процессов часто лимитируются диффузионными звеньями.
Плотность
диффузионного потока
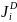 частиц i-го сорта можно определить
соотношением:
частиц i-го сорта можно определить
соотношением:
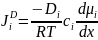 .
.
В
ионных расплавах диффузионный поток
ионов обусловлен не только градиентом
химического потенциала, но и
электростатическими силами. Плотность
полного потока заряженных частиц Ji
определяется градиентом электрохимического
потенциала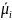 :
:
=
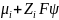 ,
,
где
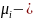 химический потенциал i-й частицы;
химический потенциал i-й частицы;
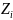 — ее заряд;
— ее заряд;
 —
электрический потенциал фазы; F —
постоянная Фарадея.
—
электрический потенциал фазы; F —
постоянная Фарадея.
В общем случае справедливо выражение
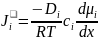
Удельная
электрическая проводимость ϰ
характеризует способность
ионов
сорта i переносить электрический заряд
под действием градиента электрохимического
потенциала. Диффузия ионов одного знака
может привести к накоплению электрического
заряда на межфазных границах, т. е. к
появлению градиента потенциала d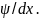 .
.

Рисунок 25. Зависимость электрической проводимости шлака, содержащего 50,05 % SiO2; 9,9 % А1203; 50,05 % СаО, от температуры
Количественная
связь
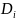 и η может быть описана соотношением
Писаржевского-Лазарева:
и η может быть описана соотношением
Писаржевского-Лазарева:
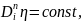
где
η =
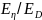 .-
величина постоянная для шлака данного
состава
.-
величина постоянная для шлака данного
состава
Температурная
зависимостьудельной электрической
проводимости выражается уравнением: ϰ
=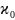 ехр (—
ехр (—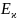 /RТ).
/RТ).
где – энергия активации электропроводности-это энергия, необходимая для перехода носителя тока из одного положения равновесия в другое.
На рисунке 25 представлена температурная зависимость электрической проводимости шлака системы СаО—SiO2—А1203.
При содержании оксидов переходных металлов более 10 % шлаки становятся смешанными проводниками. В ряде случаев может преобладать доля электронной проводимости, что может быть объяснено нарушением стехиометрии расплава.
Диаграмма плавкости шлаковых систем.
Подавляющее большинство шлаковых расплавов цветной металлургии относится к силикатам. Представление о фазовых превращениях, в частности о температуре плавления простейших силикатов, дают бинарные диаграммы состояния. Ряд таких диаграмм в высокотемпературной области представлен на рисунке 26. Бинарные силикаты окислов щелочных металлов образуют в жидком состоянии однофазные расплавы. Характерной особенностью всех диаграмм плавкости бинарных силикатов является наличие в средней области диаграммы (40—70% SiO2) одной или нескольких эвтектик, имеющих более низкие температуры плавления, чем исходные окислы SiO2 иМехОу. Для ряда бинарных силикатных систем характерно существование одного или нескольких устойчивых химических соединений. Так например, известны следующие устойчивые химические соединения 2FеО∙SiO2; МgO∙SiO2; К2O∙2SiO2; Nа2O∙2SiO2; 2 ZnО∙SiO2 и т.д.
Рассмотрим более подробно диаграммы состояния СаО — SiO2 иFеО — SiO2, составляющие основу шлаков цветной металлургии. Система СаО — SiO2 (рисунок 27) характеризуется наличием в твердом состоянии двух устойчивых химических соединений СаО-SiO2 (TПЛ=1540°С) и 2СаО∙SiO2 (Tпл=2130° С). Температуры плавления свободных окислов кальция и кремнезема равны соответственно 2570 и 1713° С.

Рисунок 26. Диаграммы состояния бинарных силикатов.
Кроме этих химических соединений, в системе имеются еще два соединения 3 СаО • SiO2 и 3 СаО • 2SiO2 устойчивые в ограниченном температурном интервале. Более острая форма максимума на линии ликвидуса для 2 СаО • SiO2 указывает на более высокую устойчивость этого соединения, по сравнению с СаО • SiO2. Для соединения СаО∙SiO2 характерны в твердом состоянии две коисталлические модификации β и α.

Рисунок 27. Диаграмма состояния системы СаО-SiO2.
Силикаты
железа и его окислы представляют собой
наиболее важную составляющую шлаков
цветной металлургии. Именно окислы
железа оказывают решающее влияние на
электропроводность, вязкость, потери
металлов. Железо дает несколько
степеней окисления, что сильно меняет
активность кислорода в расплавах,
концентрацию дырок и другие физические
и термодинамические свойства
расплавов. Для суждения о фазовых
превращениях в силикатах железа
рассмотрим диаграмму FеО—SiO2. Диаграмма
состояния этой системы приведена на
рисунке 28. Нужно сразу же отметить, что
при рассмотрении этой системы нельзя
пользоваться правилом фаз в видеС = К —
Ф+1. Число переменных параметров должно
быть равно двум, так как закись железа
является фазой переменного состава.
Переменная валентность железа в этой
системе предопределяет наличие в ней
фактически не двух (FеО и SiO2), а трех (еще
и Fе203) компонентов. Фактическое содержание
окиси железа в приведенной системе
при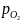 ≈10-13
ат показано в верхней части диаграммы
(рис. 28). При других давлениях кислорода
возможен и несколько другой ход линий
фазовых переходов и другое содержание
трехвалентного железа.
≈10-13
ат показано в верхней части диаграммы
(рис. 28). При других давлениях кислорода
возможен и несколько другой ход линий
фазовых переходов и другое содержание
трехвалентного железа.
В рассматриваемой системе установлено наличие одного устойчивого химического соединения — фаялита (2 FеО- SiO2) с температурой плавления 1205°С. О его незначительной прочности говорит пологий максимум на кривой ликвидуса. Шлаковые расплавы некоторых процессов цветной металлургии (например, конвертирования) на диаграмме расположены несколько правее фаялита и имеют температуру плавления ниже 1200°С. Для сплавов, богатых SiO2, наблюдается область расслаивания в жидком состоянии. Более высокий ионный потенциал Fе2+ по сравнению с Са2+ приводит к расслаиванию системы при более низких концентрациях закиси железа, добавляемой к кремнезему. Диаграмма состояния характеризуется двумя эвтектиками, имеющими темпертуру плавления 1177+2° С. В одной эвтектике (76% FеО, 24% SiO2) в равновесии находятся силикатный расплав, вюстит и фаялит. В другой (62% FеО, 38% SiO2) — силикатный расплав, тридимит и фаялит.

Рисунок 28. Диаграмма состояния системы FeО-SiO2
Тройные диаграммы состояния ближе соответствуют составу реальных металлургических шлаков, чем бинарные. Эти диаграммы можно использовать в первом приближении для определения границ ликвидуса шлаков различных пирометаллургических процессов, а также при оценке хода кристаллизации, последовательности выделения фаз и температур кристаллизации.
На рисунке 29 представлена тройная диаграмма СаО— SiO2 — А12O3, составляющая основу доменных шлаков. Она может представить интерес и для цветной металлургии в случае получения из шлаков железа. Эта диаграмма достаточно хорошо изучена в широкой области составов. На диаграмме выделены отдельные области, очерченные кривыми. Каждая такая область является проекцией поверхности ликвидуса пространственной тройной диаграммы на плоскость треугольника. Она выражает условия равновесия расплава с твердой фазой, состав которой для каждой области отмечен на диаграмме. Пересечения изотермических плоскостей с поверхностями ликвидуса нанесены на диаграмме в виде изотерм. Пограничные кривые, разделяющие области на диаграмме, являются проекцией пересечения поверхностей ликвидуса в пространстве. Они отражают условия равновесия двух твердых фаз с жидкостью при различных температурах. Внутри концентрационного треугольника имеются точки, отвечающие составам двух устойчивых химических соединений: А — соответствует анортиту СаО∙А12O3∙2SiO2, tпл=1550°С и В — гелениту 2СаО∙А12O3∙SiO2, tпл = 1590°С. Положение вершин устойчивых химических соединений отмечено на диаграмме зачерненными точками. Кроме того, в системе имеется ряд инконгруэнтно плавящихся химических соединений. Соединения образуют восемь двойных и тройных эвтетик с наиболее низкими температурами плавления, а также сложные перитетики.
На рисунке 30 представлена тройная диаграмма СаО—SiO2—FеО.В этой системе имеются расплавы с температурой плавления 1100-1200°С, например расплаву, содержащие 45% FеО, 20% СаО и 35% SiO2. Однако при содержании СаО свыше 45—50% температура плавления расплавов резко возрастает и, например, при содержании 50% СаO, 35% SiO2 и 15% FеО превышает 1600°С. Поэтому для разжижения высокоосновных шлаков в печах присаживают различные флюсы.

Рисунок 29. Тройная диаграмма системы СаО∙А12O3∙SiO2

Рисунок 30. Диаграмма состояния СаО—SiO2—FеО.
Термодинамика окисления примесей металлургического расплава (окислительное рафинирование)
Различие в величине сродства металлов к кислороду используется в процессах окислительного рафинирования черновых металлов.
В этих процессах создаются условия, в которых окисляются металлы — примеси и не окисляется основной металл. В результате добиваются практически полного удаления примесей при частичном окислении основного металла. Если окисел примеси не растворим в основном металле, он всплывает на поверхность и его удаляют и ванны. Практически необходимые для рафинирования условия получают при продувке через ванну воздуха. Ванна насыщается кислородом до необходимой концентрации. Окисление примеси при этом осуществляет главным образом за счет кислорода, содержащегося в ванне металла. Выплавляемые черновые металлы (медь, свинец) содержат до 97—99% основного металла, остальное — примеси, которые чаще всего находятся в черновом металле в растворенном состоянии, реже в виде соединений (с кислородом, серой, мышьяком и другими элементами), растворенных или взвешенных в виде частиц отдельной фазы в массе основного металла.
Высокотемпературное окислительное рафинирование металлов осуществляют в специальных печах. В печи находится расплав чернового металла, содержащий примеси и шлак. Рассмотрим термодинамические условия окислительного рафинирования металла (Ме) от примеси (Ме'), имеющей большее сродство к кислороду.
Окислительное
рафинирование возможно если
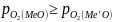 ,
т.е когда упругость диссоциации окисла
основного металла больше упругости
диссоциации окисла примеси. Поэтому
металлургам, чтобы добиться максимально
полного удаления примеси
Ме',
необходимо стремиться получать наибольшее
значение упругости диссоциации окисла
основного металла в печи. Поскольку
при рафинировании приходится иметь
дело практически с чистым металлом,
величина [Ме]
может быть примята постоянной. Таким
образом, единственным путем повышения
упругости диссоциации окисла основного
металла будет увеличение концентрации
его в металлическом расплаве. Обычно
это осуществляется в результате барботажа
металлической ванны воздухом или
кислородом.
,
т.е когда упругость диссоциации окисла
основного металла больше упругости
диссоциации окисла примеси. Поэтому
металлургам, чтобы добиться максимально
полного удаления примеси
Ме',
необходимо стремиться получать наибольшее
значение упругости диссоциации окисла
основного металла в печи. Поскольку
при рафинировании приходится иметь
дело практически с чистым металлом,
величина [Ме]
может быть примята постоянной. Таким
образом, единственным путем повышения
упругости диссоциации окисла основного
металла будет увеличение концентрации
его в металлическом расплаве. Обычно
это осуществляется в результате барботажа
металлической ванны воздухом или
кислородом.
Чтобы ответить на вопрос, до каких пределов целесообразно окислять ванну основного металла, в качестве примера рассмотрим окисление меди при ее рафинировании. При температуре рафинирования 1200°С предельная растворимость кислорода в жидкой меди составляет 12,4%. Поскольку равновесное давление кислорода над насыщенным раствором равно давлению над чистым окислом, дальнейшее повышение содержания кислорода в ванне больше 12,4% нецелесообразно.
Одновременно
с повышением упругости диссоциации
окисла основного металла нужно стремиться
уменьшить равновесное давление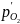 оксида примеси определяемого
уравнением
оксида примеси определяемого
уравнением
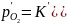 (1)
(1)
Согласно уравнению (1) для снижения и полного удаления примеси необходимо максимально снижать активность МеО в шлаке, что может быть достигнуто, если шлак, обогащенный Ме’О, непрерывно убирать из печи. В момент достижения равновесия упругость диссоциации окислов основного металла и примеси равны. Приравнивая уравнения и решая полученные равенства относительно концентрации металла, получим выражение
[Me′]
=K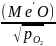 (2)
(2)
Из выражения (1) следует, что равновесное давление кислорода зависит также' от содержания Ме' в растворе меди. Чем меньше содержание примеси, тем оно больше.
Предельное содержание примеси, находящейся в ванне в истинном растворе в конечном итоге определяется равновесием реакции:
[МеО] + [Ме'] ↔ [Ме] + (Ме'О). (3)
Очевидно процесс окисления примеси рафинируемого металла будет протекать вплоть до установления равновесия в системе, определяемого константой равновесия обменной реакции:
K
=
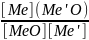 (4)
(4)
Фактическое содержание примеси будет определяться также и тем насколько полно были удалены взвешенные мелкие частицы окислов из ванны металла.
Влияние температуры на процесс не будет однозначным. С одной стороны, основная реакция окислительного рафинирования, как правило, экзотермична. Согласно правилу Ле-Шателье повышение температуры должно способствовать сдвигу равновесия реакции в левую сторону, что отрицательно скажется на результатах рафинирования. С другой стороны, повышение температуры в ряде случаев обеспечивает более высокую растворимость МеО в металле, а Ме'О в шлаке, что должно снизить конечную концентрацию примеси. В каждом конкретном случае этот вопрос требует отдельного решения.
Черновые
металлы содержат, как правило, не одну,
а несколько примесей, отличающихся
различным сродством к кислороду.
Учитывая, что упругость диссоциации
окислов зависит не только от стандартной
величины сродства к кислороду, но и от
концентрации данного металла в растворе,
последовательность удаления примесей
из металла не должна строго соответствовать
величинам стандартного сродства
металлов к кислороду, а будет определяться
исходными содержаниями примесей в
металле. Например, примесь, имеющая
более высокую упругость диссоциации
окисла, но содержащаяся в большом
количестве в металле, будет окисляться
в первую очередь. Обычно примеси
окисляются совместно, но в разной
степени, что зависит от термодинамических
характеристик. Совместному окислению
примесей способствует также различие
концентрации кислорода в разных участках
барботируемой ванны. Предельное
содержание примесей можно найти из
условия равенства упругости диссоциации
всех окислов примеси и основного металла
(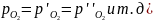
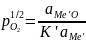 =
=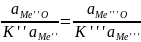 (5)
(5)
Процесс затрудняется, если МеО мало, а Ме'О наоборот значительно растворим в металле, если Ме'О образует стойкие соединения с другими примесями, растворимыми в металле.
В металлургической практике широко распространено окислительное рафинирование черновой меди и свинца. Рафинирование черновой меди должно протекать в более благоприятных условиях, чем рафинирование свинца. Это связано с тем, что растворимость окислов свинца в жидком свинце близка к нулю, а растворимость закиси меди в меди значительна. Различие в величинах растворимости резко сказывается на кинетике процесса. При температурах 1100—1200°С в жидкой меди растворяется 8,3—12,4% Сu20, тогда как до температур 800° С растворимость кислорода в свинце практически равна нулю. Несмешиваемость глета (РbО) и чернового свинца приводит к кинетическим затруднениям, вследствие перенесения реакции Ме'+РbО↔Ме'О+Рb на границу раздела Рb—РbО при недостаточно развитой, межфазной поверхности раздела. Обменная реакция осуществляется практически только на каплях свинца, которые образуются в факеле воздушной среды при продувке металла воздухом и на межфазной границе рафинируемый металл — шлак.
При наличии в черновой меди совместно значительных количеств никеля, мышьяка и сурьмы процесс удаления этих компонентов окислением встречается с большими трудностями. Это связано с образованием сравнительно прочных сиботаксисов в жидком металле, которые при кристаллизации меди дают медно- никелевые антимонаты и арсенаты — медно-никелевые слюдки. По формуле (95) можно рассчитать предельные теоретически возможные остаточные концентрации примесей в металле. Так, согласно данным А, П. Вольского, предельная концентрация остаточного железа в меди составляет 0,0011%, никеля 0,13%- В ряде случаев для снижения предельного содержания примеси в металле эффективен перевод образующихся окислов примеси в более сложное и прочное химическое соединение. Например, при рафинировании от никеля добавкой железной руды закись никеля можно связать в феррит (Ni0•Fе203). Добавкой соды или окиси кальция мышьяк и сурьму переводят в соответствующие арсенаты или антимонаты (Na3AsO4, Nа3Sb04). При образовании химических соединений из окислов примесей убыль термодинамического потенциала возрастает на величину термодинамического потенциала образования сложного соединения из окислов. Это, в свою очередь, приводит к уменьшению значения константы равновесия реакции окисления примеси и остаточного равновесного содержания ее в металле.
Растворенный в металле кислород взаимодействует с примесями, если сродство к ним больше, чем к железу. Поскольку коэффициент распределения кислорода между шлаком и металлом остается величиной постоянной, равной, например при 1600° С, 420, то кислород из шлака будет непрерывно поступать в металл. В этом случае окислительная способность шлака будет больше, чем окислительная способность металла. При интенсивном раскислении шлака в сталеплавильной печи, когда содержание FеО в нем снижается до 1—3%, окислительная способность его оказывается ниже окислительной способности металла, и кислород начнет переходить из металла в шлак. Таким образом, шлак в сталеплавильной ванне может быть источником кислорода для окисления примесей металла или может быть аккумулятором кислорода, поступающего из металла. Этими свойствами шлака широко пользуются на практике, повышая его окислительную способность путем присадки окислителей для удаления вредных и избыточных примесей и понижая его окислительную способность присадкой электродного порошка, алюминиевого порошка ит. д., для удаления кислорода из металла и восстановления необходимых элементов из шлака.
В изолированной системе металл—шлак, когда в эту систему не поступает кислород и окисляющиеся примеси, наступает при данной температуре момент равновесия, точнее состояние динамического равновесия, которое можно описать уравнением
(FеО) + [Ме]↔[Fе] + (МеО), (6)
где Ме — примесь металла;
МеО — его оксид.
Постоянная равновесия этой реакции будет иметь следующий вид
K
=
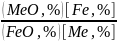 (7)
(7)
Постоянная равновесия определяется температурой и поэтому, меняя температуру ванны, можно изменять поведение примесей. В большинстве случаев с повышением температуры в записанном виде постоянная равновесия реакции уменьшается, и поэтому повышение температуры способствует восстановлению примеси, т. е. повышению ее содержания в металле.
Контрольные вопросы:
1. Рассказать химический и минералогический состав шлаков.
2. Рассказать физико – химические свойства шлаков
3. Объяснить диаграмму плавкости шлаковых систем.
4. Объяснить термодинамику окисления примесей металлургического расплава (окислительное рафинирование)
Лекция 4. Исходные материалы металлургического производства Руды, их характеристика. Значимость для промышленности страны. Принципы обогащения руд. Основы процессов окускования руд: агломерация и производство окатышей.
План лекции:
1. Минералы, руды, месторождения
2. Необходимость обогащения для экономичного использования минеральных ресурсов
3. Схема обогатительно-технологической системы
4. Методы обогащения
5. Агломерация
6. Производство окатышей
Минералы, руды, месторождения
Минерал — природное химическое соединение приблизительно однородное по составу и физическим свойствам, образующееся в результате физико-химических процессов в земной коре. Руды состоят из минералов. В земной коре наиболее распространены следующие химические соединения: силикаты — около 25 %, оксиды и гидрооксиды — 12, 5 %, сульфидные соединения и их аналоги — 14 %, фосфаты и их аналоги — 18%. Известно более 2500 естественных минеральных видов.
Из большого числа известных в природе минералов промышленный интерес представляют лишь несколько сотен. В рудах принято различать минералы, содержащие ценные компоненты и минералы вмещающих пород. Таких минералов насчитывается более 200 (табл. 6). Они сосредоточены в верхнем слое земной коры, составляющей всего около 1% массы земли.
Месторождением (природной геохимической аномалией) называется скопление полезного ископаемого (содержащее ценные компоненты) на поверхности или в недрах земли, которое по количеству, качеству, условиям залегания и технологической пригодности может быть использовано в промышленности. Месторождения, использование которых при существующем уровне развития техники и технологии экономически целесообразно, называются промышленными.
Месторождения состоят из одного или нескольких рудных тел определенного состава. Их формирование происходит в некоторый период времени (стадии) в определенных геологических и физико-химических условиях. Число таких стадий обычно достигает четырех-шести, иногда — десяти.
В верхних частях рудных тел могут находиться минеральные массы первичного гидротермального этапа и этапа, обусловленного вторичным окислением минералов вблизи поверхности земли.
В зависимости от области промышленного применения среди минеральных ресурсов выделяют:
а) топливно-энергетические (нефть, природный газ» ископаемый уголь, горючие сланцы, торф, урановые руды);
б) рудные, являющиеся сырьевой базой черной и цветной металлургии (железные, марганцевые, хромовые руды, бокситы, полиметаллические руды, медно-никелевые, вольфрамо-молибденовые, оловянные, руды благородных металлов и др.);
в) горно-химическое сырье (фосфориты, апатиты, поваренную, калийные и магнезиальные соли, серу и ее соединения, барит, борные руды, бром — и йодосодержащие растворы);
г) природные строительные материалы и нерудные полезные ископаемые, а также поделочные, технические и драгоценные камни (кварцевые пески, глины, известняки мрамор, гранит, яшму, агат, горный хрусталь, гранат, корунд, алмаз и др.);
д) гидроминеральные (пресные и минерализованные подземные воды). В месторождении содержание соответствующего элемента превышает его среднее содержание в земной коре.
Таблица 1. Наиболее часто встречающиеся минералы при обогащении.
Вид минералов |
Количество |
Химическая формула |
Самородные |
12 |
Металлы – Au, Ag, Pt, Cu, Ir, Os, Bi, Sb
Неметаллы – C(графит), С(алмаз), S, As |
Интерметаллические соединения |
13 |
AsSb, Ag3Sb, NiAs, NiSb, PbSe и другие |
Соли |
174 |
Сульфиды (46) -простые(21) Ag2S (аргентит), PbS (галенит), ZnS (сфалерит), FeS2 (пирит), MoS2 (молибденит), Cu2S (ковемин) и др. -сложные (25) CuFeS2 (халькоперит), Cu5FeS4 (борнит), FeAsS (арсенопирит), и др. Галогениды (5) CaF2 (флюорит), KCl (сильвин) и др. Сульфаты (12) PbSO4 (англезит), BaSO4 (барит) и др Карбонаты (11) CaCO3 (кальцит), FeCO3 (сидерит), ZnCO3 (смитсонит), PbCO3 (церуссит) и др Силикаты (71) CuSiO3 (хризокола), Zu2SiO4 (виллемит), Na(AlSiO4) (нифелин), LiAl(SiO3)2 (слодумен) и др Прочие соли: нитраты, бораты, хроматы, фосфаты, арсениды, ванадаты, молибдаты, вольфраматы Ca5[PO4]3(Fe,OH,Cl) (аматит), CaWO4 (шеелит), PbCrO4 (крокоит) и др |
Оксиды |
36 |
Fe2O3 (гематит), Fe3O4 (магнетит), TiO2 (рутил), SiO2 (кварц), Al2O3 (корунд), Сu2O (куприт), ZnO (цинкит), MnO2 (пиролюзит), (Mg,Fe)TiO2 ильменит |
Русский ученый А. Е. Ферсман ввел понятие «кларк», определив его как среднее содержание элемента в земной коре, выраженное в процентах (например, кларк кислорода 46,60; кремния 27,72). Для оценки концентрации элементов в месторождении В.И. Вернадский ввел термин «кларкконцентраций» — показатель степени концентрирования элемента в отдельном месторождении по сравнению с геохимической концентрацией» В связи с этими понятиями руду можно определить как отложение, в котором кларк концентрации некоторого элемента достигает величины, достаточной для рентабельного извлечения. В таблице 7 приведены оценки концентрации некоторых металлов, характеризующих рудные скопления.
Концентрация химического элемента в промышленных месторождениях обычно превышает его среднее содержание в литосфере в десятки и сотни раз (табл.8).
Некоторые элементы, которые играют важную роль в экономике и давно известны, в действительности достаточно редки. Например, медь менее распространена, чем цирконий, распространенность свинца сравнима с распространенностью галлия, а ртуть встречается реже, чем любой из редкоземельных элементов. Вместе с тем относительно распространенными являются некоторые мало используемые элементы: рубидий находится в природе в количествах, сравнимых с никелем; ванадий значительно более распространен в природе, чем олово, скандий — чем мышьяк, а гафний, один из последних открытых элементов, более распространен в природе, чем йод. Доступность элемента в значительной степени зависит от его способности образовывать индивидуальные минералы. Наиболее трудно извлекаются рассеянные элементы: индий, рубидий, галлий, гафний, рений и др.
Количество элементов, находящихся в рассеянном состоянии, во много раз превышает их количество, концентрирующееся в рудных месторождениях. Глинистые минералы содержат больше алюминия, чем боксит, но технология получения алюминия из глинистых минералов менее экономична. Магний извлекают из морской воды, где его концентрация 0,13%, хотя имеются громадные по запасам месторождения оливина, содержащего около 13% магния. Иногда использование определенных редких элементов обусловлено не только их полезными свойствами, но и возможностью их попутного получения при добыче более распространенных элементов.
По происхождению руды делят на коренные и россыпные. Коренные залегают в виде различной формы на некоторой глубине. Если рудные пласты выходят на поверхность, то под действием воды и солнца они разрушаются и образуют россыпи, состоящие из частиц — отдельных минералов.
Главными считают химические элементы, присутствующие в природных образованиях в количестве свыше 1 %, второстепенными—0,1+1%, микроэлементами—прочие, распространенность которых ≤ 0,1%.
По числу главных элементов, находящихся в рудах, их делят на моно- и полиметаллические. Название главного элемента определяет название руды: медные, медно-цинковые и т. д.
Необходимость обогащения для экономичного использования минеральных ресурсов
Целью обогатительных процессов является концентрирование полезного ископаемого (минерала), содержащего данный химический элемент. Концентрирование осуществляется путем разделения минералов на основе их различий в физических и физико-химических свойствах и перевода в отдельные продукты.
Процессы концентрирования стали необходимы в связи с тем, что богатые месторождения в настоящее время практически исчерпаны и в эксплуатацию вводят все более бедные. Обогащению подвергают 70—80% добытых руд. Например, в цветной металлургии рентабельной является разработка руд с содержанием свинца, цинка, никеля и меди всего около 0,1—0,3%, молибдена—0,01%. Естественно прямая металлургическая переработка таких бедных руд либо вообще невозможна, либо не рентабельна. При обогащении получают концентраты, содержащие ценные компоненты в десятки, сотни и даже тысячи раз больше, чем руды. При этом сокращается в то же число раз объем сырья, поступающего на металлургическую переработку (табл.9).
Необходимость обогащения полезных ископаемых подтверждается зависимостью технико-экономических показателей металлургического передела от содержания металла в концентрате, поступающем на плав (табл. 10).
Таблица 9. Достигаемая степень концентрации при обогащении
Металл |
Содержание металла (массовая доля) |
Степень концентрации |
|
в руде α, % |
в концентрате β, % |
β/α |
|
Сu |
0.5 |
30 |
60 |
РЬ |
1.0 |
60 |
60 |
Мо |
0.1 |
50 |
500 |
Для угля эффект меньше по объему, но значителен по качеству. Например, уменьшение содержания золы в угле от 13 до 6 % повышает его калорийность на 20 %. Значительно возрастает эффективность использования фосфоритовых и апатитовых концентратов как удобрений в сельском хозяйстве.
Стоимость механического удаления породы, например, магнитной сепарацией на фабриках в пять-десять раз дешевле, чем переплавка ее в доменной печи.
Схема обогатительно-технологической системы
Обогатительно-технологическая система включает схемы дробления и измельчения, собственно обогащения, обезвоживания концентратов, складирования хвостов и кондиционирования оборотных вод (рис. 31)
На обогатительную фабрику руду доставляют с месторождения обычно в виде кусков, максимальный размер которых ограничен 1200 мм при добыче открытым способом на карьере и 700 мм — при разработке подземным способом.
В таких кусках руды ценные минералы находятся в виде вкраплений (включений), распределенных в монолитной массе породы. Поскольку носителем индивидуальных свойств являются минералы, представленные в виде отдельных зерен, использовать различие этих свойств возможно только после предварительного разъединения руды на отдельные частицы мономинерального состава и определенной крупности.
Каждый тип руды характеризуется относительно устойчивым соотношением минералов и преимущественным размером их вкраплений. Например, руды цветных металлов являются тонковкрапленными, преобладающий размер минеральных вкраплений в них составляет 0,02-0,2 мм. Даже в самой простой медной сульфидной руде медь представлена в руде минимум пятью медными минералами (халькозин, борнит, халькопирит, малахит, хризоколла) и большим числом породных минералов (кварц, кальцит, доломит и др.). Следовательно, из исходных кусков руды крупностью, например 1200мм необходимо выделить включения медных минералов, размер которых составляет 0,02-0,2 мм, что возможно за счет снижения конечной крупности частиц в 6*103 -6*104 раза.
После сокращения крупности кусков дроблением и измельчением образуется смесь минералов, в которой всегда присутствуют частицы различных сортов: медные минералы, сростки медных минералов с пустой породой, пустая порода (рис. 32).
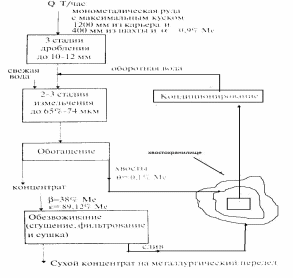
Рисунок 31. Структурная схема обогатительно-технологической системы на примере монометаллической руды

Рисунок 32. Частицы различных сортов, образующиеся после дробления и измельчения (1 - чистые минералы, содержащие только медь; 2 – сростки минералов меди; 3 — пустая порода).
Частицы каждого сорт имеют различную крупность. Различают сростки медных минералов и последних с породой. Состав сростков разнообразен: от богатых до бедных по меди, от двойных (из двух минералов) до сложных (три-четыре минерала). При определенной крупности частиц руда «вскрывается», т. е. достигается оптимальное заранее заданное количество чистых минералов. Избежать присутствия определенной доли сростков в смеси минералов не удается практически никогда. Поскольку практически достигаемая степень сокращения крупности при дроблении и измельчении в среднем составляет 3-5 раз, то за одну операцию разрушения кусков невозможно достичь требуемой конечной крупности кусков руды и оптимальное вскрытие достигается после 2-3 операций дробления и 2-3 операций измельчения.
Исходная руда и продукты ее дробления уже после первых операций разрушений содержат готовый по крупности продукт. Его целесообразно отделять путем грохочения и классификации. Готовым продуктом называют часть руды, размер кусков которой соответствует конечному вскрытию или размеру кусков какой-либо последующей стадии дробления или измельчения. Процессы дробления и грохочения, объединенные в технологическую последовательность операций, называют схемой дробления, а последовательность процессов измельчения и классификации — схемой измельчения. Процессы дробления, измельчения, грохочения и классификации называют подготовительными операциями, а схемы дробления и измельчения — схемами подготовки руды к обогащению.
Основные процессы—это процессы собственно разделения минералов, которые основаны на использовании различий в физических и физико-химических свойствах минералов.
В гравитационных методах обогащения используется различие в плотности минералов. Диапазон изменения плотности составляет от 1, 3 г/ см * для угля до 18 г/см3 для золота.
В магнитных методах обогащения — различие в удельной магнитной восприимчивости. Диапазон от 9-10-6 г/см3 для диамагнитного графита до 2-10-2г/см3 для ферромагнитного магнетита.
В электрических методах — различие в удельном сопротивлении. Диапазон от 10-4Ом см для проводника халькозина до 10-17Ом-см для изолятора циркона.
При флотационных методах решающую роль играет различие в смачиваемости минералов водой.
В специальных методах обогащения используются различия в люминесценции минералов, их природной или наведенной радиоактивности, форме частиц, прочности и др.
Гравитационные, магнитные, электрические и специальные методы обогащения относят к механическим, а флотационный — к физико-химическим.
Выбор метода обогащения во многом обусловливается крупностью руды, при которой она вскрывается (табл. 11).
Таблица 11. Классификация минеральных выделений по размеру и способы их извлечения из руд.
Минеральные выделения |
Преобладающий размер выделений, мм |
Методы и технологические процессы, применяемые для извлечения минеральных выделений |
Весьма крупные |
100-20 |
Радиометрическая сепарация |
Крупные |
20-2 |
Гравитационные. Отсадка, обогащение в тяжелых средах (суспензиях), магнитные |
Мелкие |
2-0,2 |
Гравитационные. Концентрация на столах, обогащение в тяжелых средах, магнитные электрические, флотационные (пенная сепарация) |
Тонкие |
0,2-0,02 |
Флотационные, гравитационные (концентрация на специальныхстолах), гидрометаллургия |
Весьма тонкие (эмульсионные) |
0,02-0,002 |
Флотационные, гидрометаллургия |
Субмикроскопические |
0,002-0,0002 |
Гидрометаллургия |
Коллоидно-дисперсные |
<0,0002 |
Тоже |
Методы обогащения
Основные задачи обогащения решаются применением тех или иных методов разделения, в основе которых лежит различие ряда физических свойств минералов.
Основными методами обогащения руд цветных металлов являются флотация и гравитация. Из других методов обогащения, используемых при обработке руд цветных металлов, следует назвать магнитную сепарацию, ручную рудоразборку и электростатическое обогащение. В большинстве случаев они являются вспомогательными методами.
Флотацией называется способ обогащения, основанный на избирательном прилипании минеральных частиц, взвешенных в пульпе, к пузырькам воздуха. Плохо смачиваемые водой частицы минералов прилипают к пузырькам воздуха и поднимаются вместе с ними на поверхность пульпы, образуя на ней минерализованную пену. Частицы других минералов, хорошо смачиваемых водой, не прилипают к пузырькам и остаются в пульпе. Таким образом достигается разделение различных минералов.
Флотационное разделение возможно только с применением флотационных реагентов — органических и неорганических соединений. В зависимости от назначения флотационные реагенты делятся на собиратели, пенообразователи, депрессоры, активаторы и регуляторы среды. Собиратели (коллекторы) — реагенты, избирательно уменьшающие смачиваемость определенных минеральных частиц водой. При воздействии собирателей обеспечивается прилипание таких частиц к пузырькам воздуха. Важнейшими собирателями при флотации руд цветных металлов являются калиевые (реже натриевые) ксаитогенаты. В качестве пенообразователей (вспенивателей) чаще всего используют алифатические спирты, фенолы, крезол и ряд других синтетических продуктов на основе оксидов пропилена и этилена и др. Вспениватели уменьшают межфазное натяжение на границе жидкость — воздух, что способствует образованию более мелких пузырьков воздуха в пульпе, а следовательно, прочной и устойчивой пены. Депрессоры (подавители) задерживают флотацию какого-либо минерала, как бы подавляют его. Они способствуют образованию на минерале хорошо смачиваемой поверхности. Активаторы восстанавливают прежнюю флотируемость депрессированных минералов. Регуляторы среды используют для создания среды с определенными физическими и химическими свойствами, в которой наилучшим образом проявляется действие других флотационных реагентов.
Флотацию проводят в аппаратах, называемых флотационными машинами. По способу образования воздушных пузырьков и перемешивания пульпы эти машины делятся на механические, пневматические и комбинированные. В странах СНГ при обогащении руд цветных металлов почти исключительно применяют механические флотационные машины.
Схематически устройство одной камеры механической флотационной машины показано на рисунке 33. Пульпа поступает в приемную коробку 1, откуда по трубе 2 попадает на импеллер 3 и через статорный диск 4 выбрасывается в камеру. За счет разрежения, создаваемого импеллером, в трубу 2 через трубу 5 засасывается воздух. При смешивании с пульпой и под воздействием вспенивателя воздух диспергирует на мельчайшие пузырьки, которые поднимаются вверх и захватывают несмачивающиеся частицы. Образовавшаяся на поверхности пульпы пенаудаляется пеноснимателем 6 в желоб 7. Из камеры в камеру пульпа переходит через межкамерную коробку 8 с регулятором уровня 9.
В пневматических машинах (рис. 34) аэрации и перемешивание пульпы производятся сжатым воздухом, подаваемым через трубу, расположенную в центре камеры. Пневматические машины просты по конструкции, не имеют механических частей, но очень требовательны к гранулометрическому составу твердой фазы и трудно вводятся в действие после остановки вследствие забивания воздухоподводящих трубок, решеток и т. д.

Рисунок 33. Схема устройства камеры механической флотационной машины
Гравитационные методы обогащения проводят, как правило, в водной среде. Они основаны на различии скорости движения минеральных частиц различной массы в воде и применимы для. обогащения руд с достаточной разницей в плотностях разделяемых минералов и с примерно одинаковой крупностью частиц измельченной руды. Основными способами мокрого гравитационного обогащения являются отсадка, обогащение на концентрационных столах и в желобах (шлюзах). Разновидностью гравитационного обогащения является обогащение в тяжелых суспензиях, когда разделение минералов проводят в среде большой плотности. Отсадке подвергаются руды с крупностью частиц от 25 (реже до 50 мм) до 0,5—0,3 мм, а обогащению на столах — материалы крупностью от 4 до 0,1 мм и меньше.
Обогащение отсадкой основано на использовании разницы в скоростях падения минеральных частиц различной массы в восходящей струе воды. При отсадке руда разделяется на слои минеральных зерен. В верхнем слое концентрируются легкие минералы, а в нижнем — тяжелые.
Шлюзы используют для обогащения руд россыпных месторождений. Они особенно эффективны при плотности ценного минерала более 6— 7 т/м3. Шлюз представляет собой длинный наклонный желоб, по которому движется поток пульпы.
На дне шлюза в зависимости от крупности зерен и их свойств имеются трафареты (выступы, углубления, пороги) или мягкий покров из ворсистого или рифленого материала. Принцип действия струйного желоба схематически показан на рисунке 35.
Рисунок 34. Схема работы пневматической флотационной машины
(К — коллектор сжатого воздуха)
Одним из простых и совершенных методов гравитационного обогащения является обогащение в тяжелых средах (суспензиях), позволяющее разделять минералы даже с разницей в плотности до 0,1. Сущность этого метода заключается в следующем. Если смесь двух минералов поместить в среду с плотностью, промежуточной между плотностями этих минералов, то смесь разделится: легкий минерал всплывет, а тяжелый утонет.

Рисунок 35. Схема обогащения в струйном желобе: 1— пульпа; 2 — концентрат; 3— хвосты; 4 — промежуточный продукт
Рисунок 36. Схема действия магнитного сепаратора: 1—магнитные частицы; 2 —немагнитные частицы
В качестве разделяющей среды в промышленности чаще всего используют тяжелые суспензии, представляющие собой взвесь тонкого порошка твердых тяжелых веществ в воде. Утяжелителями могут служить магнезит (Fe304), галенит (PbS) или низкокремнистый ферросилиций — сплав железа с кремнием (15—17 % Si).
Магнитное обогащение (сепарация) основано на различии магнитной восприимчивости разделяемых минералов. Оно проводится в сильном магнитном поле, создаваемом постоянными магнитами из специальных сплавов (чаще) или электромагнитами. При движении руды в магнитном поле сепаратора одни частицы намагничиваются, притягиваются к полюсам магнита и затем выносятся из рабочего пространства, а другие—немагнитные частицы удаляются питающим транспортером.
Принципиальная схема разделения магнитных и немагнитных частиц в магнитном сепараторе приведена на рисунке 36.
Электростатический метод обогащения основан на действии электрического поля на зараженные частицы. Заряжаются частицы благодаря электризации в электрическом поле или на заряженном электроде, трением и другими способами.
При соприкосновении частиц обогащаемого материала с заряженным металлическим электродом электростатического сепаратора все частицы приобретают одноименный заряд. Частицы с большой проводимостью, получающие больший заряд, отталкиваются от электрода, а плохие проводники тока (диэлектрики) почти не заряжаются и не изменяют пути движения в сепараторе.
Окускование материалов
Окускование мелких материалов проводят окатыванием (грануляцией), брикетированием и агломерацией.
Окатыванием (грануляцией) называется операция укрупнения мелких фракций руд, концентратов и порошков, при которой материал скатывается в шаровидные почти геометрически правильные прочные окатыши (гранулы), сохраняющие свою форму и размеры при дальнейшей переработке.
Окатывание— сравнительно новый метод окускования. Промышленное применение он получил только в начале 60-х годов текущего столетия. Сейчас этот метод нашел широкое применение на предприятиях многих отраслей промышленности; включая и цветную металлургию. На новых предприятиях, как правило, вместо агломерации предусматривают окатывание. Преимуществом процесса является более высокая производительность при меньших капитальных и эксплуатационных затратах.
Технологическая схема окатывания включает следующие три операции: подготовку материалов к окатыванию, собственно окатывание и упрочнение сырых гранул. Первая операция предусматривает измельчение исходных материалов (в случае необходимости), подготовку их по гранулометрическому составу, увлажнение или подсушку и тщательное перемешивание компонентов шихты. Решающее влияние на результаты окатывания оказывает влажность исходной шихты. Оптимальная влажность при окатывании колеблется в пределах 6—12 %. Для получения более прочных окатышей иногда в шихту вводят связующие добавки. В цветной металлургии для этих целей чаще всего используют сульфит-целлюлозный щелок, сульфат натрия и известь.
Окатывание осуществляют в барабанных или чашевых (тарельчатых) грануляторах. Окатывание в барабанных грануляторах (рисунке 37, а) происходит следующим образом. При вращении барабана материал поднимается по образующей благодаря трению и частично за счет центробежной силы, пока не достигнет поверхности слоя, а затем скатывается вниз под действием силы тяжести. При качении окатыши «наматывают» на себя тонкие классы, растут и постепенно продвигаются по барабану в сторону разгрузки. Основным недостатком барабанных грануляторов является неоднородность окатышей по размеру. Это происходит вследствие того, что вблизи разгрузочного конца гранулы почти не растут из-за отсутствия свежей шихты. Поэтому барабанные грануляторы вытесняются в настоящее время чашевыми.

Рисунок 37. Схема движения материалов в барабанном (а)и чашевом (б) грануляторах
Чашевый гранулятор (рисунок 38) представляет собой тарель диаметром до 5,5 м с бортами высотой до 0,9 м, вращающуюся со скоростью около 4—7 об/мин. Угол наклона чаши (тарелки) может изменяться от 35 до 55°. При окатывании на чаше (см. рис. 37, б) отдельные окатыши поднимаются вместе с вращающейся тарелью на некоторую высоту, а затем скатываются по поверхности слоя свежего материала под углом естественного откоса. Чем крупнее окатыши, тем на меньшее расстояние они поднимаются и тем быстрее скатываются и пересыпаются через борт тарели по мере поступления новых порций исходной шихты. Таким образом, наиболее крупные гранулы циркулируют по небольшой траектории, а наиболее мелкие— по всей площади тарели, многократно соприкасаясь со свежим материалом. В результате этого наклонная чаша выдает более равномерные окатыши, чем барабанный гранулятор.
1— чаша; 2 — нож; 3 —рама; 4— электродвигатель; 5 — редуктор
Рисунок 38. Чашевой гранулятор.
Производительность чашевых грануляторов и крупностьобразующихся окатышей при прочих равных условиях зависят от скорости вращения тарели, угла ее наклона и высоты бортов. Во всех случаях увеличение продолжительности окатывания приводит к получению более крупных окатышей и снижению относительной производительности гранулятора.
Прочность сырых окатышей после грануляции обычно мала (до 15-20 Н/окатыш). Однако она может быть увеличена уменьшением содержания в них влаги, которую удаляют обычно искусственной сушкой при температурах выше 100 °С. В ряде случаев для упрочнения окатышей прибегают к прокалке (обжигу) при температуре до 1000°С и выше.
Брикетированием называется процесс окускования путем прессования рыхлых и пылевидных материалов в куски правильной и однообразной формы — брикеты. Придаваемая брикетам прочность обусловливается либо действием сил молекулярного сцепления в результате сближения отдельных частиц при прессовании, либо действием связующих веществ, обеспечивающих необходимое сцепление частиц. Поэтому по характеру связывания частиц различают брикетирование без добавок связующих и брикетирование с применением неорганических и органических веществ. В качестве неорганических связующих используют известь, глину, хлорид кальция и др. К числу органических веществ относятся пек, гудрон, смолы, уголь, сульфитный щелок и т. п. Перед прессованием исходные материалы подвергают подготовительным операциям: подсушке или увлажнению, измельчению, гранулометрической классификации, перемешиванию со связующими веществами и т. д. Сырые брикеты могут быть непосредственно направлены в металлургический передел. Однако чаще их дополнительно упрочняют сушкой, обжигом или пропариванием.

1 — рама; 2 — вал; 3 — загрузочная воронка; 4 — бандажи; 5 — вальцы
Рисунок 39. Валковый пресс.
Для брикетирования рудного сырья в цветной металлургии наибольшее распространение получили валковые и штемпельные прессы.
Валковый пресс (рис. 39) представляет собой два металлических вальца, вращающихся навстречу друг другу. На вальцы насажены сменные бандажи с углублениями по форме брикетов, изготовленные из высокопрочной стали. Прессуемый материал загружается сверху между вальцами. При вращении вальцов углубления совмещаются, и шихта, попавшая в них, прессуется в брикет. Давление в валковых прессах передается по сферической поверхности неравномерно, что создает неодинаковую прочность в различных частях брикета. Для уменьшения неравномерности давления брикетам придают каплеобразную или яйцевидную форму, небольшие размеры и массу до 0,2—0,3 кг. Брикетирование на валковых прессах проводят при давлении 5—10 МПа. Полученные брикеты падают на наклонный грохот для отделения мелочи (главным образом, шихты, прошедшей между валками) и направляются в металлургический передел. Валковые прессы являются наиболее простыми и дешевыми устройствами. Однако они имеют следующие существенные недостатки:
1)быстрый износ брикетных ячеек в бандажах;
высокая чувствительность к составу шихты и особенно к виду и содержанию связующих веществ;
зависимость качества брикетов от колебаний влажности исходной шихты.
Штемпельные прессы обеспечивают более равномерное сжатие и позволяют получать более крупные брикеты, обычно цилиндрической формы. Давление прессования в штемпельных прессах при брикетировании осуществляется путем одновременного сжатия загруженной шихты верхним и нижним штемпелями (пуансонами). Схема прессования на штемпельных прессах показана на рисунке 40. Штемпельные прессы отличаются периодичностью работы,, большими габаритами, сложностью конструкции, малой производительностью, большим расходом электроэнергии и необходимостью частой замены быстроистирающихся матриц.

1—6 — последовательность операций в цикле; 7— верхний штамп; 8 — питатель; 9 — нижний штамп; 10 — загруженная шихта
Рисунок 40.Схема прессования на штемпельных прессах.
Большой практический интерес представляют получающие все большее распространение кольцевые прессы, сочетающие свойственные валковым прессам непрерывность действия и относительную простоту конструкции с возможностью создания высоких давлений, присущих штемпельным прессам.
Агломерацией называется процесс спекания мелкой руды или концентратов в прочный, кусковой и пористый материал (агломерат).
Спекание происходит за счет частичного расплавления легкоплавких компонентов шихты, которые, смачивая куски более тугоплавкой породы, при последующем охлаждении сваривают их. Тепло для нагрева и оплавления шихты при агломерации окисленных руд получают за счет сжигания вводимого в шихту мелкого кокса (коксика). При агломерации сульфидных концентратов источником тепла является горение сульфидов самой шихты, причем одновременно со спеканием в этом случае происходит частичный или полный окислительный обжиг.
Горение топлива происходит за счет кислорода дутья, которое просасывается или продувается через слой лежащей на колосниковой решетке шихты.
На рисунке 41 приведен схематический разрез слоя шихты с указанием зон протекания основных процессов при агломерации с просасыванием воздуха.

1— зона агломерации (спекания); 2—. зона горения; 3 — зона воспламенения; 4 — зона сушки; 5 — зона сырой (переувлажненной) шихты; 6 — колосниковая решетка
Рисунок 41. Схема агломерации с просасыванием воздуха и распределение температуры по высоте слоя шихты.
Горючие компоненты шихты (топливо или сульфиды) вначале поджигаются на поверхности слоя шихты с помощью зажигательного горна. Горячие газы, пронизывая слой шихты, просушивают нижележащие слои шихты. Удаляющиеся пары воды создают в слое шихты поры, улучшающие его газопроницаемость. Затем шихта постепенно нагревается горячими газами до температуры воспламенения топлива (~700°С), что способствует интенсификации процесса горения и резкому возрастанию температур. При температурах около 1200°С происходит оплавление поверхности кусочков шихты за счет плавления наиболее легкоплавких составляющих шихты. При этом образуется небольшое количество жидкой фазы, необходимой для цементирования тугоплавких компонентов. После полного выгорания топлива на данном участке слоя шихты зона горения перемещается вниз, а поступающий сверху холодный воздух охлаждает шихту, что приводит к затвердеванию жидкой фазы и свариванию шихты в кусок агломерата.
Основными обязательными компонентами агломерационной шихты являются руда или концентрат и оборотный агломерат (возврат), которые перед загрузкой на колосниковую решетку увлажняют и тщательно перемешивают. В качестве возврата используют, как правило, мелкую фракцию агломерата предыдущих операций спекания. Введение оборотного агломерата в шихту способствует повышению ее газопроницаемости. Кроме того, частички уже оплавившегося материала являются наиболее легкоплавкими компонентами и служат как бы центрами возникновения жидкой фазы.
При спекании окисленных материалов в отличие от сульфидных к шихте добавляют коксик в количестве 7—8 % от массы твердой шихты.
Роль влаги в процессе спекания велика. Присутствие в шихте влаги в значительной мере определяет все показатели процесса и качество получаемого агломерата. При перемешивании увлажненной шихты, проводимом обычно в барабанных смесителях, мелкие частицы шихты окатываются в комочки. Это ведет к увеличению объема и газопроницаемости шихты. Кроме того, повышению газопроницаемости шихты способствует испарение влаги в процессе агломерации, что приводит к образованию в комках шихты пор. Для каждой шихты существует своя оптимальная влажность, отвечающая ее максимальному объему и обеспечивающая максимальную газопроницаемость. Оптимальная влажность для окисленных руд составляет 20—25 %, а для сульфидных шихт 4,5—6 %. Отклонение влажности от оптимальной более чем на ±15 % (отн.) приводит к снижению газопроницаемости шихты, резкому ухудшению показателей процесса, а иногда и к полному прекращению процесса спекания.
В ряде случаев в шихту агломерации вводят флюсы. Получающийся при этом офлюсованный агломерат более удобен для последующей плавки, так как является самоплавким.
При агломерации в слое шихты в зависимости от вида исходного сырья происходят следующие физико-химические процессы: горение углерода или сульфидов самой шихты, дегидратация соединений, разложение карбонатов или высших сульфидов, частичное восстановление оксидов или окисление (полное или частичное) сульфидов, образование силикатов или ферритов, плавление легкоплавких фаз и частичное шлакообразование.
Хорошая термическая подготовка приводит к направленному изменению фазового и химического состава обрабатываемого материала. В частности, образование фаялита (2FeO-SiО2) при агломерации облегчает протекание процессов шлакообразования и плавления при последующей плавке. В конечном итоге плавка агломерата по сравнению с сырой шихтой или брикетами всегда отличается более высокой удельной производительностью плавильного агрегата и меньшим расходом топлива или электроэнергии.
Для осуществления процесса агломерации в промышленных условиях почти повсеместно используют ленточные агломерационные машины непрерывного действия. Устройство агломерационной машины ленточного типа с просасыванием воздуха через слой спекаемого материала показано на рисунке 42. Агломерационная машина представляет собой длинную раму, по которой движется непрерывный ряд тележек- паллет. Движение и проталкивание паллет по направляющим рельсам осуществляется от привода через ведущее (большое) зубчатое колесо. Дно у паллет набрано из колосников. По коротким сторонам они имеют борта. В местах примыкания паллет друг к другу бортов нет. Каждая паллета имеет по четыре ходовых колеса. При движении паллеты образуют прямоугольный желоб, который заполняется слоем шихты, подаваемой из бункера с помощью маятникового питателя. Толщина слоя шихты составляет 250— 300 мм. Она регулируется срезающим ножом, который одновременно разравнивает поверхность шихты. Сразу после загрузки шихты паллета поступает под зажигательный горн и одновременно проходит над первой камерой разрежения. В этот момент горячие топочные газы и воздух начинают просасываться через ,слой шихты и зажигают содержащиеся в ней горючие компоненты. Горение шихты и ее спекание продолжаются в течение всего времени прохождения паллет под остальными камерами разрежения. К моменту прохождения паллетой последней камеры процесс агломерации должен закончиться. Если он не успеет завершиться, то нижний слой шихты останется неспеченным (брак). Далее тележка Скатывается по направляющему (малому) колесу, опрокидывается и с нее сбрасывается на колосниковый грохот готовый агломерат. Нижний продукт грохочения используется в качестве возврата.
Пустая паллета далее под действием силы тяжести скатывается по нижним наклонным направляющим, в голове машины захватывается ведущим зубчатым колесом и поднимается вверх под загрузку.
Зажигательный горн, расположенный над паллетами, отапливается природным газом или мазутом.
Размещенные под горизонтальным рядом паллет камеры разрежения имеют индивидуальное регулирование величины вакуума и соединены общим коллектором с дымососом (эксгаустером). Общая длина камер разрежения является рабочей длиной агломерационной машины. Ширина паллет определяет ее рабочую ширину.

1- привод, 2- бункер для загрузки «постели», 3- шихтовой бункер, 4-зележка- паллета, 6-камера разряжения, 7- каркас машины.
Рисунок 42. Агломерационная машина с площадью спекания 50м2 .
В цветной металлургии наибольшее распространение получили агломерационные машины с площадью всасывания 50 м2 (2х25 м) и 75 м2 (2,5х30 м). При скорости движения паллет 2,7—3 м/мин (~0,05 м/с) производительность агломашнн по шихте составляет 35—45 т/(м2-сут). Имеются примеры использования агломерационных машин с большей рабочей, площадью — до 200 м2 и более.
Окускование рудных материалов методом агломерации по сравнению с грануляцией и брикетированием является значительно более дорогим способом. Однако этот метод обеспечивает хорошую химическую и термическую подготовку шихты к плавке, что оказывает существенное влияние на работу плавильных аппаратов и улучшение их технико-экономических показателей.
Производство окатышей
Производство окатышей. Расширение использования бедных руд и особенно стремление к более глубокому обогащению их привели к получению тонкоизмельченных железорудных концентратов (менее 0,07 мм), для которых появилась необходимость найти новые пути окускования. В связи с этим начал развиваться так называемый процесс окатывания или окомкования. Этот процесс приобретает особое значение, когда фабрику окускования концентратов приходится строить не на металлургическом заводе. Объясняется это тем, что окатыши меньше разрушаются при перевозке, чем агломерат, особенно офлюсованный.
Процесс производства окатышей состоит из двух стадий: а) получения сырых (мокрых) окатышей; б) упрочнения окатышей (подсушка при 300—600 и обжиг при 1200—1350 °С). Схема производства окатышей на современной фабрике показана на рисунке 43. Исходную шихту: возврат (некондиционные окатыши), концентрат и в случае производства офлюсованных окатышей известняк загружают в бункеры 1, откуда она при помощи дозаторов выдается на сборный транспортер 2 и поступает в смесительный барабан 3. После смешивания шихта поступает по другому транспортеру в окомкователь или так называемый гранулятор 5. Для лучшего окомкования и обеспечения необходимой прочности к шихте добавляют связующее вещество, обычно бентонит (мелкодисперсная глина) в количестве 0,5—1,5 % и воду в количестве 8—10 %. В грануляторе при круговом движении шихта при помощи связующего вещества и воды постепенно превращается в гранулы — комки. При этом из гранулятора разгружаются только комки, достигшие определенного размера (шарики диаметром 10—20 мм).
Сырые окатыши после гранулятора 5 падают на обжиговую машину. Обычно применяют ленточную конвейерную машину, подобную агломерационной. Реже применяют для обжига окатышей другие агрегаты: шахтные печи, вращающиеся трубчатые печи, последовательно расположенные колосниковая решетка — вращающаяся трубчатая печь.
У конвейерных машин ширина паллет составляет 3—4 м, рабочая площадь спекания 100—500 м2 и производительность их равна 2500—9000 т/сут. Верх ленты перекрыт камерами в соответствии с делением на зоны сушки, обжига и охлаждения. Зона обжига составляет около 50 % от общей площади машины.

I— сушка; II— обжиг; III— охлаждение; 1— шихтовые бункеры; 2 — сборный конвейер; 3 — смесительный барабан; 4 — бункер для бентонита; 5 — тарельчатый гранулятор; 6 — обжиговая машина; 7 — вентиляторы; 8 — грохот
Рисунок 43. Схема производства окатышей.
В зоне сушки окатыши подогревают до 250—400 °С газами, поступающими из зон обжига и охлаждения. Циркуляция газов и удаление их в дымовую трубу осуществляются вентиляторами. В зонах обжига окатыши нагреваются до 1200-1350 °С продуктами горения газообразного или жидкого (мазута) топлива, просасываемыми через слой окатышей на колосниковой решетке машины. В зоне охлаждения окатыши охлаждаются принудительно подаваемым через колосниковую решетку воздухом. Охлажденные окатыши разгружаются на грохот. Фракцию > 5 мм отправляют для доменной плавки, а фракция 0—5 мм является возвратом. Время пребывания окатышей в зоне обжига равно 7—12 мин. Расход природного газа составляет 21—45 кг/т окатышей.
Основная цель обжига окатышей сводится к упрочнению их до такой степени, чтобы они в дальнейшем выдерживали транспортировку, перегрузки и доменную плавку без значительных разрушений. При этом в отличие от агломерации нельзя доводить процесс до перехода значительной части шихты в жидкое состояние. Если не ограничить верхний предел температуры (1320—1350 °С), то произойдет оплавление окатышей и сваривание их в крупные глыбы. В то же время понижение температуры обжига ниже 1200—1250 °С приводит к понижению прочности окатышей.
Обычно окомковывают магнетитовые концентраты. Основными физико-химическими процессами при обжиге являются разложение известняка, окисление магнетита, химические взаимодействия с образованием легкоплавких фаз, упрочнение окатышей, удаление серы.
При обжиге офлюсованных окатышей идет разложение известняка СаСО3 с образованием СаО и поглощением тепла. Поскольку атмосфера в зоне обжига окислительная, при температурах 900—1000 °С идет окисление магнетита до гематита: 2Fe3О4 + 0,5О2 = 3Fe2О3. Обычно в окатыше обнаруживается периферийная гематитовая зона и центральная зона с остатками магнетита. При температурах 1200—1350 °С появляется жидкая фаза из легкоплавких соединений, образующихся в результате химического взаимодействия составляющих шихты; в неофлюсованных окатышах это соединения из SiО2 и Fe2О3, в офлюсованных— ферриты кальция CaO-Fe2О3 и 2СаО * Fe2О3.
Упрочнение окатышей (спекание частиц в прочную гранулу) происходит преимущественно путем твердофазного (без участия жидкой фазы) спекания и отчасти путем жидкофазного. Первое заключается в том, что в результате нагрева поверхность частиц размягчается и в местах контакта друг с другом они спекаются (свариваются). Твердофазное спекание начинается при 800—900 °С, спекаются как гематит, так и магнетит. Жидкофазное спекание начинается при температурах 1200-1350 °С, когда, как отмечалось, появляются участки жидкой фазы. Она смачивает твердые частицы и при затвердевании скрепляет их; при этом по сравнению с твердофазным спеканием повышается прочность окатышей, но несколько уменьшается их пористость. Оптимальное количество жидкой фазы составляет 12-20%.
При обжиге сульфиды шихты (FeS2, FeS) окисляются, а образующийся газообразный оксид SО2 уносится газами; степень удаления сульфидной серы из неофлюсованных окатышей составляет 95-99%. При добавке известняка в шихту степень десульфурации снижается, так как S02 связывается в соединение CaSО4. Готовые неофлюсованные окатыши содержат < 0,003% S, офлюсованные 0,01-0,08 % S.
Свойства окатышей.
Крупность окатышей должна составлять 5—18 мм, допускается содержание не более 3% фракций крупностью менее 5 мм.
Холодную прочность окатышей определяют по величине усилия, необходимого для раздавливания окатыша, и результатам испытаний во вращающемся барабане, проводимых как и при испытании прочности агломерата. Усилие раздавливания составляет 1,5—2,5 кН на окатыш; барабанная проба (выход фракции крупностью более 5 мм) холодных окатышей составляет 82—97 % при норме не менее 95 %.
Горячую прочность (прочность при восстановлении) определяют по величине раздавливающего усилия восстановленного до определенной степени горячего или охлажденного окатыша, и по газопроницаемости и усадке восстанавливаемого слоя окатышей, находящихся под нагрузкой. Установлено, что горячая прочность сильно снижается по мере восстановления окатыша. Горячая прочность возрастает при увеличении плотности структуры окатыша, в частности, при обжиге с получением определенного количества жидкой фазы.
Восстановимость определяется удельной поверхностью доступных для газа-восстановителя пор и размером окатыша. Наилучшая восстановимость у окатышей, обожженных при 1000-1150 °С с упрочнением по твердофазному механизму и с пористой неоплавленной структурой. Но из-за малой прочности таких окатышей обжиг ведут при 1200-1350 °С. Появление при этих температурах жидкой фазы и оплавленных участков в окатыше несколько снижает восстановимость. Восстановимость падает по мере роста диаметра окатышей и особенно резко при диаметре более 16—18 мм.
По сравнению с агломератом производство окатышей характеризуется меньшим отсевом мелочи, дополнительным расходом топлива; у окатышей выше содержание железа и ниже основность, а себестоимость их производства примерно одинакова. Основным преимуществом окатышей является более высокая холодная прочность, что позволяет транспортировать их на большие расстояния; однако их горячая прочность ниже, и содержание мелочи в шахте печи при проплавке агломерата и окатышей выравнивается.
Металлизованные окатыши. В последнее время в доменном производстве опробованы металлизованные окатыши, в которых часть оксидов железа восстановлена до железа. Повышение степени металлизации окатышей на каждые 10% обеспечивают снижение расхода кокса на 4,5—6 % и увеличение производительности доменной печи на 5—7 %. На металлизацию расходуется топлива больше, чем кокса на восстановление железа в доменной печи, но это более дешевое и менее дефицитное топливо, чем кокс (уголь, природный газ).
Контрольные вопросы:
1. Дать понятие минералы, руды, месторождения
2. Показать необходимость обогащения для экономичного использования минеральных ресурсов
3. Объяснить схему обогатительно-технологической системы
4. Объяснить методы обогащения
5. Дать понятие агломерация
6. Рассказать производство окатышей
Лекция 5. Общая характеристика процессов доменной плавки. Движение шихты и газов в доменной печи, рациональное их распределение. Развитие косвенного и прямого восстановления в доменной печи. Образование чугуна и шлака. Процессы в горне доменной печи. Методы интенсификации доменного процесса. ГОСТы на чугун.
План лекции:
1. Возникновение и развитие доменного производства.
2. Доменная печь
3. Шихта доменной плавки
4. Чугуны, выплавляемые в доменных печах
5. Особенности движения шихты в доменной печи
Возникновение и развитие доменного производства.
По свойствам (в зависимости от содержания углерода) черные металлы делят на три группы: железо (техническое) —до 0,15 % С, сталь 0,15—1,7 % С, чугун 1,7—7 % С.
Железо в природе не встречается в чистом виде. В земной коре оно обычно находится в виде различных химических соединений, чаще всего с кислородом, в виде оксидов, смешанных с пустой породой, не содержащей железа. Извлечение железа из руд, т. е. получение его в металлической форме требует решения двух задач: 1) восстановления железа из его оксидов; 2) отделения восстановленного железа ог пустой породы. В древности производство железа осуществляли в так называемых сыродутных горнах, которые вырывали в земле, а позднее выкладывали из камня. В такой горн загружали руду в виде небольших кусков в смеси с древесным углем. Через отверстие у основания горна поступал воздух. При горении угля в нижней части печи развивалась довольно высокая температура ≥1000°С, а образующийся оксид углерода участвовал в восстановительных процессах. Размягченные восстановленные зерна железа слипались, образуя ком (крицу). По окончании горения крицу извлекали из горна и проковывали молотами. При этом из крицы, находящейся в тестообразном состоянии, выдавливались остатки пустой породы и после охлаждения отслаивались, а зерна сваривались в единое целое. Получавшийся таким образом металл служил для изготовления необходимых предметов и оружия.
Со временем этот примитивный способ получения металла (сыродутный процесс) совершенствовался с соответствующим улучшением качества железа и увеличением его производства. Совершенствование происходило по двум основный направлениям: 1) увеличение высоты печей, способствующее улучшению использования тепла отходящих газов н повышению температуры в печи; 2) применение специальных устройств для вдувания воздуха в печь. В результате значительного увеличения количества поступающего в печь воздуха повысилась температура в горне. Так сыродутые горны превратились в домницы — шахтные печи высотой 2—4 м. Как и в сыродутных горнах, металл получали в виде крицы, но вследствие более высокой температуры в домницах часто обнаруживали металл в жидком виде: вместо железа получали чугун, имеющий значительно более низкую температуру плавления.. Вначале чугун считали нежелательным продуктом и выбрасывали, затем начали использовать его в смеси с рудой. Оказалось, что при этом получать металл стало выгоднее, чем только из руды. Так одноступенчатый процесс получения железа непосредственно из руды был заменен двухступенчатым способом: 1) получение чугуна из руды; 2) передел чугуна в железо. Домница работала попеременно, то выплавляя чугун, то производя крицу. Позднее для передела чугуна в крицу стали приме нять специально приспособлен ные для этого печи, а конструкция домницы изменялась с целью лучшего приспособления ее для выплавки чугуна, Домница превратилась в доменную печь. На рисунке 44 , а приведен профиль одной из первых доменных печей.
Возникновение собственно доменного производства относят к середине XIV в. В последующие два—три столетия доменное производство развивалось медленно, в основном в результате увеличения высоты доменных печей и мощности воздуходувных устройств. В качестве топлива использовали древесный уголь. Производительность таких доменных печей составляла ~2 т/сут.
Быстрое истребление лесов, затруднявшее снабжение древесным углем металлургических заводов Западной Европы, и в первую очередь Англии, вызвало необходимость замены древесного угля другими видами топлива. В 1735 г. в Англии был выплавлен в доменной печи чугун на коксе (продукте переработки каменного угля). Однако только через столетие, в середине XIX в. большинство доменных печей Западной Европы было переведено на кокс. С 1828 г. в доменных печах начали применять нагретое дутье, что вызвало незначительное снижение расхода кокса и увеличение производительности.

А — одной из первых (полезный объем 28 м3, суточная производительность 1,5 т чугуна); Б — современной (полезный объем 5037 м3. суточная производительность ~ 12000 т чугуна)
Рисунок 1. Профили доменной печи.
В послевоенные годы основными направлениями технического развития доменного производства было совершенствование конструкций загрузочных устройств, воздухонагревателей, подготовки шихтовых материалов к металлургическому переделу, использование в плавке природного газа и кислорода, а также увеличение размеров доменных печей. Самые крупные доменные печи имеют объем >5000 м3 и производят чугуна >12000 т/сут
В России первые доменные печи появились около 1630 г. в районе г. Тулы. Однако по-настоящему черная металлургия России начала развиваться на Урале, где были сосредоточены большие запасы высококачественных железных руд и находились огромные массивы леса (для производства древесного угля). Начало выплавки чугуна на построенных по распоряжению Петра I Невьянском и Каменском заводах относится к 1701 и 1702 гг. К середине XVIII в. на Урале работали уже десятки доменных печей, намного превышающих западноевропейские как по размерам, так и по производительности.
Доменная печь
Основным агрегатом для извлечения железа из железных руд является доменная пень (рисунок 45). По принципу работы она относится к типу шахтных печей, т. е. таких, рабочее пространство которых вытянуто в направлении вертикальной оси. Практикой установлена оптимальная конфигурация внутреннего пространства печи — ее профиля. Горизонтальное сечение доменной печи представляет собой окружность, в вертикальном сечении печь состоит из пяти зон. Верхнюю ее часть, через которую производят загрузку шихтовых материалов, называют колошником. Основной частью печи по объему является шахта, представляющая собой усеченный конус. Самая широкая часть, распар, через заплечики (в форме обратного усеченного конуса) переходит в горн. Современные доменные печи имеют большие размеры. Так, диаметры колошника, распара, горна составляют соответственно: 7—8, 12—16 и 10—14 м. Общая высота внутреннего пространства доменной печи составляет 254-300 м, а с учетом того, что она несколько приподнята на фундаменте и что над колошником установлено загрузочное устройство и газоотводы, верхняя точка ее находится над поверхностью земли на уровне 60—70 м. В верхней части горна имеется большое число расположенных равномерно по окружности фурменных отверстий, через которые в печь подают воздух. В нижней части горна имеется несколько (2—4) отверстий, предназначенных для выпуска чугуна и шлака — чугунных и шлаковых леток. Внутренняя часть печи выложена огнеупорным кирпичом, сохранность которого в течение нескольких лет эксплуатации обеспечивается системой охлаждения.
1—доменная
печь;
2
— воздухонагреватели;3
— пылеуловитель;
4 —
бункерная эстакада
Рисунок 45. Общий вид доменной печи:
3.2.2. Шихта доменной плавки
Для обеспечения нормального хода металлургических процессов и получения чугуна заданного сорта доменную печь загружают шихтой, состоящей из трех основных частей, взятых в заранее рассчитанном строго определенном соотношении.
1.Железорудный материал (агломерат или окатыши) — продукты предварительной обработки железной руды, заключающейся в обогащении и окусковании. Железорудные материалы кроме основного компонента — рудного минерала (Fе20з и Fе304) включают некоторое количество других веществ, не содержащих железа. Эту часть руды называют пустой породой. В состав пустой породы входят оксиды: SiO2; А1203; СаО; Мg0 и др.
2.Кoкс — главный источник тепловой энергии, он выполняет также роль реагента-восстановителя. Основными компонентами кокса являются углерод (85 %) и зола (9—12 %).
3.Флюс — материал, необходимый для снижения температуры плавления пустой породы рудного материала и золы кокса. Чаще всего в качестве флюса используют известняк, содержащий 96—98 % СаС03. В этом случае СаО флюса улучшает также переход серы из металла в шлак, т. е. понижает концентрацию серы в чугуне, улучшая качество металла.
3.2 3 Общая схема доменного процесса
Сущность доменного процесса состоит в том, что из шихты восстанавливается основное количество железа, а затем, при более высоких температурах, в нижней части горна происходит разделение на слои расплавившихся чугуна и шлака вследствие их различных плотностей (плотность чугуна примерно в 2,5 раза больше плотности шлака). Общую схему доменного процесса можно представить следующим образом (рис. 46). В любой момент времени вся доменная печь заполнена шихтовыми материалами — от горна до колошника. Через фурменные отверстия, под давлением подают воздух, нагретый до 1000—1200 °С. Попадая в слой кокса, находящегося в горне, воздух быстро расходуется на его горение. На расстоянии ~2 м от стенки горна газ уже не содержит кислорода. Поскольку горение кокса в доменной печи происходит при недостатке воздуха, то конечным продуктом сгорания углерода является не С02, а СО. Образующиеся в горне печи продукты сгорания (содержащие СО и N2) с температурой ≥2000 °С направляются вверх. Нагревая шихту, газ охлаждается и выходит из печи через колошник (поэтому газ называют колошниковым) с температурой 200—300°С. При движении через шихту газ одновременно с теплообменными участвует в восстановительных процессах, в результате чего часть монооксида углерода СО превращается в диоксид углерода СО2.
Доменный процесс относится к типу противоточных — навстречу потоку поднимающегося газа опускается столб шихтовых материалов. Опускание шихты происходит под действием ее веса, а условием ее движения является освобождение пространства в нижней части доменной печи в результате сгорания кокса и плавления рудного материала и флюса. Периодически, через несколько минут в доменную печь через колошник загружают очередную порцию шихты.
Сразу после попадания в печь шихта начинает нагреваться и по мере непрерывного опускания последовательно идут следующие процессы: испарение влаги шихты, восстановление оксидов железа и некоторых других элементов, диссоциация карбонатов. Вследствие специфических условий плавки (наличия в печи восстановительной газовой атмосферы и сильного восстановителя— кокса) конечным продуктом переработки руд в доменных печах является не чистое железо, а чугун — железоуглеродистый сплав, содержащий 91—94 % Fе; 3,5—4,5 % С и 1—5 % других элементов.
На уровне нижней части шахты или в заплечиках при температурах > 1200 °С начинается образование первых порций расплавленных чугуна и шлака. Последний образуется из трех частей: пустой породы рудного материала, флюса и золы кокса. Расплавленные чугун и шлак в виде капелек, струй стекают вниз и накапливаются в горне, образуя два слоя: нижний — чугун и верхний — шлак. В результате процесса шлакообразования происходит расплавление пустой породы рудного материала, золы кокса и флюса, что способствует отделению их от восстановленного железа и облегчает удаление из доменной печи. Шлак является одним из основных регуляторов химического состава чугуна. В зависимости от состава шлака облегчается или затрудняется переход в чугун тех или иных элементов. Типичный состав доменного шлака, следующий, %: СаО 35—45; SiO2 36—38; А1203 7—15; МgО 4—10; МnО 0,5—1,0; FеО 0,4—0,8; S 1—2. Капельки чугуна, проходя через слой шлака в горне, освобождаются от большой части серы, чугун и шлак приобретает окончательный химический состав.

1 — колошник; 2 —шахта; 3 —распар; 4 — заплечики; 5 — фурмы для дутья; 6— шлаковая летка; 7 —шлак; 8— чугун; 9 — чугунная летка
Рисунок 46. Распределение основных химических процессов по высоте доменной печи.
Таким образом, одна из характерных особенностей доменного процесса заключается в том, что формирование химического состава чугуна происходит по мере движения вниз твердой шихты и расплавленных масс металла и шлака. Слой чугуна в горне, сколько бы он там ни находился, не изменяет своего химического состава. Со временем количество чугуна и шлака в горне увеличивается. Когда верхний уровень шлака приближается к горизонту фурм, требуется произвести выпуск чугуна и шлака из печи. С этой целью- открывают чугунную и шлаковую летки. После выпуска накопившихся продуктов плавки летки вновь закрывают. Следующий выпуск чугуна и шлака производят в зависимости от производительности доменной печи — через 1—2 ч. Таким образом, периодичность выпусков связана не с необходимостью получения заданного химического состава чугуна (образовавшийся чугун всегда готов к выпуску), а определяется существующей технологией обслуживания горна. Не исключено, что в случае разработки стойкой чугунной летки, не разрушающейся в течение длительного времени, чугун из доменной печи будут выпускать непрерывно. По описанной схеме, когда процесс плавки не прерывается ни на мгновение, доменная печь работает в течение нескольких лет.

1 — группа предприятий; обеспечивающих сырьем доменный цех; II — металлургические цеха; III— вспомогательные цеха
Рисунок 47. Структура предприятия с законченным металлургическим циклом.
Из рисунка 47, на котором представлена схема завода с законченным металлургическим циклом, видно, что доменное производство занимает головное положение в системе металлургического завода. Доменный цех не только дает металл, из которого в дальнейшем получают различную продукцию, но много газа, используемого в качестве топлива в различных нагревательных устройствах прокатных, термических, коксохимического, доменного и других цехов. Для нужд народного хозяйства используется и третий продукт доменной плавки — шлак (для производства некоторых изделий методом литья, в строительной промышленности как заменитель щебня, в качестве исходного сырья при получении цемента, при производстве шлаковаты и др.). Таким образом,доменное производство является безотходным.