
- •2 Вопрос
- •3 Вопрос
- •4 Вопрос
- •5 Вопрос
- •6 Вопрос
- •9. Назначение и области фазовых диаграмм.
- •10.Построение процессов реальных газов и их расчет с помощью фазных диаграмм.
- •11. Формулировка и математическое выражение первого закона термодинамики.
- •12. Теплота и работа как функции процесса. Аналитическое выражение теплоты и работы через параметры состояния. Графическое изображение.
- •13.Общая схема исследования термодинамических процессов идеальных газов
- •14.Аналитическое исследование изохорного процесса
- •15. Аналитическое исследование изобарного процесса
- •16. Аналитическое исследование изотермического процесса
- •17. Аналитическое исследование адиабатного процесса
- •22. Истечение без трения.Так как водяной пар не является идеальным газом, расчет его истечения лучше выполнять не по аналитическим формулам, а с помощью h, s-диаграммы.
- •27. Пусть тепловая машина состоит из нагревателя с температурой , холодильника с температурой и рабочего тела.
- •31.Цикл со смешанным подводом теплоты (цикл Тринклера)
- •34. Паросиловая установка по циклу ренкина
- •Принципиальная схема компрессорной холодильной машины:
1 вопрос
Основные понятия и исходные положения технической термодинамики
Тех. термодинамика – изучает свойства рабочих тел, законы взаимного превращения теплоты и работы, а также устройства в которых эти превращения реализуются.
Рабочее тело – вещество способное воспринимать теплоту и совершать работу. В качестве рабочего тела рассматривают газ, пар (то, что при расширении совершает работу).
Термодинамическая система – совокупность материальных тел и окружающей среды, между которыми осуществляется термодинамическое взаимодействие.
Идеальный газ – это модель газа, у которого отсутствуют межмолекулярные силы и объем молекул бесконечно мал по сравнению с объемом всего газа.
2 Вопрос
Технические параметры состояния рабочих тел. Единицы измерения. Уравнение состояния идеальных газов.
Параметры рабочего тела:
1.Основные:
- абсолютная температура Т (К)
-
абсолютное давление Р (А)
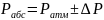
Вакуумное – мало; Избыточное – много; Абсолютное – нормально.
- удельный объем v (Па)
1бар
=
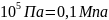
1АТ
= 98
1АТМ = 101325 Па
(А- атмосфера, Т-техническая, М-механическая)
1мм.рт.ст = 133,3 Па
1мм.вод.ст = 9,81 Па
2. Калорические (энергия)
-
внутренняя энергия U
(кДж)
 (
(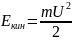 )
)
- энтальпия (теплосодержание) I(Н) (кДж) I(Н) = U + pV
-
энтропия S

3 Вопрос
Калорические параметры состояния рабочих тел.
Единицы измерения.
Внутренняя энергия
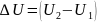 U=
Eкин + Eп (Eкин =
m
U=
Eкин + Eп (Eкин =
m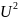 /2)
/2)Энтальпия – термодинамическое свойство вещества, которое указывает уровень энергии сохраненной в его молекулярной структуре. ( I(Н) = U + pV)
Энтропия - состояние термодинамической системы определяющее меру необратимого расширения энергии. (S=∆Q/T)
4 Вопрос
Газовые смеси. Законы газовых смесей.
Уравнение состояния для газовой смеси и компонентов.
Механическая смесь газов – совокупность газов, не вступающих в химическую реакцию друг с другом.
Виды долей определяющих состав смеси :
массовая доля
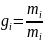
объемная доля

мольная доля
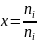
Газовые смеси
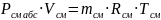

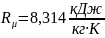 .
.
5 Вопрос
Теплоемкость идеальных газов. Виды теплоемкостей.
Связь между ними. Расчет количества тепла.
Теплоемкость
– показывает какое количество теплоты
необходимо подвести к телу, чтобы
изменить его температуру на 1 ( C
( C
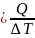
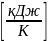 )
)
Виды теплоемкостей:
массовая
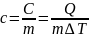
объемная

мольная

изобарная
изохорная
политропная
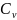 – массовая
изохорная теплоемкость
– массовая
изохорная теплоемкость
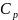 – массовая
изобарная теплоемкость
– массовая
изобарная теплоемкость
C´v – объемная изохорная теплоемкость
C´p - объемная изобарная теплоемкость
 – мольная
изохорная теплоемкость
– мольная
изохорная теплоемкость
μCp - мольная изобарная теплоемкость
Cn – массовая политропная теплоемкость.
Q
=
mCm t
t
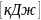 – определение теплоты.
– определение теплоты.
6 Вопрос
Зависимость теплоемкости идеальных газов от температуры.
Расчет количества тепла через средние температуры.






9. Назначение и области фазовых диаграмм.
Фа́зовая диагра́мма — это диаграмма состояния, которая отображает графическую систему равновесия бесконечной физико-химической системы при условиях, отвечающих координатам рассматриваемой точки на диаграмме.
Фазовые диаграммы нужны для определения различных процессов, таких как изотермический, адиабатный, изохорный, изобарный и политропный процессы.
Областями для построения фазовой диаграммы являются термодинамические параметры — температура и давление — и состав системы.

Фазовая диаграмма и ее области на примере воды.
10.Построение процессов реальных газов и их расчет с помощью фазных диаграмм.
Р еальный
газ – это газ существующий в природе у
которого присутствуют силы межмолекулярного
взаимодействия и молекулы имеют конечный
объем.
еальный
газ – это газ существующий в природе у
которого присутствуют силы межмолекулярного
взаимодействия и молекулы имеют конечный
объем.
