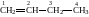Лекція 3. Ненасичені вуглеводні
План
Алкени. Гомологічний ряд, номенклатура, ізомерія.
Способи добування алкенів.
Фізичні та хімічні властивості алкенів.
Загальна характеристика та класифікація дієнів
Способи добування дієнових вуглеводнів
Фізичні та хімічні властивості.
Алкіни. Гомологічний ряд, номенклатура, ізомерія.
Способи добування алкінів.
Фізичні та хімічні властивості алкінів.
Поширення в природі ненасичених вуглеводнів та їх застосування в різних галузях сільського господарства.
Алкени (етиленові вуглеводні, етени або олефіни) – ненасичені вуглеводні з одним подвійним зв’язком і загальною формулою СnН2n.
В кожного ненасиченого атома Карбону гібридизується одна s- та дві р- орбіталі, одна р- орбіталь залишається вільною, тобто для алкенів характерна sp2-гібридизація. Валентний кут становить 120°. При цьому утворюються оптимальні умови для перекриття електронних орбіталей. Три такі орбіталі атома Карбону утворюють три σ-зв’язки (два С–Н та один С–С). р-електрони, що залишились у незмінному вигляді, утворюють ще один зв'язок між атомами Карбону. Орбіталь кожного такого електрона має вигляд об’ємної вісімки і розташована перпендикулярно до площини розміщення σ-зв’язків. Отже молекула етилену має 5 σ-зв’язків розташованих в одній площині і один π-зв'язок розташований перпендикулярно до площини σ-зв’язків. Всі атоми у молекулі утворюють між собою кут 120°.


Найпростішим членом ряду є етилен CH2=CH2, від назви якого походить назва всього ряду. Алкени утворюють гомологічний ряд, який можна записати виходячи з гомологічного ряду алканів віднявши два атоми Гідрогену. Гомологічний ряд алкенів: С2Н4, С3Н6, С4Н8, С5Н10, і т.д.
Номенклатура. За раціональною номенклатурою алкени розглядаються як похідні етилену, в яких атоми гідрогену заміщені радикалами. Так, вуглеводень СН3=СН–СН3 має назву метилетилен, вуглеводень СН3–СН=СН–СН2–СН3 метилетилетилен і т.д.
За номенклатурою IUPAC назва алкенів походить від назви відповідних насичених вуглеводнів, що має найдовший карбоновий ланцюг, причому cуфікс -ан замінюється суфіксом -ен (-єн) і цифрою вказується номер того атома Карбону, який зв’язаний з наступним Карбоновим атомом – подвійним зв’язком (положення кратного зв’язку). Нумерація ланцюга починається з того боку, до якого ближче розміщений цей зв'язок, наприклад:
|
|
бутен-1 |
2-метилпропен-1 |
|
|
Назви одновалентних залишків алкенів мають закінчення –енил, наприклад:
СН3–СН2–СН=СН– СН3–СН=С–СН3
1-Бутенил-1 2-бутенил-2
Деякі типові групи мають тривіальні назви, наприклад:
СН2=СН– СН2=СН–СН2– СН2=С–СН3
Вініл Аліл Ізопропеніл
Ізомерія. Ізомерія алкенів залежить від: 1) ізомерії будови ланцюга карбонових атомів: 2) положення подвійного зв’язку в ланцюгу. Існує ще й третя причина ізомерії алкенів: різне розташування атомів і атомних груп в просторі, тобто так звана просторова ізомерія, або цис-транс-ізомерія.
Структурна ізомерія (положення кратного звязку та ізомерія карбонового скелету) у алкенів починається з бутену С4Н10.
У ряді алкенів ми зустрічаємось зі стереоізомерією особливого роду – так званою цис- і транс-ізомерією, або геометричною ізомерією. Виходячи із природи -зв’язку, згідно з якою всі атоми етену лежать в одній площині і -зв’язок утворюється взаємодією електронних шарів особливої форми, які мають вигляд об’ємної вісімки, що виключає можливість вільного обертання навколо зв’язку С=С. Це приводить до просторової фіксації прилягаючих до цих карбонових атомів радикалів, які можуть розміщуватися по один або по різні боки від площини симетрії подвійного зв’язку, чим і обумовлена цис- і транс-ізомерія.
Як приклад, можна навести цис- і транс-ізомери бутену-2, формули яких зображено нижче:
|
|
(Z)-2-бутен Цис-ізомер |
(Е) -2-бутен транс-ізомер |
Ізомери, у яких однакові атоми (або атомні групи) розміщені по один бік від площини подвійного зв’язку, називаються цис-ізомерами; ізомери, у яких однакові атоми (або атомні групи) розміщені по різні боки площини подвійного зв’язку, називаються транс-ізомерами.