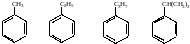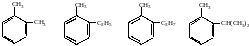- •Лекція 4. Ароматичні вуглеводні. Терпени
- •Загальна характеристика класу
- •Способи добування.
- •5. Фізичні та хімічні властивості.
- •Правила заміщення в бензольному ядрі
- •6. Поширення в природі. Застосування. Екологічні проблеми пов’язані з їх використанням. Канцерогенні сполуки
- •Багатоядерні арени
- •7. Загальна характеристика терпенів
Лекція 4. Ароматичні вуглеводні. Терпени
План
1. Загальна характеристика класу.
2. Номенклатура та класифікація аренів.
3. Ізомерія.
4. Способи добування.
5. Фізичні та хімічні властивості.
6. Поширення в природі. Застосування. Екологічні проблеми пов’язані з їх використанням. Канцерогенні сполуки
7. Загальна характеристика терпенів, терпеноїдів
Загальна характеристика класу
Ароматичними вуглеводнями (аренами) називають сполуки, які містять у своїх молекулах особливе циклічне групування з шести атомів карбону, послідовно сполучених один з одним простими і подвійними зв’язками, що чергуються. Це групування називають бензеновим ядром, або бензеновим кільцем. Замкнена система з трьох спряжених подвійних зв’язків, яка є в бензеновому ядрі, надає речовинам даної групи так званий ароматичний характер, тобто особливості, які помітно відрізняють ароматичні сполуки від насичених і ненасичених аліфатичних і аліциклічних сполук.
Назву “ароматичні сполуки” спочатку відносили до природних речовин, які мають приємний запах (смоли, бальзами та ін.). Останнім часом ця назва втратила своє значення, тому що ароматичні речовини зустрічаються серед інших класів органічних сполук, а більшість ароматичних сполук не має приємного запаху або ж зовсім не пахне, а деякі з них навіть мають неприємний запах. До початку другої половини позаминулого століття було відомо дуже мало ароматичних сполук. Починаючи з другої половини XIX ст. хімія ароматичних сполук почала інтенсивно розвиватися, а ароматичні сполуки широко застосовуватися в техніці і лабораторній практиці.
Критерії ароматичності сполук:
Молекула повинна бути циклічною та плоскою;
Молекула повинна мати замкнений ланцюг спряжених π-електронів;
Кількість π-електронів (N) у ланцюгу спряження повинно відповідати правилу Хюккеля N = 4n+2, де n = 1, 2, 3 і т.д. Звідси: ароматичністю володіє система з 6, 10, 14 і т.д. π-електронами.
В наш час клас арени об’єднує сполуки, що мають бензольні ядра. Їх поділяють на одно- та багатоядерні арени, а також арени з конденсованими ядрами.
До одноядерних належить бензен та його гомологи. Багатоядерні арени поділяють на: вуглеводні, в яких два або більше кілець сполучені безпосередньо один з одним (біфеніл); ди- і поліарилалкани (дифенілметан); вуглеводні з конденсованими ядрами, в яких одне або кілька кілець є бензоїдними (нафтален).

Вперше властивості бензену пояснив А.Кекуле (1865 р.) запропонувавши зображати структуру бензену у вигляді циклу, в якому чергуються прості та подвійні зв’язки.

Ця структура не пояснює симетрію та реакційну здатність бензену. Бензен не виявляє властивостей ненасичених сполук: реагує з бромом лише за наявності каталізаторів, при цьому відбувається заміщення а не приєднання; бензен стійкий до окиснення; важко гідрується. Рентгеноструктурне дослідження показало, що бензен є плоским правильним шестикутником з довжиною зв’язків 0,139 нм, а не чергуванням одинарних і подвійних зв’язків.
У теорії резонансу молекулу бензену розглядають як гібрид двох головних форм:

Дійсна структура молекули не відповідає цим формам і не є рівноважною сумішшю цих двох форм. Його структуру слід уявляти як змішану між цими двома формами.
Згідно з теорією молекулярних орбіталей атоми Карбону в молекулі бензену перебувають у стані sp2- гібридизації. За допомогою 3 валентних електронів атом Карбону зв’язаний з двома сусідніми атомами Карбону і атомом Гідрогену. Таким чином в ядрі бензену є 6 σ-зв’язків С-С та С-Н. Електронна хмара 4 електрона р, що не бере участь у гібридизації, має форму гантелі і зорієнтована перпендикулярно до площини кільця. З 6р-електронів утворюється суцільна π-електронна система, єдина для всіх атомів Карбону. Області найбільшої електронної густини розміщені по обидва боки від площини π-зв’язків. Таким чином, бензенове ядро має 6π-зв’язків. Сформовані два нерозривні кільця електронної густини обумовлюють хімічні властивості бензену та його похідних. Шість не гібридизованих 2р-орбіталей взаємодіють між собою і утворюють шість делокалізованих орбіталей, з яких 3 – зв’язуючі і 3 – розпушуючі. Це надає молекулі більшої стабільності в порівнянні з моделлю будови молекули бензолу за Кекуле з 3 подвійними зв’язками.

Саме тому найбільш близьким є уявлення молекули бензену у вигляді кола, вписаного в шестикутник.
 або
або

На основі даних рентгеноструктурного аналізу та інших фізичних методів (рефрактометрія, визначення дипольних моментів, УФ-, ІЧ- та ЯМР-спектроскопія, спектри комбінаційного розсіювання, електронографія тощо) встановлено:
1. Молекула бензену являє собою плоский правильний шестичленний цикл, у якому всі шість атомів карбону і шість атомів гідрогену розміщені в одній площині і утворюють правильний шестикутник з кутом 120°. Довжини всіх С – С-зв'язків однакові – 0,14 нм і мають приблизно середнє значення між довжинами простого (0,154 нм) і подвійного (0,134 нм) карбон-карбонових зв'язків. Довжини всіх зв'язків Н – С також однакові – 0,108 нм .
2. Молекула бензену симетрична, і має вісь шостого порядку, а не третього, як це випливає з формули А. Кекуле.
3. Ядра атомів і валентні електрони в молекулі бензену розподілені симетрично. Бензен є неполярною сполукою. Його дипольний момент дорівнює нулю (=0).
4. Бензен – діамагнітна сполука і має анізотропію магнітної сприйнятливості. Його молекула є симетричною в магнітному відношенні. Це свідчить про наявність у його молекулі делокалізованої системи -електронів в ароматичному ядрі, яка є причиною її кільцевого струму, який виникає при накладанні магнітного поля, і відповідно причиною магнітної анізотропії. Наявність у молекулі такої -електронної системи і діамагнітна анізотропія молекули є основною ознакою ароматичності органічних сполук.
5. Загальною властивістю бензену та інших ароматичних сполук є здатність їх -електронної орбіталі до деформації під впливом замісників і полярних реагентів. Під впливом замісників електронна густина в бензеновому ядрі може збільшуватись або зменшуватись.
Гомологічний ряд одноядерних аренів:
Заміщуючи в молекулі бензену атоми гідрогену алкілами, дістанемо гомологічний ряд бензену. При заміщенні атомів гідрогену в бензені насиченими алкільними радикалами одержимо гомологічний ряд бензену складу CnH2n-6, наприклад:
|
|
|
||||||
|
метилбензен |
етилбензен |
пропілбензен |
Ізопропілбензен |
|
|||
|
|
|||||||
о-метилтолуен |
о-етилтолуен |
о-пропілтолуен |
о-ізопропілтолуен |
|||||
Номенклатура За історичною номенклатурою метильне похідне бензену називають толуеном (толуолом), диметильне – ксилолом, ізопропілбензен – кумолом (куменом), вінілбензен – стирол (стирен), амінобензен –анілін, гідроксибензен – фенол (карболова кислота).
Для ізомерів положення з двома замісниками використовують префікси орто-, мета-, пара- (скорочено о-, м-, п-).
Радикали аренів, які зустрічаються найчастіше називають арилами.
Вуглеводень |
Радикали |
|||
|
|
|
|
|
Бензен |
Феніл |
орто-Фенілен |
мета-Фенілен |
пара-Фенілен |
|
|
|
|
|
Толуен |
орто-Толіл |
мета-Толіл |
пара-Толіл |
Бензил |
За раціональною номенклатурою бензенові вуглеводні прийнято називати як похідні бензену. Спочатку називають радикал, якщо їх декілька – дотримуються старшинства, додають префікс, якщо є декілька однакових і потім додають слово бензен, наприклад:
|
||
метилбензен |
етилбензен |
вінілбензен |
За номенклатурою IUPAC пронумеровані атоми Карбону вказують положення замісників. Нумерацію карбонових атомів бензенового ядра ведуть за годинниковою стрілкою, пам'ятаючи, щоб величина цифр у назві була найменшою:
|
|
1-етил-2-пропілбензен |
1,2-диметил-4-етилбензен |
Якщо бічний ланцюг аліфатично-ароматичної сполуки довший і більш розгалужений, то зручніше за основу назви брати бічний ланцюг, розглядаючи радикал феніл як замісник:

1,2-диметил-1-фенілпропан
Якщо одна з груп у сполучені зі словом «бензен» відповідає тривіальній назві речовини, то з цієї групи починається нумерація, наприклад:

2,4-динітротолуен
Ізомерія. Ізомерія гомологів і похідних бензену зумовлена ізомерією радикалів (замісників), їх кількістю та положенням у бензеновому ядрі. Сам бензен ізомерів не має, оскільки всі шість атомів гідрогену в його молекулі рівноцінні. При введенні в бензенове ядро замість атома гідрогену алкільного радикала або будь-якого іншого атома чи групи атомів можливе існування тільки одного продукту заміщення, тому що всі шість положень у бензеновому ядрі рівноцінні. У зв'язку з цим для однозаміщених бензену немає ізомерів, ізомерія яких була б викликана положенням радикала, атома або групи атомів у бензеновому ядрі. Отже, толуен, етилбензен ізомерів не мають. Однозаміщені бензену можуть мати тільки такі ізомери, ізомерія яких зумовлена ізомерією самого радикала, на який замінили атом гідрогену бензенового ядра.
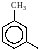
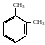
Ізомерія двозаміщених бензену пов'язана з положенням замісників (атомів або груп атомів, які заміщують у бензеновому ядрі атоми гідрогену), а також ізомерією самих радикалів і їх величиною. Двозаміщені бензену можуть мати замісники в 1,2-(орто-), 1,3-(мета) і 1,4- (пара-) положеннях. Диметилбензен (ксилен) існує у вигляді таких ізомерів:
|
|
|
|
|
о-диметилбензен або 1,2-диметилбензен |
м-диметилбензен або-1,3-диметилбензен |
n-диметилбензен або-1,4-диметилбензен |
||
Починаючи з метилпропілбензену крім о-, м-, n-ізомерів існують ізомери з ізомерними радикалами (о-, м-, n-метилпропілбензени і о-, м-, n-метилізопропілбензени) та ізомери, ізомерія яких викликана різною величиною радикалів (о-, м-, n-метилпропілбензени і о-, м-, n-діетилбензени).
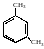
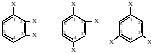
У тризаміщених бензену при трьох однакових замісниках можливо три ізомери, а саме 1, 2, 3 (суміжний), 1. 2, 4 (несиметричний) і 1, 3, 5 (симетричний):
|
||
суміжний |
несиметричний |
симетричний |
Якщо з трьох замісників два однакові, кількість ізомерних тризаміщених бензену дорівнює шести, а при трьох різних замісниках – десяти. Усі ці передбачені теорією ізомери одержані на практиці.