
IV a группа (углерод, кремний).
Углерод. Соединения углерода.
I. Углерод.
Углерод может проявлять как восстановительные, так и окислительные свойства. Восстановительные свойства углерод проявляет с простыми веществами, образованными неметаллами с большим по сравнению с ним значением электроотрицательности (галогенами, кислородом, серой, азотом), а также с оксидами металлов, водой и другими окислителями.
При нагревании с избытком воздуха графит горит, образуя оксид углерода (IV):
C + O2 = CO2
при недостатке кислорода можно получить СО
2C + O2 = 2CO
Аморфный углерод уже при комнатной температуре реагирует с фтором.
С + 2F2 = CF4
При нагревании с хлором:
С + 2Cl2 = CCl4
При более сильном нагревании углерод реагирует с серой, кремнием:
C + 2S = CS2
C + Si = SiC
При действии электрического разряда углерод соединяется с азотом, образуя диацин:
2С + N2 → N ≡ C – C ≡ N
В присутствии катализатора (никель) и при нагревании углерод реагирует с водородом:
С + 2Н2 = СН4
С водой раскаленный кокс образует смесь газов:
С + H2O = CO + H2
Восстановительные свойства углерода применяются в пирометаллургии:
C + CuO = Cu + CO
При нагревании с оксидами активных металлов углерод образует карбиды:
3С + СаО = СаС2 + СО
9С + 2Al2O3 = Al4C3 + 6CO
2C + Na2SO4 = Na2S + CO2
2C + Na2CO3 = 2Na + 3CO
Углерод окисляют такие сильные окислители, как концентрированные серная и азотная кислоты, другие окислители:
C + 4HNO3(конц.) = CO2 + 4NO2 + 2H2O
С + 2H2SO4 (конц.) = 2SO2 + CO2 + 2H2O
3C + 8H2SO4 + 2K2Cr2O7 = 2Cr2(SO4)3 + 2K2SO4 + 3CO2 + 8H2O
В реакциях с активными металлами углерод проявляет свойства окислителя. При этом образуются карбиды:
4C + 3Al = Al4C3
2C + Ca = CaC2
Карбиды подвергаются гидролизу, образуя при этом углеводороды:
Al4C3 + 12H2O = 4Al(OH)3 + 3CH4
CaC2 + 2H2O = Ca(OH)2 + C2H2
II. Соединения углерода.
Оксиды.
Оксид углерода (II).
Оксид углерода (II) несолеобразующий оксид. Очень ядовит!
В лаборатории получают действием концентрированной серной кислоты на муравьиную кислоту:
НСООН
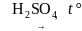 CO + H2O
CO + H2O
Химическая активность угарного газа крайне мала. При обычных условиях он не реагирует ни с водой, ни с кислотами, ни со щелочами. При высоких температурах вступает в окислительно-восстановительные реакции в роли восстановителя.
СО горит синим пламенем:
2СO + O2 = 2CO2
Восстанавливает металлы из их оксидов:
3CO + Fe2O3 = 2Fe + 3CO2
СО + CuO = Cu + CO2
СО + NiO = Ni + CO2
Взаимодействует с парами воды:
CO + H2O ↔ CO2 + H2
В присутствии катализатора или при облучении СО окисляется хлором, образуя ядовитый газ фосген:
CO + Cl2 = COCl2
СО окисляется пероксидом натрия:
CO + Na2O2 = Na2CO3
При нагревании с водородом при повышенном давлении образуется метиловый спирт:
CO + 2H2 ↔ CH3OH
При пропускании СО в расплав щелочи при высоком давлении образуется соль (формиат натрия) в результате протекания окислительно-восстановительной реакции:
CO + NaOH = HCOONa
Оксид углерода (IV).
Как кислотный оксид взаимодействует с водой (реакция обратима), основными оксидами и растворами щелочей:
CO2 + H2O ↔ H2CO3
CO2 + CaO = CaCO3
CO2 + 2NaOH (избыток) = Na2CO3 + H2O
CO2(избыток) + NaOH = NaHCO3
При пропускании СО2 через раствор карбоната образуется гидрокарбонат:
Na2CO3 + CO2 + H2O = 2NaHCO3
В реакциях СО2 способен выступать только в роли окислителя. При высоких температурах он взаимодействует с углем и с активными металлами:
CO2 + C = 2CO
CO2 + 2Mg = 2MgO + C
2CO2 + 2Na2O2 = 2Na2CO3 + O2
Na2SiO3 + 2CO2 + 2H2O = 2NaHCO3 + H2SiO3↓
Соли (карбонаты, гидрокарбонаты).
При нагревании карбонаты (все, кроме карбонатов щелочных металлов и аммония) разлагаются до оксида металла и оксида углерода (IV).
CaCO3 CaO + CO2
Карбонат аммония при нагревании разлагается на аммиак, воду и углекислый газ:
(NH4)2CO3 2NH3 + 2H2O + CO2
Гидрокарбонаты при нагревании переходят в карбонаты:
2NaHCO3 Na2CO3 + CO2 + H2O
Качественной реакцией на ионы СО32─ и НСО3− является их взаимодействие с более сильными кислотами, последние вытесняют угольную кислоту из солей, а та разлагается с выделением СО2
Na2CO3 + 2HCl = 2NaCl + CO2 ↑ + H2O
NaHCO3 + HCl = NaCl + CO2 ↑ + H2O
При смешивании растворов будет происходить гидролиз и по аниону слабой кислоты и по катиону слабого основания:
3Na2CO3 + 2FeCl3 + 3H2O = 2Fe(OH)3 + 6NaCl + 3CO2
Кремний. Соединения кремния.
Кремний.
При низких температурах кремний химически инертен, при высоких температурах реагирует как с неметаллами, так и с некоторыми металлами. В большинстве случаев кремний является восстановителем, в реакциях с более сильными восстановителями (активными металлами) выступает в роли окислителя.
При нагревании выше 400°С кремний взаимодействует с кислородом:
Si + O2 = SiO2
При взаимодействии с галогенами (с фтором при комнатной температуре), при нагревании с хлором, бромом, иодом образуются галогениды кремния:
Si + 2Cl2 = SiCl4
Si + 2Br2 = SiBr4
При температуре выше 600°С взаимодействует с серой:
Si + 2S = SiS2
При температуре около 2000°С кремний соединяется с углеродом с образованием карбида кремния (карборунда):
Si + С = SiС
При взаимодействии с активными металлами образуются силициды металлов:
Si + 2Mg = Mg2Si
Si + 2Са = Са2Si
Si + 2MgO = Mg2Si + 2SiO
Силициды щелочных, щелочноземельных металлов и магния разлагаются водой, щелочами и разбавленными кислотами с образованием силана:
Mg2Si + 4H2O = 2Mg(OH)2 + SiH4↑
2Ca2Si + 4NaOH + 10H2O = 2Na2SiO3 + 4Ca(OH)2 + SiH4↑
Mg2Si + 4HCl = 2MgCl2 + SiH4↑
В водных растворах щелочей кремний растворяется с образованием солей кремниевой кислоты :
Si + 2NaOH + H2O = Na2SiO3 + 2H2
Кремний не взаимодействует с водными растворами кислот, но аморфный кремний растворяется в плавиковой кислоте:
Si + 6HF = H2[SiF6] + 2H2
(Si(тв.) + 4HF(г.) = SiF4 + 2H2)
Кремний растворяется в смеси концентрированных азотной и плавиковой кислот:
3Si + 4HNO3 + 12HF = 3SiF4 + 4NO + 8H2O
Соединения кремния.
