
Задание 64
Составьте выражения для скоростей прямой, обратной реакций (уравнение реакции то же, что в предыдущей задаче), константы равновесия. Вычислите, во сколько раз изменится скорость прямой реакции при заданном изменении температуры, концентрации и давлении (табл. 4). Как необходимо изменить внешние условия (температуру, давление, концентрации веществ) для смещения равновесия слева направо?
Номер задачи |
64 |
Уравнение в задании темы 3 |
44 |
Темп. коэффициент |
2 |
t1 |
20 |
t2 |
50 |
n1 (концентрация 1-ого компонента увеличилась в n1 раз) |
5 |
n2 (концентрация 2-ого компонента увеличилась в n2 раз) |
5 |
m (давление увеличилось в m раз) |
10 |
Решение:
C2H5OH(Ж) + 3О2(г) = 2СО2(г) + 3H2O(г)
Скорость реакции прямо пропорциональна произведению концентрации реагирующих веществ, взятых в степенях, соответствующих стехиометрическим коэффициентам при формулах этих веществ в уравнении реакции.
Выражение скорости для прямой реакции:
V1 = k 1 * [C2H5OH(Ж)]*[О2(г)]3
Выражение скорости для обратной реакции:
V2 = k2* [СО2(г)]2*[H2О(г)]3
Выражение для константы равновесия:
k 1 [СО2(г)]2*[H2О(г)]3
К = — = —————————
k2 [C2H5OH(Ж)]*[О2(г)]3
Рассмотрим, во сколько раз изменится скорость прямой реакции при заданном изменении температуры, если:
Температурный коэффициент γ = 2
t1 =20 0C
t2 =50 0C
Зависимость
скорости реакции от температуры
выражается формулой Вант-Гоффа
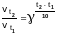 ,
где
,
где
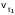 -
скорость реакции при температуре t1,
-
скорость реакции при температуре t1,
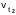 - скорость реакции при температуре
t2 ,
- температурный коэффициент реакции.
- скорость реакции при температуре
t2 ,
- температурный коэффициент реакции.
Таким образом,
= 2 (50-20) / 10 = 23 = 8
При повышении температуры на 30 0С (t2 – t1 = 50 0C – 20 0C = 300C) скорость реакции увеличится в 8 раз.
Рассмотрим, во сколько раз изменится скорость прямой реакции при заданном изменении концентрации, если:
n1 (концентрация 1-ого компонента увеличиласьв n1 раз) 5
n2 (концентрация 2-ого компонента увеличиласьв n2 раз) 5
V1 = k 1 * [C2H5OH(Ж)]*[О2(г)]3
V`2= k 1 * [5C2H5OH(Ж)]*[5О2(г)]3 = 5*53*k 1 * [C2H5OH(Ж)]*[О2(г)]3 =
= 625 k 1 * [C2H5OH(Ж)]*[О2(г)]3
V`2 / V1 = 625
Это значит, что при увеличении концентрации C2H5OH(Ж)в 5 раз и О2(г) в 5 раз скорость реакции увеличится в 625 раз.
Рассмотрим, во сколько раз изменится скорость прямой реакции при заданном изменении давления, если:
m (давление увеличилось в m раз) = 10
Для газообразных веществ увеличение давления равнозначно увеличению концентрации. Таким образом, увеличение давления в 10 раз приводит к увеличению концентрации О2(г) в 10 раз.
V1 = k 1 * [C2H5OH(Ж)]*[О2(г)]3
V`2= k 1 * [C2H5OH(Ж)]*[10О2(г)]3 = 103*k 1 * [C2H5OH(Ж)]*[О2(г)]3 =
= 1000 k 1 * [C2H5OH(Ж)]*[О2(г)]3
V`2 / V1 = 1000
Это значит, что при увеличении давления, а соответственно, и концентрации О2(г) в 10 раз скорость реакции увеличится в 1000 раз.
Для смещения равновесия данной реакции слева направо нужно:
C2H5OH(Ж) + 3О2(г) = 2СО2(г) + 3H2O(г)
уменьшить температуру, так как (см. решение предыдущего задания) H(р-ции)< 0, значит Q> 0, прямая реакция является экзотермической.
увеличить концентрацию C2H5OH(Ж) или О2(г) или уменьшить концентрацию СО2(г) или H2O(г)
3) при протекании прямой реакции (слева направо) происходит увеличение давления ( 3 моль газов → 5 моль газов). Следовательно, для смещения равновесия данной реакции вправо нужно уменьшить давление.
