
КОНТРОЛЬНЫЕ РАБОТЫ |
|||
● ХИМИЯ |
● ФИЗИКА |
● Высшая математика |
|
● Электротехника, ТОЭ |
● СТАТИСТИКА |
||
● Иностр. языки (английский, немецкий) |
|||
● Теоретическая механика |
● Сопромат |
||
● СТРОИТЕЛЬНАЯ МЕХАНИКА |
|||
тел: 8-927-489-95-31 |
|||
ВК: https://vk.com/nasy13rova , https://vk.com/himgroup |
|||
Эл. почта: 89274899531@mail.ru |
|||
ПРОСЬБА!!! Заказывайте работы заранее. Ближе к сессии бывает большая очередь. |
|||
Решения заданий начинаются ниже, смотрите со второй страницы
|
|||
Задание 4
1. Для атомов элементов, порядковые номера которых указаны в табл.1 укажите состав ядер (число протонов и нейтронов), составьте электронные формулы атомов. Укажите валентные электроны, распределите их по квантовым ячейкам в стационарном и возбуждённом состояниях, определите значения спиновой валентности. К какому электронному семейству принадлежит каждый элемент?
2. Исходя из положения элементов в периодической системе элементов Менделеева, выбранных в соответствии с шифром (см. табл.1), охарактеризуйте их свойства. Является ли каждый из них металлом или неметаллом, окислителем или восстановителем? Каковы высшая и низшая степени окисления их атомов? Составьте формулы оксидов и гидроксидов, отвечающих их высшей степени окисления? Какими кислотно-основными свойствами обладают эти соединения? Приведите уравнения соответствующих реакций. Образуют ли данные элементы водородные соединения? Сравните свойства соединений данного элемента со свойствами аналогичных соединений элементов той же подгруппы периодической системы.
Номер Порядковые задачи номера элементов |
4 15, 52 |
Решение:
Элемент с порядковым номером 15 – это фосфор Р. Массовое число ядра атома фосфора равно 31.
Cостав ядра:
число протонов равно порядковому номеру элемента: Z = 15
число нейтронов равно разности массового число ядра и количества протонов:
N=A-Z=31-15=16
Электронная формула атома Р:
1s22s22p63s23p33d0
Валентные электроны фосфора имеют конфигурацию: 3s23p33d0
Для стационарного, отвечающего минимальной энергии, состояния атома распределение по квантовым ячейкам электронов таково:
Р … 3s23p33d0
![]()
3s 3p 3d
3d ячейки при этом остаются свободными. Спиновая валентность фосфора в основном (стационарном) состоянии равна 3. При возбуждении атома в результате приобретения им дополнительной энергии электроны из 3s-состояния переходят в одну из пустых 3d-ячеек:
Р * 1s22s22p63s13p33d1
![]()
3s 3p 3d
Спиновая валентность становится равной 5.
У фосфора происходит застройка внешнего р-подуровня, поэтому он относится к р-элементам.
Фосфор – элемент 3-го периода, 5-ой группы главной подгруппы периодической системы. Является неметаллом. В окислительно-восстановительных реакциях может проявлять себя и как окислитель (принимать электроны):
Р0 + 3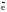
Р-3
Р-3
и как восстановитель (отдавать электроны):
Р0 - 5 Р+5
Высшая степень окисления атома фосфора равна номеру группы: + 5
Низшая степень окисления атома фосфора равна количеству электронов, которые он способен принять: -3
Высший оксид фосфора – Р2О5. Это кислотный оксид. Проявляет свойства, характерные для кислотных оксидов:
1. Кислотный оксид + вода = кислота
Р2О5 + 3H2O = 2H3PO4
2. Основный оксид + кислотный оксид = соль
3CaO + Р2О5 = Ca3(PO4)2
3. Кислотный оксид + щелочь = соль + вода
Р2О5 + 6NaOH = 2Na3PO4 + 3H2O
Высший гидроксид фосфора – фосфорная кислота H3PO4. Это кислота средней силы.
Проявляет свойства, характерные для кислот:
Реагирует с основаниями (реакция нейтрализации):
H3PO4 + 3NaOH = Na3PO4 + 3H2O
Реагирует с основными оксидами:
2H3PO4 + 3MgO = Mg3(PO4)2+ 3H2O
Взаимодействует с солями:
2H3PO4 + 3K2SiO3 = 2K3PO4 + 3H2SiO3↓
Водородное соединение фосфора – фосфин РН3.
Сравним свойства соединений Р со свойствами аналогичных соединений элементов той же подгруппы периодической системы. Ближайшими соседями Р по подгруппе являются азотN и мышьяк As.
В ряду N – P – As происходит ослабление неметаллических свойств.
В ряду оксидов N2О5 – Р2О5 – As2О5 и гидроксидов HNO3 - H3PO4 - H3AsO4
происходит ослабление кислотных свойств.
Элемент с порядковым номером 52 – это теллурТe. Массовое число ядра атома теллура равно 128
Cостав ядра:
число протонов равно порядковому номеру элемента: Z = 52
число нейтронов равно разности массового число ядра и количества протонов:
N=A-Z=128-52=76
Электронная формула атома Тe: 1s22s22p63s23p63d104s24p64d104f05s25p4
Валентные электронытеллура имеют конфигурацию: …5s25p4
Для стационарного, отвечающего минимальной энергии, состояния атома теллура распределение по квантовым ячейкам электронов таково:
Тe…5s25p4
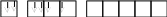
5s 5p 5d
5d ячейки при этом остаются свободными. Спиновая валентностьтеллура в основном (стационарном) состоянии равна 2. При возбуждении атома в результате приобретения им дополнительной энергии электроны из 5p-состояния переходят в одну из пустых 5d-ячеек:
Тe*… 5s25p35d1
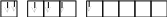
5s5p 5d
Спиновая валентность становится равной 4. При получении новой порции энергии атомом возбуждается следующая электронная пара: электрон из 5s-ячейки переходит в свободную ячейку 5d-подуровня.При этом спиновая валентность станет равной 6.
Тe**…5s15p35d2
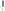
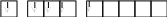
5s 5p 5d
У теллура происходит застройка внешнего р-подуровня, поэтому он относится к р-элементам.
Теллур – элемент 5-го периода, 6-ой группы главной подгруппы периодической системы. Является неметаллом. В окислительно-восстановительных реакциях может проявлять себя и как окислитель (принимать электроны):
Тe0 +2 Тe-2 ,
и как восстановитель (отдавать электроны):
Тe0 - 4 Тe+4
Тe0 - 6 Тe+6
Высшая степень окисления атома теллура равна номеру группы: + 6
Низшая степень окисления атома теллура равна количеству электронов, которые он способен принять: -2
Высший оксид теллура – ТeO3. Кислотные свойства выражены слабо. Плохо реагирует с холодной водой, разбавленными кислотами и щелочами. Кристаллическая форма пассивна. Аморфная форма реагирует с горячей водой, концентрированной хлороводородной кислотой, концентрированными щелочами, HF.

Высший гидроксид теллура –ортотеллуровая кислота: H6ТeO6. Плавится под избыточным давлением, выше температуры плавления разлагается. Хорошо растворяется в воде. Слабая кислота. Лишь частично нейтрализуется щелочами. Образует гетерополикислоты. Проявляет окислительные свойства, но реагирует медленно.

![]()
Теллур образует водородное соединение – теллуроводородH2Тe
Сравним свойства соединений теллура со свойствами аналогичных соединений элементов той же подгруппы периодической системы. Соседями теллура по подгруппе являются кислород, сера, селен, полоний.
В ряду элементовО - S – Se – Te – Ро происходит ослабление неметаллических свойств.
В ряду оксидов SO3 – SeO3 – TeO3 и кислот H2SO4 - H2SeO4–H6TeO6 происходит ослабление кислотных свойств.
