
- •А. М. Лихтер, о. Н. Гречухина, а. А. Попов
- •Оглавление
- •1. Основы молекулярно-кинетической теории 5
- •1. Основы молекулярно-кинетической теории
- •1.1 Развитие представлений молекулярно-кинетической теории
- •1.2 Термодинамические параметры. Масса и размеры молекул
- •1. Давление
- •3. Температура
- •Опыт №1.1 Давление молекул на стенку сосуда.
- •Ход работы
- •1.3 Статистические закономерности. Распределение Максвелла. Скорости молекул
- •1.4 Основное уравнение кинетической теории газов
- •1.5 Число соударений между молекулами. Средняя длина свободного пробега молекул
- •1.6 Явления переноса
- •Опыт№1.2
- •Ход работы
- •Тесты к лекции №1.
- •Вопросы к разделу 1 «Основы молекулярно-кинетической теории»
- •2. Идеальные газы
- •2.1 Понятие об идеальном газе. Состояние системы
- •Опыт№2.1 Модель газа.
- •Ход работы
- •2.2 Процессы
- •2.3 Основные газовые законы
- •Опыт№2.2 Броуновское движение.
- •Ход работы
- •2.4 Уравнение состояния идеальных газов и газовая постоянная
- •2.5 Смесь газов. Закон Дальтона
- •2.6 Идеальный газ в поле тяжести. Распределение Больцмана
- •Опыт№2.3 Изменение давления от высоты.
- •Ход работы
- •Тесты к лекции №2.
- •Вопросы к разделу 2 «Идеальные газы»
- •3. Основы термодинамики
- •3.1 Предмет и метод термодинамики
- •3.2 Связь теплоты и работы. Механический эквивалент тепла
- •3.3 Степени свободы молекул. Распределение энергии по степеням свободы. Внутренняя энергия идеального газа
- •3.4 Работа расширения газа
- •Опыт№3.1
- •Ход работы
- •Опыт№3.2 Работа расширения газа.
- •Ход работы
- •3.5 Теплоемкость. Измерение теплоемкостей. Классическая теория теплоемкости и отступление от неё. Закон Дюлонга и Пти
- •Опыт№3.3 Теплоемкость металлов
- •Ход работы
- •Тесты к лекции №3.
- •Вопросы к разделу 3 «Основы термодинамики»
- •4. Процессы в газах
- •4.1 Первый закон термодинамики и его применение к изопроцессам в газах
- •4.2 Адиабатический процесс
- •Опыт№4.1 Адиабатическое расширение.
- •Ход работы
- •Опыт№4.2 Адиабатическое сжатие.
- •Ход работы
- •4.3 Политропный процесс
- •Опыт№4.3
- •Ход работы
- •Опыт№4.4 Изотермический процесс.
- •Ход работы
- •Опыт№4.5 Изохорный процесс.
- •Ход работы
- •4.4 Круговые процессы
- •4.5 Идеальная тепловая машина. Цикл Карно
- •Тесты к лекции №4.
- •Вопросы к разделу 4 «Процессы в газах»
- •5. Второй закон термодинамики
- •5.1 Содержание второго закона
- •5.2 Теорема Карно. Кпд реальной тепловой машины
- •Опыт№5.1 Двигатель Герона
- •Ход работы
- •Опыт№5.2 Двигатель Стирлинга.
- •Ход работы
- •Опыт№5.3 Двигатель внутреннего сгорания.
- •Опыт№5.4 Паровой двигатель.
- •5.3 Теорема Клаузиуса. Энтропия
- •5.4 Теорема Нернста
- •5.5 Энтропия и вероятность. Философское значение второго закона термодинамики
- •Вопросы к разделу 5 «Процессы в газах»
- •6. Реальные газы и фазовые переходы
- •6.1 Отклонение реальных газов от идеальных газовых законов. Межмолекулярные силы
- •6.2 Уравнение Ван-дер-Ваальса
- •6.3 Критическое состояние вещества
- •Опыт№6.1. Критическое состояние эфира.
- •Ход работы
- •6.4 Внутренняя энергия реальных газов. Явление Джоуля-Томсона
- •Опыт№6.2 Эффект Джоуля-Томсона.
- •Ход работы
- •6.5 Фазовые переходы. Диаграмма состояния
- •Вопросы к разделу 6 Реальные газы и фазовые переходы
3.4 Работа расширения газа
Взаимодействие тела с соприкасающимися с ним внешними телами можно характеризовать давлением. При взаимодействии может происходить перемещение точек поверхности тела, т.е. изменяться его объем.
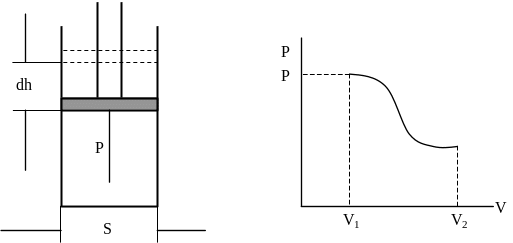
Рис.24.
Подсчитаем элементарную работу dA, совершаемую газом при его расширении:
dA = Fdh = рSdh = pdV.
Полная работа: 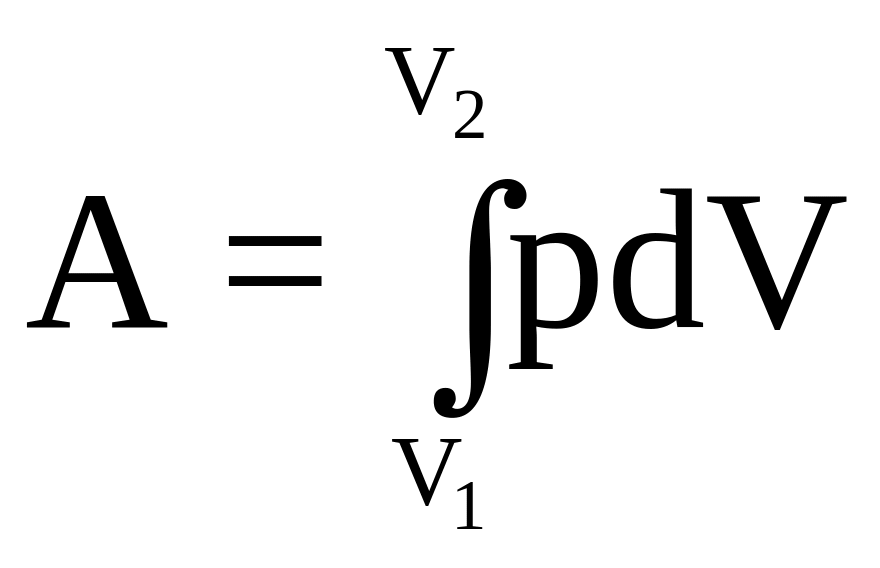 . (35)
. (35)
Если тело расширяется, то V2>V1 и А > 0 – работа расширения положительная. Газ совершает работу против внешних сил.
Если тело сжимается, то V2<V1 и А < 0 – работа сжатия отрицательная. Внешняя сила совершает работу над телом.
Работа при различных процессах:
а) изотермический:
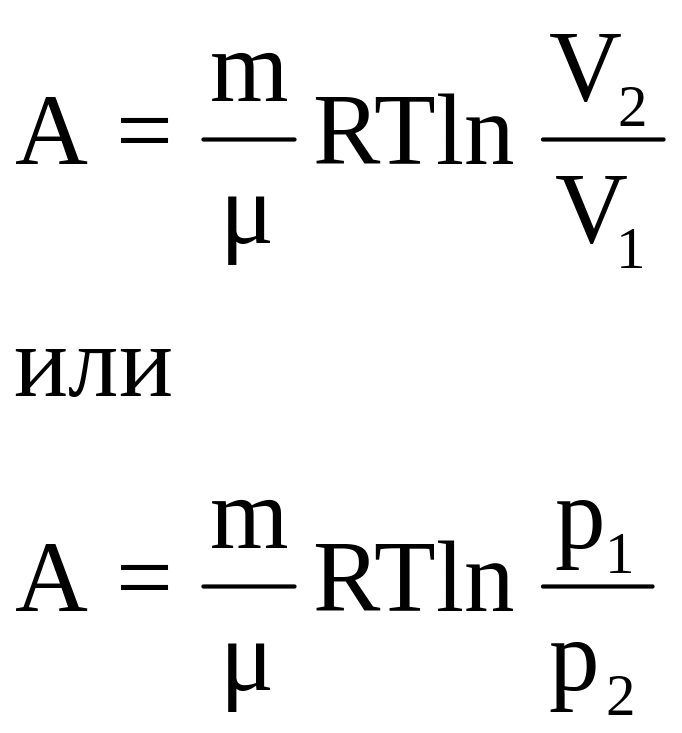 , (36)
, (36)
б) изохорический:
A = 0,
в) изобарический:
A = p (V2 – V1). (37)
Опыт№3.1
«Пушка» на моторе. Изохорический нагрев газа.
Цель работы: с помощью данной установки рассмотреть изохорический нагрев газа.
Оборудование:
Двигатель, вращающий латунную трубку.
Латунная трубка, внутри которой капли этилового спирта.
Зажим.
Пробка, которой плотно закрыта латунная трубка.
Ход работы
Включим двигатель, тем самым приведем латунную трубку во вращение.
Зажимом будем тормозить трубку, от трения будет повышаться температура спирта в трубке.

Рис.25. Демонстрация опыта
Температура трубки и этилового спирта повышается, давление молекул спирта на пробку увеличивается. Пробка выстреливает.

Рис.26. Демонстрация опыта
Вывод: этиловый спирт получил энергию от латунной трубки, которая нагрелась из-за трения, эта энергия была использована в совершении работы спиртом при выталкивании пробки. При изохорическом нагревании газа давление в газе возросло, что и заставило вылететь пробку из трубки.
Опыт№3.2 Работа расширения газа.
Цель работы: рассмотреть ситуацию, которая наглядно показывает случай, в котором нагретый газ совершает работу.
Оборудование:
1. Пробирка.
2. Вода.
3. Пробка.
4. Свеча.
5. Зажим.

Рис.27. Демонстрация опыта
Ход работы
Наполнить пробирку водой и плотно закрыть пробкой.
Начать нагревать пробирку с помощью зажженной свечи.
Постепенно в пробирке будет образовываться пар.
В момент, когда давление пара возрастет до определенного значения, пробка вылетит из пробирки.

Рис.28. Демонстрация опыта
Вывод: при нагревании пар получил энергию от сожженного топлива, расширяясь, он совершил работу – вытолкнул пробку.
3.5 Теплоемкость. Измерение теплоемкостей. Классическая теория теплоемкости и отступление от неё. Закон Дюлонга и Пти
В термодинамике для характеристики тепловых свойств тел используется понятие теплоёмкости.
Если при поглощении количества тепла dQ температура тела повышается на dT, то
dQ ~ dT,
dQ = CTdT,
![]() –
называется теплоёмкостью тела,
–
называется теплоёмкостью тела,
![]() .
.
Ст – не универсальная постоянная для тела, а является функцией условий, при которых происходит нагревание и зависит от свойств тела:
![]() – молярная теплоемкость
(теплоемкость моля или киломоля),
– молярная теплоемкость
(теплоемкость моля или киломоля),
![]() ,
,
![]() – удельная теплоемкость
(теплоемкость единицы массы),
– удельная теплоемкость
(теплоемкость единицы массы),
![]() ,
,
Cт = υCμ
= mCуд, где
![]() –
число молей (38)
–
число молей (38)
В зависимости от условий протекания процесса вводят теплоемкости:
СтР – теплоемкость при р = const:
а) СРμ – молярная при p = const;
б) Cуд.р – удельная при p = const;
CтV – теплоемкость при V = const:
а) CVμ – молярная при V = const;
б) Cуд.V – удельная при V = const.
Измерение теплоемкостей твердых и жидких тел обычно производят с помощью калориметра, используя уравнение теплового баланса.
Если нагревание происходит при V = const, то всё тепло переходит во внутреннюю энергию U, тогда согласно определению теплоемкости:
![]() ,
поэтому
,
поэтому
![]() – постоянная величина, независящая от
параметров состояния. (39)
– постоянная величина, независящая от
параметров состояния. (39)
Аналогично, если нагревание происходит при постоянном давлении (p = const), то:
![]() –
постоянная величина, независящая от
параметров состояния. (40)
–
постоянная величина, независящая от
параметров состояния. (40)
Объединяя (39) и (40), получим:
Cpμ = Cvμ + R – уравнение Роберта-Майера, (41)
![]() –
показатель адиабаты.
–
показатель адиабаты.
Итак:
для изохорического процесса:
![]() ,
,
для изобарического процесса:
![]() .
.
