
- •Вопрос 14: Факторы гумификации.
- •Вопрос 15: Органо-минеральные производные гумусовых кислот.
- •Вопрос 16: Функции органического вещества почв в биосфере.
- •Вопрос 17: Почвенные коллоиды. Строение, состав, свойства.
- •Вопрос 18: Понятие о почвенном поглощающем комплексе.
- •Вопрос 19: Механическая поглотительная способность почвы.
- •Вопрос 20: Биологическая поглоти тельная способность почвы.
- •Вопрос 21: Химическая поглотительная способность почвы.
- •Вопрос 22: Физическая поглотительная способность почвы.
- •Вопрос 23: Физико-химическая поглотительная способность почвы.
- •Вопрос 24: Обменное и необменное поглощение катионов.
- •Вопрос 25: Общие закономерности поглощения анионов в почвах.
- •Вопрос 26: Роль поглотительной способности в генезисе и плодородии почв.
- •Вопрос 27: Почвенная кислотность, формы, способы регулирования.
Вопрос 17: Почвенные коллоиды. Строение, состав, свойства.
Коллоиды представляют собой наиболее дисперсную часть твердой фазы почвы, размеры их лежат в пределах 0,001—0,2 мкм.
В коллоидной химии за верхнюю границу диаметра коллоидных частиц принимают величину 0,1 мкм, в почвоведении — 0,2 мкм. В общем, это условные границы и они не имеют принципиального характера. Существенно то, что начиная с этих размеров резко возрастает адсорбционная емкость почвенных частиц благодаря быстрому росту их удельной поверхности.
Коллоиды не только поглощают и удерживают ионы и органические вещества, но и служат цементом для более крупных частиц и агрегатов, влияя таким образом на структуру почвы, от которой зависит ее водно-воздушный режим.Коллоиды образуются в процессе выветривания и почвообразования либо путем раздробления крупных частиц до коллоидных размеров или же за счет соединения молекул и ионов до размеров коллоида. Содержание их в почве различно — от 1—2 до 30—40% к массе почвы. В воде они образуют коллоидные растворы или системы, состоящие из дисперсной фазы (масса коллоидных частиц) и дисперсионной среды (почвенный раствор).
Состав почвенных коллоидов. По вещественному составу коллоиды почвы бывают минеральные, органические и органо-минеральные. В большинстве своем минеральные коллоиды представлены вторичными минералами. Часть из них находится в кристаллическом состоянии. Это прежде всего глинистые минералы: монтмориллонит, каолинит, вермикулит, гидрослюды и др. Кроме них в коллоидной фракции всегда присутствует небольшая примесь тонкодисперсных первичных минералов, главным образом кварца и слюд, не проявляющих коллоидные свойства. Широко представлены в почвах, особенно влажных субтропических и тропических областей, минеральные коллоиды аморфной природы. Это аллофаны, коллоидные формы кремнезема, гидроксиды алюминия, железа и марганца.
Органические коллоиды состоят преимущественно из гумусовых веществ. В коллоидно-дисперсном состоянии могут находиться полисахариды, белки, лигнин и некоторые другие соединения, а также клетки наиболее мелких бактерий, диаметр которых лежит в пределах размеров коллоидных частиц.
Органо-минеральные коллоиды представлены гуматами кальция, продуктами взаимодействия гумусовых веществ с глинистыми минералами, осажденными формами полуторных оксидов и другими соединениями. В почвах присутствуют многочисленные комплексные минеральные и органо-минеральные соединения коллоидной природы, образующиеся при совместном осаждении двух или нескольких веществ. Сюда относятся кремне-алюминиевые и кремне-железистые образования, железисто-марганцевые, органо-железисто-марганце- вые и другие соединения. В большинстве почв преобладают минеральные коллоиды, составляющие 85—90% их общей массы.
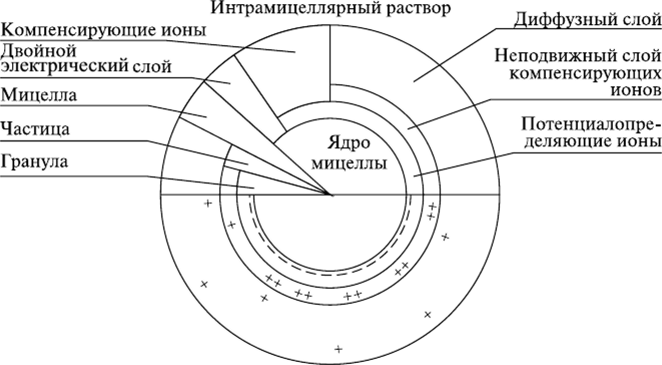
Строение коллоидов. Основу коллоида составляет ядро — внутренняя часть коллоида, представляющее собой аморфное или кристаллическое вещество различного химического состава. На поверхности ядра находится слой ионов, несущих заряд . Ионы, расположенные на поверхности ядра и несущие заряд, называются потенциалопределяющими, а ядро со слоем ионов — гранулой. Появление заряда у различных коллоидов связано с их химическим составом и структурой. У глинистых минералов наличие отрицательного заряда обусловлено свободными валентностями краевых ионов кислорода кристаллической решетки.
Возникновение заряда возможно за счет диссоциации ионов поверхностного слоя в окружающую среду. Это типично для коллоидов органической природы (гуминовые и фульвокислоты), коллоидных форм кремниевой кислоты, гидроксидов железа и алюминия. Так, в кислой среде коллоидный гидроксид железа приобретает положительный заряд вследствие диссоциации в раствор гидроксильного иона. Ион ОН- соединяется с водородом почвенного раствора в молекулу воды, а на поверхности коллоида остается некомпенсированный положительный заряд.
Между гранулой и окружающим раствором на границе раздела фаз возникает термодинамический потенциал, и под действием электростатических сил из раствора притягиваются ионы противоположного знака, образуя компенсирующий слой ионов. Вокруг ядра коллоида образуется двойной электрический слой, состоящий из слоя потенциалопре- деляющих и слоя компенсирующих ионов.
Часть ионов компенсирующего слоя прочно удерживается электростатическими силами и образует неподвижный слой, находящийся в непосредственной близости к межфазной поверхности на молекулярном расстоянии от поверхности ядра. Гранула вместе с неподвижным слоем компенсирующих ионов называется частицей. Другая часть ионов компенсирующего слоя благодаря тепловому движению, стремящемуся равномерно распределить их во всем объеме, удалена от поверхности ядра на расстояние, превышающее молекулярное. Эти ионы образуют диффузный слой, толщина которого в разбавленных растворах колеблется от 0,001 до 0,01 мкм. Концентрация ионов с зарядом, противоположным заряду коллоида, убывает по мере удаления от его поверхности, при этом уменьшается и связь ионов с коллоидом. На определенном расстоянии силы электростатического притяжения уравновешиваются силами теплового движения и концентрация ионов с различными зарядами выравнивается. Это расстояние и определяет толщину диффузного слоя. Между коллоидной частицей и окружающим раствором возникает электрокинетический или дзета-потенциал, под влиянием которого и находятся ионы диффузного слоя. Коллоидная частица вместе с диффузным слоем ионов называется мицеллой. Коллоидная мицелла электронейтральна, однако поскольку основная масса ее принадлежит грануле, заряд последней и рассматривается как заряд коллоида.
Свойства почвенных коллоидов. Важнейшим свойством почвенных коллоидов является способность обменивать ионы, находящиеся в компенсирующем слое, на ионы того же знака, находящиеся в дисперсионной среде. Легко обмениваются ионы диффузного слоя, гораздо труднее — ионы неподвижного слоя. Коллоиды, имеющие в потен- циалопределяющем слое отрицательно заряженные ионы, называются ацидоидами. Они несут отрицательный заряд и способны к поглощению и обмену катионов. К ацидоидам относятся коллоидная кремниевая кислота, гуминовые и фульвокислоты, глинистые минералы.
Коллоиды, имеющие в потенциал определяющем слое положительно заряженные ионы, называются базоидами. Они несут положительный заряд и способны к поглощению и обмену анионов. К ним относятся гидроксиды железа и алюминия, а также белковые соединения.
Некоторые коллоиды способны менять знак заряда: в кислой среде они заряжены положительно, в щелочной — отрицательно. Такие коллоиды называются амфолитоидами или амфотерными коллоидами. Амфотерные коллоиды (гидроксиды алюминия, железа, белки), а также комплексные, состоящие из кристаллических коллоидов, покрытых пленкой аморфных веществ, имеют на поверхности функциональные группы, которые в зависимости от реакции раствора ведут себя то как кислоты, то как основания.При некотором значении pH, которое называется изоэлектрической точкой, коллоид посылает в окружающий раствор одинаковое количество катионов и анионов и становится электронейтральным.
Среди почвенных коллоидов преобладают ацидоиды, играющие важнейшую роль в поглощении почвой катионов. В почвах с сильнокислой реакцией среды, особенно сформированных на аллитной коре выветривания, заметно возрастает роль базоидов. Такие почвы обладают невысокой способностью поглощать катионы, но активно сорбируют анионы, особенно фосфат-ионы.
Наряду с поглощением ионов коллоиды способны притягивать к себе молекулы воды, или гидратироваться, что обусловлено проявлением поляризационных сил. С приближением к заряженной коллоидной частице электронейтральная оболочка воды деформируется. Хотя молекула воды остается в целом нейтральной, она приобретает форму диполя. Попадая в сферу электрического поля заряженной частицы, диполи приобретают строгую ориентировку, обращаясь к ней концами, несущими заряд, противоположный заряду частицы. Вокруг коллоида образуется связанная с ним пленка воды, мощность которой зависит от природы коллоида и величины заряда частицы. По количеству воды, которое удерживается коллоидами, они условно разделяются на гидрофильные и гидрофобные.
Коллоиды, способные сильно гидратироваться, т.е. удерживать мощные водные пленки, называются гидрофильными. Это присуще аморфной кремниевой кислоте, минералам группы монтмориллонита, гумусовым кислотам. Коллоиды, слабо гидратирующиеся, называются гидрофобными. К ним относятся гидроксиды железа и алюминия, минералы группы каолинита и другие вещества. Деление почвенных коллоидов на гидрофильные и гидрофобные в известной степени условно. Это связано уже с тем, что по мере диспергирования и измельчения твердых коллоидных частиц гидратация их возрастает и они становятся более гидрофильными, чем до измельчения. Способность к гидратации определяется не только природой коллоида, но и составом ионов компенсирующего слоя, которые сами способны притягивать молекулы воды электростатическими силами. Каждый ион, подобно коллоидной мицелле, окружен диполями воды. Чем больше водная пленка, тем меньше энергия поглощения иона, так как сильногидратированный ион не может достаточно близко подойти к частице. Это влечет за собой увеличение диффузного слоя и электрокинетического потенциала. Гидратация ионов возрастает от трехвалентных к одновалентным.
Важнейшим свойством почвенных коллоидов является их агрегативная устойчивость, способность коллоидной системы сохранять неизменной степень дисперсности.
В почве коллоиды могут находиться в состоянии золя, или во взвешенном состоянии, разделенные жидкой фазой. Такое существование коллоидных частиц связно с наличием электрического заряда (электрокинетического потенциала) и гидратной оболочки на поверхности частиц. Электрический заряд способствует взаимному отталкиванию коллоидных частиц, а гидратная оболочка препятствует слипанию их при столкновениях.
В силу различных причин заряд коллоидов снижается, гидратная оболочка уменьшается, коллоиды начинают взаимодействовать между собой, что ведет к слипанию частиц и выпадению их в осадок в виде геля. Это явление называется коагуляцией. Коагуляцию коллоидов вызывает периодическое высушивание, нагревание, промораживание почвы, поскольку приводит к дегидратации частиц и потере ими водной оболочки. Особенно сильное коагулирующее воздействие на коллоидные частицы, сопровождающееся снижением величины электрокинетического потенциала, оказывают электролиты, в частности легкорастворимые соли. Минимальная концентрация электролита, при которой коллоиды выпадают в осадок, называется порогом коагуляции.
При насыщении коллоидов одновалентными катионами их элек- трокинетический потенциал значительно выше, чем при насыщении двухвалентными. Следовательно, чем больше валентность ионов компенсирующего слоя коллоидов, тем меньше их электрокинетический потенциал, тем легче идет процесс коагуляции.
Коллоиды, насыщенные одновалентными катионами, будут находиться в основном в состоянии золя. Такие почвы характеризуются неблагоприятными агрофизическими свойствами. Во влажном состоянии они сильно набухают, становятся вязкими, содержат много недоступной растениям влаги. В сухом состоянии очень плотные и содержат мало агрономически ценных агрегатов. Замена натрия на кальций, магний, железо будет способствовать переходу коллоидов в гель и улучшению агрофизических свойств почвы.
Коагулирующее действие электролитов может сводиться также к отнятию молекул воды от гидратной оболочки, что приводит к сжатию диффузного слоя и укрупнению частиц вследствие их слипания. Коагуляция может происходить и в результате взаимодействия разнозаряженных коллоидных частиц. Так взаимодействуют в кислой среде положительно заряженные гидроксиды железа и алюминия с отрицательно заряженными коллоидами гумусовых кислот.
Для некоторых коллоидов характерна способность к обратному переходу из геля в золь. Это явление носит название пептизация. Она происходит под влиянием одновалентных катионов и при уменьшении концентрации солей в почвенном растворе. Коллоиды, которые могут легко переходить из золя в гель и обратно, называют обратимыми. Обычно легко обратимы гидрофильные коллоиды, насыщенные одновалентными катионами. Необратимая коагуляция характерна для гидрофобных коллоидов, насыщенных двух- и трехвалентными катионами.
К особому виду коагуляции относится тиксотропия — самопроизвольное обратимое превращение золя в гель. При этом происходит застудневание дисперсной фазы вместе с дисперсионной средой. При механическом воздействии гель снова способен перейти в золь. Это явление встречается во многих зонах. В яркой форме тиксотропия проявляется в мерзлотных и слитых почвах, отдельных генетических горизонтах солонцов. Способствуют тиксотропии преобладание минералов монтмориллонитовой группы, насыщенность ППК одновалентными катионами, высокая влажность и щелочная реакция. Тиксотропная почва содержит много воды, лишена воздухопроницаемости, в ней создаются анаэробные условия и развивается оглеение.
В почвах происходит и так называемый процесс старения коллоидов. Старение не сопровождается изменением химического и минералогического состава, но свойства коллоидов изменяются резко. Снижается их гидрофильность, способность к адсорбции, степень дисперсности. Коллоиды утрачивают связь с дисперсионной средой и коагулируют, в дальнейшем может произойти частичная кристаллизация гелей.
Агрегативная устойчивость коллоидных систем возрастает в присутствии веществ, называемых стабилизаторами. В почвах эту функцию часто выполняют гуматы и фульваты натрия. Адсорбируясь на поверхности гидрофобных частиц, они обеспечивают увеличение их гидратации. Стабилизация коллоидных частиц при адсорбции на них высокомолекулярных веществ может происходить и в результате теплового движения и взаимного отталкивания гибких макромолекул, только частично связанных с коллоидами в результате адсорбции отдельных их участков.
Агрегативная устойчивость коллоидных систем имеет важное значение в процессах профильной дифференциации веществ в почвах. Коллоиды, обладающие высокой устойчивостью и длительное время находящиеся в состоянии золя, способны перемещаться в почвенном профиле на разную глубину, что приводит к формированию системы элювиальных и иллювиальных горизонтов. Коллоиды малоустойчивые быстро выпадают в осадок.
