
Homogenní katalýza
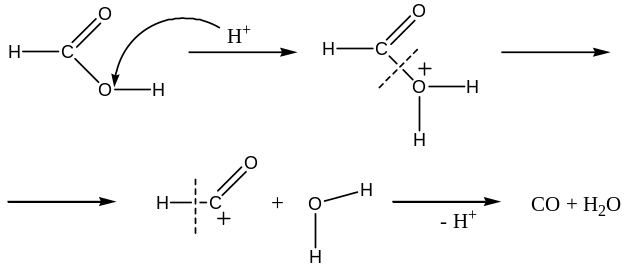
Reaktanty i katalyzátor jsou ve stejné fázi a tvoří spolu homogenní směs. Nejčastěji se jedná o reakce v roztoku. Příkladem mohou být různé reakce vyžadující kyselou katalýzu. Uveďme např. rozklad kyseliny mravenčí na oxid uhelnatý a vodu:
HCOOH → CO + H2O
Reakce je katalyzovaná kyselinou (tj. protonem) a její mechanismus je následovný:
Heterogenní katalýza
Reaktanty a katalyzátor jsou v různých fázích a tvoří heterogenní směs. Většinou bývá katalyzátor pevná látka, zatímco reaktanty jsou kapalné nebo plynné. Reakce probíhá na povrchu katalyzátoru, proto mluvíme o tzv. kontaktní katalýze. Příkladem je syntéza amoniaku z dusíku a vodíku, která je katalyzovaná železem.
Dalším důležitým pojmem je autokatalýza. Jedná se o situaci, kdy některý z produktů působí jako katalyzátor na reakci, kterou vzniká. Příkladem je redukce manganistanu draselného na manganaté ionty (známá z manganometrie), která je katalyzovaná právě manganatými ionty. Proto reakce zprvu běží velmi pomalu, často je nutné směs zahřát. Jakmile ale vznikne malé množství produktu, reakce se už rozběhne.
Kromě pozitivních katalyzátorů, které průběh reakce urychlují, existují i tzv. negativní katalyzátory, neboli inhibitory, které průběh reakce zpomalují tím, že zvyšují hodnotu aktivační energie.
Podobný efekt mají i katalytické jedy, což jsou látky, které zabraňují působení katalyzátorů nebo brzdí jejich účinek.
CHEMICKÁ ROVNOVÁHA
Uvažujme opět hypotetickou reakci
![]()
V průběhu chemické reakce ubývá výchozích látek A a B a přibývá produktů C a D. Protože je rychlost v1 chemické reakce úměrná koncentraci výchozích látek, reakce se postupně zpomaluje. Zároveň ovšem probíhá také reakce opačným směrem, kdy z látek C a D vznikají látky A a B. Látek C a D v průběhu reakce přibývá, proto se rychlost v2 této zpětné reakce zvyšuje.

Po určité době soustava dospěje do stavu dynamické rovnováhy, kdy se rychlosti obou reakcí vyrovnají (v1 = v2). Koncentrace látek A, B, C a D se navenek nemění (mluvíme o rovnovážných koncentracích), ale obě reakce neustále probíhají.
Nyní napíšeme kinetické rovnice pro obě reakce:
![]()
![]()
V okamžiku nastolení rovnováhy se obě rychlosti vyrovnají. Platí tedy:
![]()
![]()
![]()
Podíl
rychlostních konstant
![]() je opět konstanta. Značí se K a
jmenuje se rovnovážná
konstanta. Je to číslo
přiřazené dané reakci a říká nám, do jaké míry jsou výchozí
látky přeměněné na produkty. Je-li
je opět konstanta. Značí se K a
jmenuje se rovnovážná
konstanta. Je to číslo
přiřazené dané reakci a říká nám, do jaké míry jsou výchozí
látky přeměněné na produkty. Je-li
![]() ,
po dosažení rovnováhy v soustavě převládají produkty.
Je-li
,
po dosažení rovnováhy v soustavě převládají produkty.
Je-li
![]() ,
převládají výchozí látky. Znamená to, že ať na začátku
smícháme látky A, B, C a D v libovolném poměru, vždy budou
probíhat reakce do té doby, dokud rovnovážné koncentrace látek
nebudou vyhovovat tomuto vztahu.
,
převládají výchozí látky. Znamená to, že ať na začátku
smícháme látky A, B, C a D v libovolném poměru, vždy budou
probíhat reakce do té doby, dokud rovnovážné koncentrace látek
nebudou vyhovovat tomuto vztahu.
Vztah, který jsme právě odvodili, je znám jako Guldberg-Waageův zákon a dá se slovně formulovat takto: Součin rovnovážných koncentrací produktů (umocněných příslušnými stechiometrickými koeficienty) dělený součinem rovnovážných koncentrací výchozích látek (umocněných příslušnými stechiometrickými koeficienty) je konstantní a rovná se rovnovážné konstantě dané reakce.
✰ Příklad 1: Amoniak se vyrábí přímou syntézou prvků. Po dosažení rovnovážného stavu byly naměřeny následující koncentrace látek: [H2] = 0,575 mol dm-3, [N2] = 0,425 mol dm-3, [NH3] = 0,150 mol dm-3. Spočítejte rovnovážnou konstantu této reakce. .
Řešení:
Rovnice výroby amoniaku má následující podobu:
3 H2 + N2 → 2 NH3
Rovnovážná konstanta K této reakce je daná vztahem
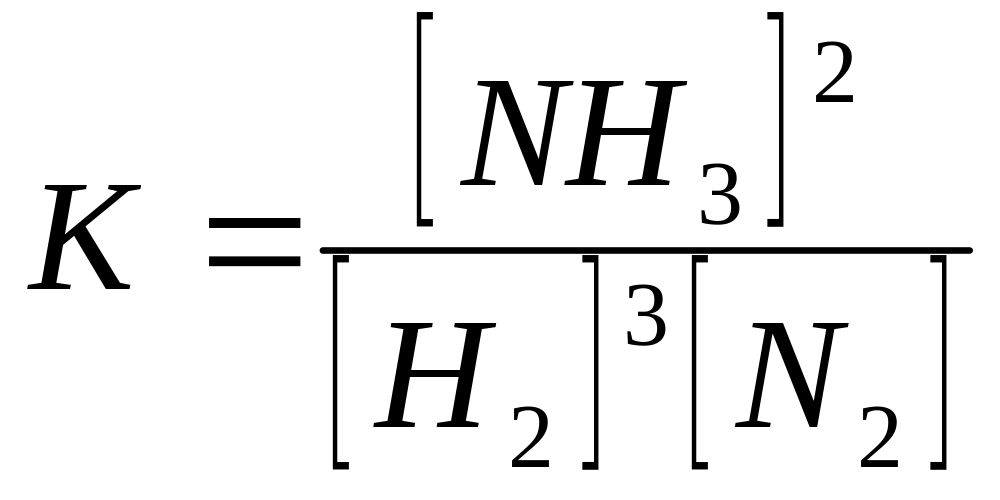
Po dosazení dostáváme
![]()
Faktory ovlivňující chemické rovnováhy
Ve chvíli, kdy změnou podmínek zasáhneme do rovnovážné soustavy, dojde ke změně koncentrací výchozích látek a produktů (tj. reakce se posune buď směrem k produktům, nebo k výchozím látkám). Platí jednoduchý princip akce a reakce, to znamená, že soustava se snaží rušivý zásah eliminovat. Tento princip je v chemii známý jako Le Chatelierův-Braunův princip.
