
Slovní zásoba 3 – Chemie – Chemická rovnováha, reakční kinetika, termochemie
chemická rovnováha (F) – химическая реакция
rovnovážné koncentrace (F) – равновесная концентрация
dynamická rovnováha (F) – динамическое равновесие
redoxní – окислительно-восстановительный потенциал
Guldberg – Waagův zákon (M) – закон Вааг-Гульдберга
rovnovážná konstanta (F) – константа равновесия
stechiometrický koeficient (M) – стехиометрический коэффициент
produkt (M) – продукт
výchozí látka (F) – исходное вещество
Le Chatelier-Braunův princip (M) – принцип Ле-Шатье-Брауна
akce (F) – действие
reakce (F) – реакция
tlak (M) – давление
teplota (F) – температура
koncentrace (F) – концентрация
elektrolyt (M) – электролит
sloučenina (F) – соединение
molekula (F) – молекула
ion (M) – ион
roztok (M) – раствор
tavenina (F) – расплав
silný elektrolyt (M) – сильный электролит
slabý elektrolyt (M) – слабый электролит
kation (M) – катион
protolytická rovnováha (F) – протеолитическое равновесие
teorie kyselin a zásad (F) – теория кислот и щёлочи
Brønsted-Lowryho teorie (F) – теория Бренстеда-Лоури
kyselina (F) – кислота
zásada (F) – щёлочь
konjugovaný pár (M) – сопряжённая пара
amfoterní látka (F) – амфотерное вещество
disociační konstanta (F) – диссоциативная константа
disociační konstanta kyseliny (F) – диссоциативная константа кислоты
disociace (F) – диссоциация
iontový součin vody (F) – ионное произведение воды
oxoniový kation (M) – оксонный катион
hydroxidový anion (M) – гидроксидовый анион
autoprotolýza vody (F) – автопротолиза воды
pH (N) – кислотный баланс
kyselost roztoku (F) – кислотность раствора
dekadický logaritmus (M) – десятичный логарифм
roztok (M) – раствор
kyselý – кислый
neutrální – нейтральный
zásaditý – щелочной
neutralizace (F) – нейтрализация
hydroxid sodný (M) – гидроксид натрия
kyselina chlorovodíková (F) – соляная кислота
chlorid sodný (M) – хлорид натрия
sůl (F) – соль
hydrolýza solí (F) – гидролиз соли
amonný kation (M) – аммонный катион
kyselina octová (F) – уксусная кислота
amoniak (M) – аммониак
octanový anion (M) – свинцовый анион
kyselina chlorovodíková (F) – соляная кислота
chlorid amonný (M) – хлорид аммония
kyselá reakce (F) – кислотная реакция
zásaditá – щелочная
neutrální – нейтральный
octan sodný (M) – ацетат натрия
chlorid sodný (M) – хлорид натрия
octan amonný (M) – ацетат аммония
elektron (M) – электрон
oxidace (F) – окисление
redukce (F) – редукция
redoxní systém (M) – окислительно-восстановительная система
oxidační činidlo (N) – окислитель
redukční – ограничительный
Beketova řada kovů (F) – Бекетов ряд металов
Vodík (M) – водород
Neušlechtilý kov (M) – неблагородный метал
ušlechtilý – благородный
galvanický článek (M) – гальванический элемент
katoda (F) – катод
anoda (F) – анод
akumulátor (M) – аккумулятор
elektrolýza (F) – электролиз
elektrolytická vodivost (F) – электролитическая проводимость
reakční kinetika (F) – кинетика реакции
chemická reakce (F) – химическая реакция
izolovaná – изолированная
simultánní – одновременный
zvratné – возвратное
paralelní – параллельный
následné – последовательное
rychlost (F) – скорость
teplota (F) – температура
Arheniova rovnice (F) – уравнение Аррениуса
tlak(M) – давление
katalyzátor (M) – катализатор
katalýza (F) – катализ
homogenní – гомогенный
heterogenní – гетерогенный
katalyzovaná reakce (F) – катализированная реакция
koncentrace látky (F) – концентрация вещества
srážková teorie (F) – теория столкновений
aktivační energie (F) – активационная энергия
teorie aktivovaného komplexu (F) – теория активированного комплекса
aktivační energie (F) – активационная энергия
inhibitor (M) – ингибитор
termochemie (F) – термохимия
molární reakční teplo (N) – молярная теплота реакции
vnitřní energie (F) – внутреняя энергия
enthalpie (F) – энтальпия
termochemická rovnice (F) – термохимическое уравнение
standardní reakční teplo (N) – стандартное тепло реакции
exotermická reakce (F) – экзотермическая реакция
endotermická – эндотермическая
první termochemický zákon (M) – первый термохимический закон
druhý termochemický zákon (M) – второй термохимический закон
standardní slučovací teplo (N) – стандартная теплота образования
spalné – сгорающее
3) Chemická rovnováha, reakční kinetika, termochemie
Reakční kinetika je část fyzikální chemie, která se zabývá rychlostí chemické reakce a faktory, které tuto rychlost ovlivňují.
Nejdříve je nutné zamyslet se nad průběhem reakcí z hlediska mikrosvěta. Molekuly reagujících látek si můžeme představit jako kuličky, které do sebe narážejí. Některé z těchto srážek vedou k reakci, což znamená, že některé vazby zaniknou a vytvoří se nové. Otázku, proč některé srážky vedou k reakci a jiné nikoli, vysvětlují dvě teorie:
Teorie aktivních srážek
Aby srážka mezi molekulami vedla k reakci (tzv. účinná srážka), musí být splněny dvě podmínky
Molekuly musí mít vhodnou prostorovou orientaci.
Př.: reakce H2 + I2 → 2 HI
reakce může probíhat

reakce nemůže probíhat:

Molekuly musí mít dostatečnou energii. Tato energie je nutná k tomu, aby došlo k zániku původních vazeb (tj. souvisí s disociační energií) a nazývá se aktivační energie (EA).
Změnu energie v průběhu reakce můžeme znázornit následujícím grafem. Osa x se nazývá reakční koordináta a zjednodušeně odpovídá průběhu reakce (zahrnuje jak hledisko časové, tak hledisko prostorové). Na osu y nanášíme hodnoty energie. Rozdíl mezi energií výchozích látek a maximem na křivce odpovídá aktivační energii reakce EA. Energetický rozdíl mezi produkty a maximem na křivce je aktivační energie zpětné reakce EA´. Rozdíl mezi výchozími látkami a produkty udává hodnotu reakční entalpie ΔH.

Tato teorie je velmi názorná, bohužel plně neodpovídá skutečnosti. Zejména experimentálně naměřené hodnoty aktivačních energií jsou podstatně nižší, než by z této teorie vyplývalo.
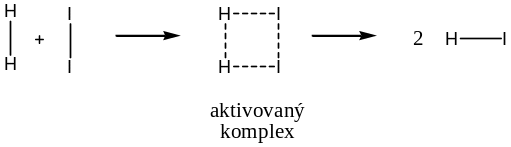
Teorie aktivovaného komplexu
Tato teorie předpokládá, že v průběhu reakce vzniká určitý nestabilní meziprodukt, tzv. aktivovaný komplex (částice „na půli cesty“ mezi výchozími látkami a produkty, v diagramu se nachází v nejvyšším bodě křivky). V této částici jsou původní vazby již oslabené a začínají se tvořit nové. Energie nutná na rozštěpení původních vazeb je tak částečně kompenzovaná energií uvolněnou při vzniku nových, proto je aktivační energie předpověděná podle této teorie nižší a lépe odpovídá skutečnosti.
Rychlost chemické reakce
Pokud chceme mluvit o reakční rychlosti, zajímá nás, jak rychle ubývají výchozí látky, resp. jak rychle přibývají produkty. Přesně řečeno, rychlost chemické reakce je definovaná jako časový úbytek molární koncentrace některé výchozích látek nebo přírůstek molární koncentrace některého z produktů dělený jeho stechiometrickým koeficientem.
Uvažujme obecnou reakci, při které z látek A a B vznikají produkty C a D.
![]()
Pozn: Dvě opačně orientované šipky vyjadřují, že probíhá také reakce zpětná, při které z látek C a D vznikají produkty A a B.
Rychlost této reakce je pak definovaná vztahem
![]()
v – reakční rychlost
Δ[A] – změna molární koncentrace látky A
a – molární koeficient látky A
Δt – časový interval
Záporné znaménko u výchozích látek vyjadřuje, že v průběhu reakce dochází k jejich úbytku. Změna jejich koncentraci je proto záporná. Rychlost reakce však musí být kladné číslo, proto před tyto členy přidáváme znaménko minus.
Faktory ovlivňující rychlost chemické reakce
