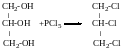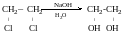- •Теорія будови органічних сполук бутлерова
- •Характеристики ковалентного зв’язку
- •Вуглеводні
- •Лабораторні методи
- •Хімічні властивості алканів
- •Радикально-ланцюговий мехнізм
- •Хімічні властивості
- •1,2 Буде 80% 20%
- •Етери. Прості ефіри. R-o-r
- •Альдегіди і кетони
- •Методи одержання
- •Оксосинтез
- •Хімічні властивості альдегідів і кетонів
- •Утворення ацеталів (взаємодія із спиртами):
- •Окиснення карбонільних сполук
- •Реакція «срібного дзеркала»:
- •Карбонові кислоти
- •Хімічні властивості карбонових кислот
- •Функціональні похідні карбонових кислот
- •Методи добування хлорангідридів
- •Принцип мікроскопічної зворотності
- •Ненасичені двохосновні карбонові кислоти
- •Добування
- •Оксокислоти
- •Вуглеводи
- •Утворення напівацеталей:
- •Бродіння глюкози
- •Дисахариди
- •Для сірчаної кислоти (80%) на нітросполуки
- •Реакція Неффе утворюється ацеформа
- •Методи добування
- •Амінокислоти
- •Методи добування
- •Ізомерія
- •Номенклатура
- •Хімічні властивості фенолів
- •Хімічні властивості
- •Хімічні властивості
Хімічні властивості
Оскільки атом С біля потрійного зв`язку більш ЕН, відповідний е- π-зв`язку сильніше притягується до ядра, менш рухливі. Це пояснюється тим, що алкіни менш активні в реакціях електрофільного приєднання, але можуть вступати в реакції нуклеофільного приєднання на відміну від алкенів.
Гідрування
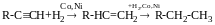
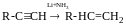
Приєднання галогенів
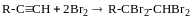
Приєднання кислот
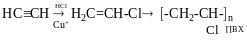
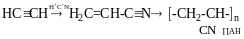
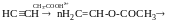
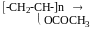
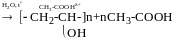
полівініловий спирт
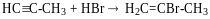 правило
Марковникова
правило
Марковникова

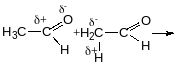
Реакця Кучерова
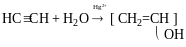
Таутомери - ізомери, які знаходяться у рухомій рівновазі і відрізняються положенням атомів Н, а також природою і положення подвійного зв`язку.
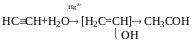

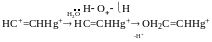
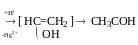
Альдегіди утворюються тільки у випадку ацетилену, у всіх інших випадках – кетони:
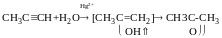
Реакція нуклеофільного приєднання до алкінів (приєднання спиртів)

механізм:
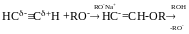
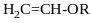
Кислотні властивості
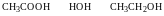
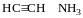
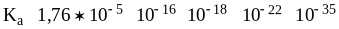

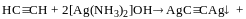

Ацетиленід срібла при повному висиханні може вибухати
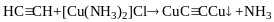

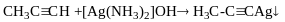
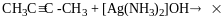
Реакція Реппе (добування дивінілу – 1,3 бутадієну)
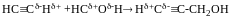

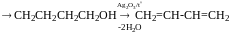
Реакція Фаворського (добування ізопрену з ацетилену)
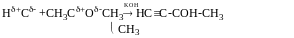
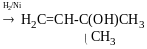 3метилбут-1-ен-3ол
----
3метилбут-1-ен-3ол
----
 ізопрен-2-метил-1,3бутадієн
ізопрен-2-метил-1,3бутадієн
Полімеризація. Димеризація
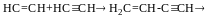
Коли в молекулі зустрічається одночасно подв. і потрійний зв`язки, домінуючий – подвійний
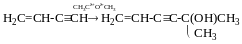
Тримеризація

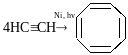 циклооктатетраєн
циклооктатетраєн
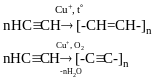 карбін
карбін
Окислення алкінів
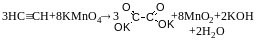
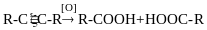
АЛКАДІЄНИ CnH2n-2
Кумульовані CH2=C=CH2 (sp-гібридизація)
З ізольованими подвійними зв’язками CH2=CH-(CH2)n-CH=CH2
Спряжені CH2=CH-CH=CH2
Нестійкий енол
 ацетон
ацетон
ален
з ізольованим подвійним звязком такі ж властивості, як і в алкенів
спряжені
дієни
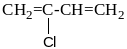 хлоропрен
хлоропрен
Особливості будови спряжених дієнів.
В них відбувається перерозподіл електронної густини за рахунок мезомерного ефекту. В спряжених дієнах утворюється π-електронна хмара , що охоплює всі атоми карбону , що належить до спряженої системи.
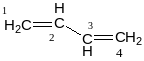


Енергія спряження = 14,6 кДж/моль.
π-електронна густина максимально зосереджується між 1,2,3 і 4 атомами, але також є і між 2 і 3.
Промислові методи добування
Дегідрування алканів

Метод Лебедєва
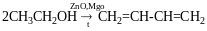
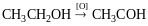



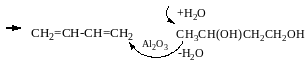
Реакція Реппе і реакція Фаворського
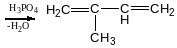
Реакція Прінса
 4,4диметил-1,3діоксин
4,4диметил-1,3діоксин
 2-метил-1,3-бутадієн
2-метил-1,3-бутадієн
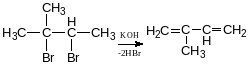 ізопрен
ізопрен
 2бутин
2бутин
Хімічні властивості дієнів
Реакція приєднання гідрування
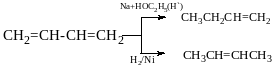
Кінетичний контроль- коли напрямок і швидкість реакції залежить тільки від значення ЕА енергії активації (утворюється продукт, що швидше)
Термодинамічний- це контроль, коли напрямок і швидкість реакції залежить від значення вільної ентальпії реакції ∆G.

Резонансні форми
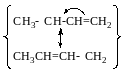 радикального
типу
радикального
типу
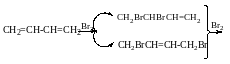

При 80°С продукту:
80°С 20°С
1,2 Буде 80% 20%
1,4 - 20% 80%
АЕ Механізм електрофільного приєднання Br:
Катіони
амільно типу
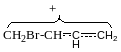
АR Радикальний механізм
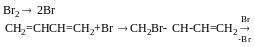
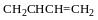
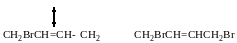
(йодування і хлорування так само)
Приєднання Ннal
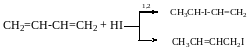
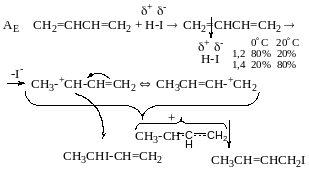
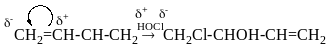
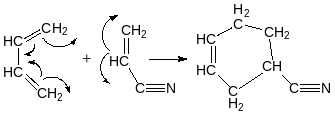
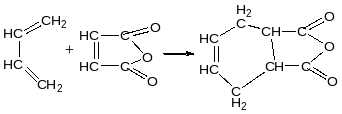
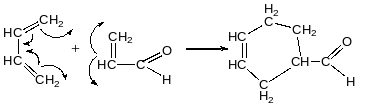
Дієновий синтез Дільса-Альдера
Вступає
лише ізопрен
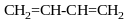
Дієн
дієнофіл
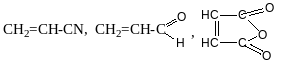
Акрилонітрил акролеїн малеїновий ангідрид

Полімеризація
При полімеризації ізопрену утворюються синтетичні каучуки.

Поляризація катіонна аніонна
 цис
1,4 полізопреновий каучук
цис
1,4 полізопреновий каучук
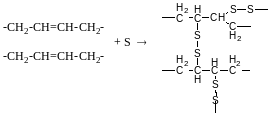
Окислення озоноліз
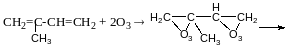
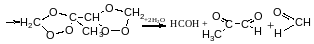
Стереохімія- поняття про асиметричний атом С, проекційні формули Фимера, оптичні антиподи, рацемати, їх властивості, поняття про відносну та абсолютну конфігурацію, діастереомери, мезоформи.
Оптична активність органічних сполук- здатність сполук обертати площину плоско-поляризованого світла.
Використовуються поляриметри
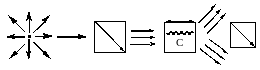
ПРИЗМА кювета(повертається) призма
(поляризується) +α-правообрт.; - α лівооберт оптичні антиподи
Для порівняння оптично-активних різних енантіомерів використовується поняття «питоме обертання», що характеризує оптичну активність енантіомера при його концентрації 1г/мл і довжині кювети (чи трубки) 1 метр.
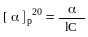 концентрація
(1г/мл)
концентрація
(1г/мл)
експериментально визначений кут обертання площини поляризації
Оптичні ізомери мають однакову хімічну будову, відрізняється розташуванням атомів у просторі.
Оптичну активність проявляють сполуки, молекули яких побудовані несиметрично, тобто відсутні елементи симетрії (вісь, площина).
Елантіомерія-явище існування 20х дзеркальних об’єктів, які не суміщені у просторі.
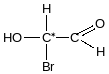
Хіральність- здатність будь-якого предмету мати своє дзеркальне відображення , не тотожне оригіналу. С*-хіральний атом Карбону має 4 різні замісники молочної кислоти.
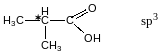
Абсолютна конфігурація
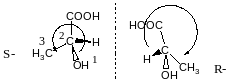 не
співпадають,якщо накласти
не
співпадають,якщо накласти
Правило Кана, Інгольда, Прелога
Старшинство замісників визначається за порядковим номером , за молекулярною масою замісника.

Старший
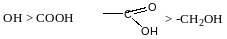
Проекційні формули Фімера
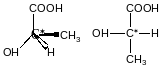 якщо
H
зліва – D-ентіомер
якщо
H
зліва – D-ентіомер
H справа – L-ентіомер
 (
НЕ ІСНУЄ)
(
НЕ ІСНУЄ)
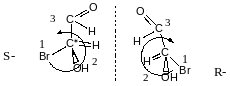
Якщо в молекулі декілька асиметричних атомів С, то кількість енантіомерів визначається по формулі:
 ,
цn-
кількість С* ;
N-
кількість енантіомерів.
,
цn-
кількість С* ;
N-
кількість енантіомерів.
Рацемат(якщо є і S- i R-) –еквімолекулярна суміш пари енантіомерів з індивідуальними фізичними властивостями.
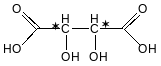 ВИННА
КИСЛОТА
ВИННА
КИСЛОТА
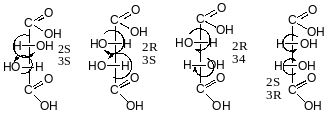
/ М Е З О Ф О Р М И \
Мезо-форми-структури оптично неактивних сполук з декількома хіральними атомами, біля яких розташовані однакові за структурою замісники, які утворюють протилежну за знаком обертання тетроядригну конфігурацію.
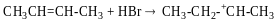


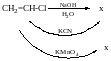
Моно- і полігалогенопохідні вуглеводнів
Галогенопохідні насичених вуглеводнів. Моногалогенопохідні алканів, добувають галогеноалкінів із насичених віглеводнів, олефінів, спиртів, характеристика зв’язків С-Наl, індукційний ефект атома НаІ.
Перерозподіл
електронної густини вздовж σ-звязку

Хімічні властивості відновлення до вуглеводнів, реакції нуклефільного заміщення галогенів на гідроксильну, алкоксильну, (ОСН3, ОСН2, СН3), нітрильну аміно та інші групи, два механізми нуклефільного заміщення (SN1 i SN2), фактори, що впливавють на хід нуклеофільно заміщення.
Реакція відщеплення, насичених полігалогенопохідних продуктів хлорування метану, галофермна реакція, дихлоркарбон.
Добування
СnH2n+1Hal
R
– CH2
– Hal
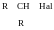
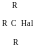
Первинні Вторинні Третинні
Хлорування (галогенування) алкану за радикальним шляхом.
CH4+Cl2→CH3Cl+HCl
Гідрогалогенування алкенів:
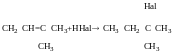
Із спиртів
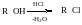
Реакція Фінкельштейна

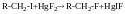
Хімічні властивості галогенопохідних

Індукційний ефект
В результаті перетягування електронної густини в бік більш ЕН атому талогену на атом С виникає частковий позитивний заряд Б+, який визначає електрофільний характер і високу реакційну здатність цих сполук в перетворенних з нуклеофільними реагентами.
Галогеноохідні дуже реакційноздатні сполуки. Їх можна використовувати для отримання майже всіх класів органічних сполук з такою ж самою кількістю атомів С.
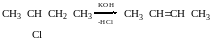
SN1 - реакція заміщення.

Реакція Гофмана

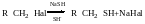
Фактори, які впливають на механічні реакції нуклеофільного заміщення.
Природа групи, яка відходить (нуклеофоб)
Природа R-CH2 вуглеводневого залишку.
Природа діючого реагенту.
Вплив розчинника.
Найкраще в реакції заміни вступають:
R-I›R-Br›R-Cl›R-F

V=k [Nu-] [R-CH2Hal]
В реакцію за механізмом SN2 краще вступ первинні і вторинні галогенопохідні.
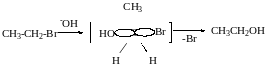
Якщо в реакцію за механізмом SN2 вступають оптично активні сполуки, відбувається зміна конфігурації.
SN1 мономолекулярне нуклеофільне заміщення
Реакція характерна для третинних галогенопохідних і для тих, що утворюють стабільні карбокатіони ( алільні-навіть більш стабільні, ніж третинні).
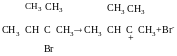
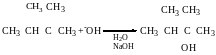
V=k [RHal]
Якщо в реакцію SN1 вступають оптично активні сполуки в результаті утворюються і R, i S, то утворюється рацемат.
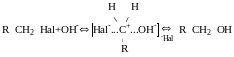

R→S S→R
α-протонні полярні розчинники сприяють перебіганню реакції за механізмом SN2.
Протонні полярні розчинники спрямовують перебіг реакції за механізмом – SN1.
H2O,
CH3-CH2-OH,
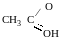 ,
,
Нуклеофільність - це спорідненість до катіона, а основність-до протона.
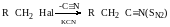
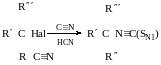
Коли взаємодія відбувається за механізмом SN1, то частинки, які мають амогідентні властивості (здатні реагувати як по одному, так і по іншому атому), взаємодія з третинним карбокатіоном по більш ЕН атому, а за механізмом SN2-більш нуклеофільним атомом.
-О-N=O
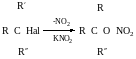
За SN1
За SN2 - з азотом.
Взаємодія галогенопохідних з металами
СН3-CH2-Hal+2Na→CH3-CH2Na+NaHal
СН3-CH2-Na+ СН3-CH2-Hal→ СН3-CH2-СН2-CH3+NaHal
Утворення реактивів Гріньяра
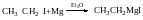
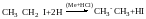
Полігалогенопохідні

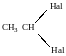
Методи отримання
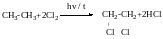

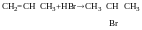

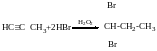

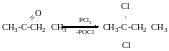
Хімічні властивості полігалогенопохідних
Полігалогенопохідні характеризуються високою термічною стійкістю і високоінертні.

Гемінальне
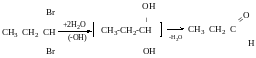

Хлороформ-дуже добрий розчинник, його отримання:
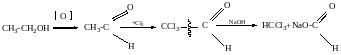
Галоформа реакція (отримання HCHal3, крім HCF3)
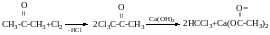
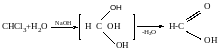
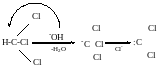
 Cимплетний
Cимплетний
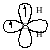 Триплетний
карбен
Триплетний
карбен

Може взаємодіяти по подвійному зв’язку:

Фреони-холодоагенти
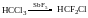

Ненасичені галогенопохідні
 вінільного
типу
вінільного
типу
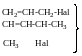 алільного
типу
алільного
типу
 алільне
хлорування
алільне
хлорування
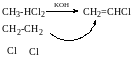
Вінілгалогеніди малоактивні в реакціях нуклеофільного заміщення; вони не взаємодіють з водним розчином NaOH i KCN.
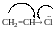 Пара
ē атома СІ проявляє позитивний мезомерний
ефект.
Пара
ē атома СІ проявляє позитивний мезомерний
ефект.
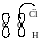 Ця
сполука стає менш реакційноздатною.
Ця
сполука стає менш реакційноздатною.

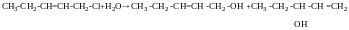
СПИРТИ. СnH2n+1OH
Методи добування, хімічні властивості, взаємодія з Na, внутрішня і міжмолекулярна гідратація. У спиртах присутня група ОН біля sp3 гібридизованого атому карбону.
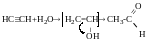
CH3-OH – одноатомний;
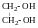 двоатомний;
двоатомний;
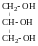 триатомний;
триатомний;
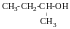 2
бутанол, вторбутиловий спирт,
метилетиокарбінол.
2
бутанол, вторбутиловий спирт,
метилетиокарбінол.
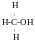 карбінол
карбінол
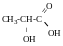 2-гідрокси-пропанова
кислота
2-гідрокси-пропанова
кислота
Ізомерія в спиртах пов’язана з ізомерією у карбоновому ланцюзі, а також із положення ОН групи.
Методи добування первинних спиртів.
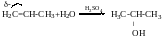
Відновлення альдегідів і кетонів
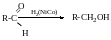

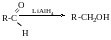
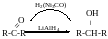
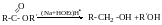
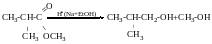
При відновленні альдегідів завжди утворюються первинні спирти, при відновленні кетонів-вторинні.
Реакція Гріньяра
Первинні спирти утворюються з формальдегіду:
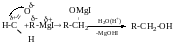
Оксиду етилену:
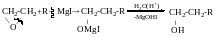

Добування вторинних спиртів
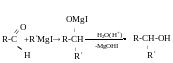

Добування третинних спиртів

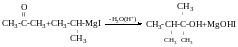
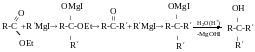
З естерів можна отримати третинний спирт з 2 однакових замісників.
Властивості спиртів
Спирти С1-С10 – рідини
Кислотні властивості спиртів
CH3OH CH3CH2OH H2O більш сильна кислота
Ка 10-17 10-18 10-16

Спирти легко взаємодіють з Na
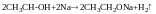
З NaOH не взаємодіють
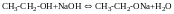

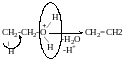
Міжмолекулярна етерофікація
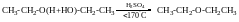
Реакція естерифікації
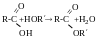
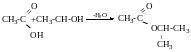
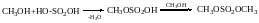
Реакції заміщення
Реакції дегідрування (утворення альдегідів)
Первинні
спирти :
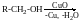
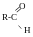
Вторинні
спирти:
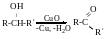
Для третинних не може бути дегідрування.
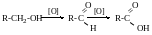

Для третинних спиртів спочатку відбувається дегідратація.
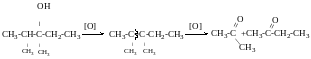
Метанол СН3ОН – добувається шляхом сухої перегонки деревини. Має сильно отруйну дію (2 г – сліпота, 10 г – смерть). Використовується для синтезу формальдегіду; для одержання ліків, барвників та ін.
Етанол – перший спирт, виявляється в процесі спиртового бродіння ( «винний спирт»). Добрий розчинник для органічних сполук. З етанолу одержують оцтову кислоту, діетиловий естер, естери етилацетату, бутилацетату тощо. Етанол діє на організм людини як наркотик і у невеликій кількості викликає сп’яніння, а у великій кількості може призвести до смерті.
С6Н12О6+дріжджі→С2Н5ОН+СО2↑
Двохатомні спирти:
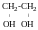 Етилен
гліколь
Етилен
гліколь
Добування.
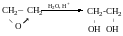
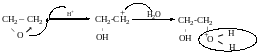
Як на багатоатомні спирти

Механізм пінакан-пінаколінового перегрупування
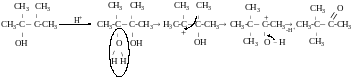
Дегідратація діолів (-Н2О)
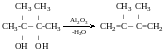
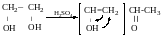
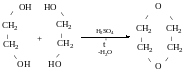
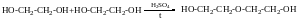
Дегідратація р- гліколів
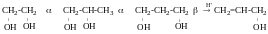
ɣ-гліколів

Окиснення
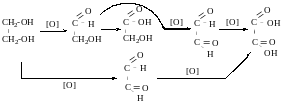
Для визначення будови α-гліколів
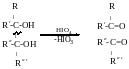 Якщо
R’=H,
то утворюється альдегід.
Якщо
R’=H,
то утворюється альдегід.
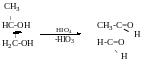
Утворення естерів (в результаті взаємодії кислоти і спирту)
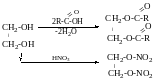 Динітрат-етиленглікаль
Динітрат-етиленглікаль
 Диацетат-етиленгліколь
Диацетат-етиленгліколь
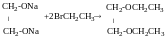 1,2-диетоксиетан
1,2-диетоксиетан
Етиленгліколь

Сильнов’язка рідина, що застосовується для синтезу полімерів, наприклад поліестерів (синтетичного волокна лавсану), як вихідна сировина для отримання таких розчинників, як діоксан. Його застосовують як антифриз для охолодження автомобільних двигунів. Динітрат етиленгліколі використовується як вибухівка. Також це сильна отрута.
Триатомні спирти
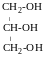 ГЛІЦЕРИН
ГЛІЦЕРИН
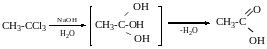
Добування омиленням
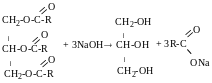
В промисловості добувають з пропену:
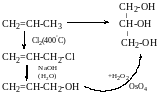

Реакція Реппе

Хімічні властивості
Гліцерин є більш сильною кислотою, ніж одно- і двоатомні спирти. Буде взаємодіяти з NaOH; сильніший, ніж кислота.

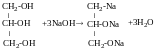
ЯК
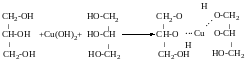
Дегідратація
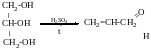
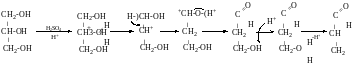
Акралеїн-лакріматор, подразник слизової оболонки.
Окиснення
Селективно щось отримати важко.
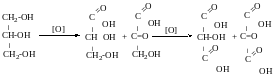
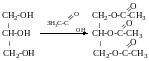 Триацетат
гліцерин
Триацетат
гліцерин
 Тринітрат
гліцерин
Тринітрат
гліцерин