
- •Теорія будови органічних сполук бутлерова
- •Характеристики ковалентного зв’язку
- •Вуглеводні
- •Лабораторні методи
- •Хімічні властивості алканів
- •Радикально-ланцюговий мехнізм
- •Хімічні властивості
- •1,2 Буде 80% 20%
- •Етери. Прості ефіри. R-o-r
- •Альдегіди і кетони
- •Методи одержання
- •Оксосинтез
- •Хімічні властивості альдегідів і кетонів
- •Утворення ацеталів (взаємодія із спиртами):
- •Окиснення карбонільних сполук
- •Реакція «срібного дзеркала»:
- •Карбонові кислоти
- •Хімічні властивості карбонових кислот
- •Функціональні похідні карбонових кислот
- •Методи добування хлорангідридів
- •Принцип мікроскопічної зворотності
- •Ненасичені двохосновні карбонові кислоти
- •Добування
- •Оксокислоти
- •Вуглеводи
- •Утворення напівацеталей:
- •Бродіння глюкози
- •Дисахариди
- •Для сірчаної кислоти (80%) на нітросполуки
- •Реакція Неффе утворюється ацеформа
- •Методи добування
- •Амінокислоти
- •Методи добування
- •Ізомерія
- •Номенклатура
- •Хімічні властивості фенолів
- •Хімічні властивості
- •Хімічні властивості
ПРЕДМЕТ ОРГАНІЧНОЇ ХІМІЇ . ТЕОРІЯ ХІМ. БУДОВИ БУТЛЕРОВА. ПРИРОДА ЗВ’ЯЗКІВ В ОРГАНІЧНИХ МОЛЕКУЛАХ. ОРГАНІЧНІ РЕАКЦІЇ ЗА ХАРАКТЕРОМ ХІМІЧНОГО ПЕРЕТВОРЕННЯ, А ТАКОЖ В ЗАЛЕЖНОСТІ ВІД СПОСОБУ РОЗРИВУ ЗВ’ЯЗКУ.ПОНЯТТЯ ПРО ПРОМІЖНІ ЧАСТИНКИ: РАДИКАЛИ, АНІОНИ, КАРБАНІОНИ.
Предметом органічної хімії є встановлення порядку сполучення атомів у молекулі, їх взаємного впливу, просторового розміщення, а також вивчення їх реакційної здатності.
Органічна хімія - хімія вуглеводнів та їх похідних. Органічні молекули складаються з С та Н, а також О2, азот, галогени, сірка.
Теорія будови органічних сполук бутлерова
Природа органічної речовини: визначається якісним, кількісним складом і хімічною будовою молекул.
Хімічна будова – певний порядок у сполученні атомів у молекулі та їх вазємний вплив.
Хімічна будова визначає фіз.. та хім.. властивості речовини, відповідно можна встановити хімічну будову, знаючи хімічні і фізичні властивості сполук
Речовини, що мають однаковий якісний і кількісний склад, але різну хімічну будову, називаються ізомерами.
С
1s2
2s22p2
2s
 2p
2p
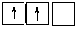
*C






Ковалентний зв'язок – зв'язок, утворений між атомами внаслідок узагальнення їх зовнішніх електронних підрівнів.
Σ-зв'язок утворений перекриванням s, p орбіта лями вздовж осі, що з’єднує центри атомів.
C-H

π-звязки утворюються бічним перекриванням p-орбіталей вздовж площини, що проходить крізь ядра двох атомів.
N2
зовнішній
ел. рівень


Характеристики ковалентного зв’язку
Довжина – відстань між центрами атомів, які утворюють зв'язок (2 атоми).
Енергія зв’язку – енергія, яка необхідна для гемолітичного розриву зв’язку на радикали.
Просторова напрямленість – розташування зв’язків у просторі між атомами у молекулі. Згідно з електронними конфігураціями орбіта лей, які їх утворюють.
Полярність – зміщення електронної пори зв’язку до одного атома завдяки різниці енергій.
σ- σ+
Н - О – Н
Якщо різниця в енергії<0,4 – неполярний ковалентний звязок, якщо >0,4 – полярний, >2 – йонний.
Поляризованість – зміна перерозподілу електронної густини зв’язку під дією зовнішніх чинників (напр.., каталізатор, реагент, розчинник).
Sp3 гібридизація 1 s і 3p-орбіталі
Гібридизація атомних орбіталей – спосіб утворення гібридних орбіта лей шляхом комбінування вихідних s, p або d орбіта лей.
 С*
С*
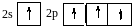
1s+3p=4sp3

105 8’


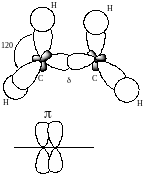
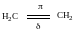
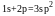
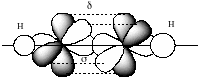
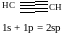
Класифікація органічних сполук за характером хімічного перетворення:
заміщення

приєднання

відщеплення
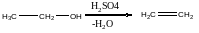
Р-я полімеризації
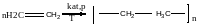
р-я ізомеризації
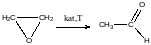 оцтовий
альдегід
оцтовий
альдегід
Класифікація органічних речовин в залежності від способу розриву зв’язку у вих.. молекулах:
гемолітичні р-ї. В них утв. проміжні частинки, які мають 1 неспарений електрон, радикал, не мають заряду і атом С перебуває в sp2 гібридизації. Чим більш стабільний радикал, тим довше він існує

найбільш стабільний
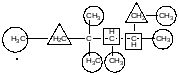


 первинний
первинний
вторинний
третинний
Гетеролітичні р-ї ( з утворенням карбокатіона; -аніона)


Карбон стабіліз., коли розташов в α положенні
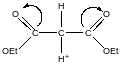
малоновий естер
Вуглеводні
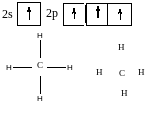
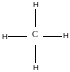
Тема. Алкани, будова алканів, тетраедрична модель молекули метану, характеристика σ-звязків, С-С, С-Н, поняття про вільне обертання навколо зв’язків С-С, конформації ( оборотні ізомери), методи добування алканів.
Класичні вуглеводні (алкани) – вуглеводні з відкритим ланцюгом, атоми С зв’язані між собою одинарними зв’язками, всі атоми у стані sp3 гібридизації.
С-С 0,154 нм 230-360 кДж/моль
С-Н 0,109 нм 410-430 кДж/моль
С-Н більш міцний, але швидше розривається, об знаходиться на поверхні молекулию Конформаційна ізомерія зумовлює обертання атомів або груп атомів навколо зв’язку С-С.
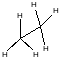
Етан

Затінена конформація

Загальмованя конформація
 більш
енергетично вигідна, ніж затінена 12
кДж/моль
більш
енергетично вигідна, ніж затінена 12
кДж/моль
Алкан
лінійної будови

Промислові методи добування
Оксосинтез (метод Фішера-Тропша)
СО і Н2 – синтез-газ у різних співвідношеннях
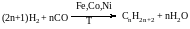
Утв. переважно суміш вуглеводнів, які складаються в основному з алканів лінійної будови (n=2-18) , називається «синтином».
Синтез-газ отримують газифікацією кам’яного вугілля:
е ндотермічна
ндотермічна
Конверсією метану:

Метод гідрування вугілля ( Берцеліус):
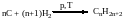
Гідрування ненасичених алкенів:
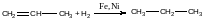
Бо водень на повітрі стає більш активним
