
- •Сольваттану энергиясы
- •15. Дебай - Хюккельдің күшті электролиттер теориясы
- •18. Эквивалентті электрөткізгіштікке температураның әсері
- •29. Гальваникалыќ элементке арналған Нернст теңдеуін шығару
- •30. Электродтық потенциалға арналған Нернст тењдеуініњ термодинамикалыќ негізделуі
- •39. Ион тасымалдау саны
- •40. Гитторф әдісімен ион тасымалдау санын аныќтау
29. Гальваникалыќ элементке арналған Нернст теңдеуін шығару
Егерде электрхимиялыќ элементте тµмендегідей ќайтымды жєне изотермиялыќ реакция ж‰ретін болса:
 ,
,
онда Р=const жаѓдайда осы реакцияныњ Гиббс энергиясы G электр энергиясына тењ болады:

Осыдан

Сонымен ќатар, реакцияныњ Гиббс энергиясы
 ,
,
ал
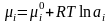 болатындыќтан:
болатындыќтан:

мұнда
 .
- стехиометриялық коэффициенттер,
бастапқы зат үшін теріс таңбамен, ал
өнім үшін оң таңбамен алынған. Сонда
теңдеу
мына т‰рде
жазылады:
.
- стехиометриялық коэффициенттер,
бастапқы зат үшін теріс таңбамен, ал
өнім үшін оң таңбамен алынған. Сонда
теңдеу
мына т‰рде
жазылады:

Тепе-тењдік жаѓдайда берілген Р жєне Т мєндерінде G=0, сондыќтан
 ,
,
Реакцияныњ
барлыќ компоненттерініњ активтілігі
бірге тењ (aі=1)
болѓан жаѓдайда
 ,
м±ндаѓы G0
- Гиббс энергиясыныњ стандартты мєні.
Сонда
,
м±ндаѓы G0
- Гиббс энергиясыныњ стандартты мєні.
Сонда

 ,
,
м±нда Ка - реакцияныњ тепе-тењдік константасы.
Осыдан:



немесе



Егер aі
= 1 болѓан жаѓдайда
 ,
мұнда Е0
- стандартты электрќозѓаушы к‰ш, олай
болса:
,
мұнда Е0
- стандартты электрќозѓаушы к‰ш, олай
болса:

немесе

Б±л тењдеу гальваникалыќ элементтіњ электрќозѓаушы к‰шініњ Нернст тењдеуі деп аталады.
30. Электродтық потенциалға арналған Нернст тењдеуініњ термодинамикалыќ негізделуі
Электродта ММn++ne реакциясы т±раќты температура мен т±раќты ќысымда жүреді дейік. Металдыњ 1г - ионыныњ металдан ерітіндіге ауысу ж±мысы изотермиялыќ ж±мыс, ол изобара - изотермиялыќ потенциал µзгерісіне тєуелді:
 ,
,
м±нда G0 - ионныњ металдаѓы изобаралыќ потенциалы; - ионныњ ерітіндідегі химиялыќ потенциалы.
Электрлік к‰штіњ ж±мысы:
 ,
,
олай болса:

 ,
,
сонда
 ,
,
себебі
 .
.
Ал
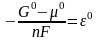 ,
сонда Нернст тењдеуін аламыз:
,
сонда Нернст тењдеуін аламыз:

К‰шті электролиттердіњ термодинамикалыќ теориясы бойынша бұл тењдеуді былай жазуѓа болады:

Электролиттіњ µте с±йылтылѓан ерітіндісінде орташа иондыќ активтілік коэффициенті бірге тењ (=1), сондыќтан соңғы тењдеу ыњѓайлыраќ т‰рге келеді:
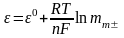
31. Гальваникалық элемент деп химиялық реакцияныњ энергиясы электр энергиясына айналатын жүйені айтады. Мысалы: Якоби – Дэниэлдің элементі өз тұздарының ерітіндісіне батырылған мыс және мырыш электродтарынан тұрады. Схема жүзінде элемент былай жазылады:
Инертті электролитпен толтырылған тұз көпірі көмегімен ерітінділер арасындағы қатынас іске асырылады, мысалы диффузиялық потенциалдыњ мәнін нөлге әкелетін KCl, KNO3 арқылы.
Диффузиялық потенциал деп єртекті электролиттердіњ жанасқан ерітінділерінің шекарасында пайда болатын потенциалды айтады.
Якоби – Дэниэл элементінің жұмысы кезінде электродтарда келесі реакциялар жүреді:
АНОД
КАТОД
ќосындысы (3)
Егер химиялық реакция элементте қайытымды жүрсе онда тізбек қайтымды болады, ал бұл кезде алынатын жұмыс изобара – изотермиялық потенциалдардың кемуіне яѓни Гиббс энергиясыныњ кемуіне тењ максимальді болады:
Электродтар арасындағы потенциалдар айырмасы ( ) гальваникалық элементтің электрќозѓауыш күшінің өлшемін анықтайды.
Электроқозғауыш күш деп бірлік электр зарядының электр өрісініњ бір нүктесінен екіншісіне тасымалдау жұмысын айтады.
(4)
ЭЌК концентрацияѓа тєуелділігі Нернст тењдеуімен аныќталады:
мұнда (5)
Гальваникалық элементтің жұмысы кезінде оның ЭҚҚ-і ерітінді концентрациясының өзгеруі және басқа жағдайларға байланысты тұрақты мәнінде сақталмайды. Сондықтан ЭҚҚ-ның нақты өлшеуі токтың минималды өту кезінде жүру керек. Бұған ЭҚҚ өлшеудің компенсациялық әдісі – Поггендорф әдісі сєйкес береді. Бұл әдіс элементтің ЭҚҚ-ның элементтің қайтымды жұмысы кезінде потенциалдар айырмасын өлшеу жолымен анықтауға мүмкіндік береді.
32. Электролиз тұрақты токтың жүргізу энергиясы және электродтардағы химиялық айналымдардан бөлінетін энергия арқасында жүреді. Сондықтан, электролиз тек электр тогы жүретін орталарда өте алады. Электр тогының өткізгіштеріне назар аударайық. Электролит деп, ерітіндісі арқылы өтетін токтың нәтижесінде жүретін химиялық процесті айтамыз. Электр тогының өткізгіштеріне мыналар жатады: тұздардың, қышқылдардың, негіздердің сулы ерітінділері. Электр тогын өткізетін заттар мен ерітінділер электролит деген атқа ие болды. Сонымен қышқылдар, негіздер және тұздар электролит болып табылады. Токтың нашар өткізгіштері болып дистильднеген су, қанттың, спирттің, глицериннің сулы ерітінділері, сонымен қатар, қалыпты осмотикалық қысымды ерітінділер, соның ішінде, қышқылдар, тұздар мен негіздердің басқа сұйықтардағы ерітінділері жатады. Құрғақ тұздар және сусыз қышқылдар мен негіздер (қатты түрде) ток өткізбейді. Фарадей заңдары
Фарадейдің бірінші заңы «Электр тогының электролит ерітіндісі арқылы өькендегі электродта бөлінетін зат массасы электр көлеміне тура пропорционалды болады».
∆m=kэQ
Мұндағы ∆m-реакцияға түскен заттың мөлшері; Q- электр мөлшері; kэ- электр мөлшерінің бірлігіне қанша зат әсер еткенін көрсететін пропорционалдық коэффициент. k мөлшері электрохимиялық эквивалент деп аталады.
k=M/(Naz|e|)
мұндағы z ион валенттілігі; М электродта бөлінген заттың молярлық массасы; Na Авогадро тұрақтысы, |e|=1,6•10-19 Кл. Фарадейдің екінші заңы Фарадейдің екінші заңы бойынша, өткен электрдің берілген мөлшерінде реакцияға түскен заттардың массаларының қатынасы олардың химиялық эквиваленттерінің қатынасына тең:
∆m1\A1=∆m2\A22=∆m3\A3=const
Элементтің химиялық эквиваленті сутегінің бір атомдық массасын немесе оттегінің жарты атомдық массасын қосатын немесе алмастыратын химиялық қосылыстарда 1\12 атом массасының C12болатын элемент бөлшегі массасы қатынасына тең. «химиялық эквивалент» түсінігі қосылыстарға қолданылады. Солай, қышқылдың химиялық эквиваленті сан бойынша оның молярлық массасының негізіне бөлінуін айтамыз (сутегі иондарының саны), негіздің химиялық эквиваленті-оның молярлық массасының қышқылдығына бөлінуін (бейорганикалық негіздерде- гидроксильді топтардың санына), тұздың химиялық эквиваленті- оның молярлық массасының катиондар немесе аниондар зарядтарының қосындысына қатынасы болып табылады.
Электроэнергия шығынын көбінесе өндірілген зат мөлшерінің бірлігіне теңестіреді, вт сағ\кг немесе квт сағ\т өлшенеді. Тұрақты ток электрэнергиясының 1т электролизбен өндірілген өнімге кеткен шығымын есептеу үшін келесі формуланы қолдану:
W=1•106•U\kηток•1000
Мүндағы W-тұрақты ток электроэнергиясының шығыны кВтсағ\т; U- электролизердегі кернеу,В; k-электрохимиялық эквивалент, грамм\а•r; һ ток- ток бойынша шығыны, бірлік мөлшері; 1000-айналдыру коэффициенті, вт•сағ тан квт•сағ қа. Айнымалы токтың өндірілген өнімгің бірлігне кеткен электрэнергия шығымын тұрақты ток энергиясы шығымы айнымалы токтың тұрақтыға айналу кезіндегі коэффициент мөлшеріне қатынасымен анықталады. электролит балқымасы немес ерңтңндң арқылы электр тогының өткізілуі уақыт аралығында және пайда болатын және шығындалатын зат мөлшері аралығында Фарадей заңдарымен анықталатын қатаң қатынастар болады.
33. Бірінші текті электродтар. Ондағы металл тотықсызданған түр-ге жатса, ал осы металдың ионы тотыққан болып есептеледі. Бұған мысал ретінде мыс пен мырыш электродтарын алуға болады. Бұл электродтардағы потенциал айырымы катиондардың активті-лігінен функционалды тәуелділікте болғандықтан, оны катион арқылы қайтымдылықта болатын электродтар дейді.
Сондай-ақ бірінші текті электродтар қатарында аниок арқылы қайтымды болатын электродтар да бар. Мысалы, селенді элек-тродта Sе + 2е=Sе2~ реакциясы жүреді. Мұндағы потенциал айыр-масы:E=E—
Сол сияқты амальгамды электродтар да осы топқа жатады. Амальгама дегеніміз сынаптың басқа металмен қоспасы немесе өзге металдың сынаптағы ерітіндісі. Бұған кадмий металының сынаппен қосылып құраған амальгамасы мысал болады. Ондағы сынапта кадмий металы еріген ерітінді — амальгама тотықсыз-данған түрге жатады. Мұндайда Вестон элементі дейді және онда Сd2+ + 2е^Сd реакция жүреді. Амальгамадағы кадмийдің активтілігі амальгаманың концентрациясына тәуелді:
Е=Е* + 1п 2*2- .
Екінші текті электродтар. Бұл электродтар сырты өзінің ері-мейтін тұзымен қапталып, анионның жақсы еритін тұзының ері-тіндісіне батырылған металдан тұрады. Мысалы, күміс сымын суда ерімейтін күміс хлоридімен қаптап, сосын оны суда жақсы еритін хлорлы калий не тұз қышқылының ерітіндісіне батырса, екінші текті электродтар қатарына жататын, хлоркүміс электро-ды деп аталатын электрод шығады. Оның электродты реакциясы АgС1 (к) +е~^Аg+ + С1~ түрінде жазылады. Ал потенциал айыры-
кт мы: Е = Е°. Келесі екінші текті злектродтың жиі кез-
десетін түрі — каломельді электрод. Ол Нg2С2 каломельден, сы-наптан және белгілі концентрациядағы хлорлыкалий тұзынан тұрады, басқаша айтқанда, каломельмен сынапты қосып, оны мүқият араластыра келіп алынған пастаны белгілі концентрация-дағы хлорлы калий ерітіндісіне салады. Сонда Нg2СІ2(к) + 2е= 2Нg с) +2С1~ электродты процесі жүреді. Ал оның электродты потенциалы хлоркүмістікі сияқты анықталады.
Газды электродтар маңызды топ құрайды. Олар электродты процеске тікелей өзі қатыспайтын, бірақ газды өзіне адсорбция-лайтын қабілеті бар мсталдан тұрады. Ондағы электродты процестерге адсорбцияланған газ және оған сәйкес ерітіндідеп ион-
106
дар қатысады. Олардың арасындағы аса маңыздыларының бірі — сутек электроды. Мұндай электрод алу үшін негізінен жұқа бор-пылдақ платина қабатымен қапталған, платина сымын не пласти-насын күкірт қышқылына батырады. Электродтағы крышқыл арқылы сутек газын жібергенде, электродтың сыртындағы платина-ның жұқа борпылдақ қабаты сутекке қанығып, газды өз бойына адсорбциялайды. Электродта адсорбцияланған сутек молекулала-рыньщ біраз мөлшері жеке атомдарға ыдырап, ионданады: Н2(адс)—2Нч^2Н+ + 2е. Бұл процестегі электродтық потенциалдың айырымы сутек ионының активтілігі мен сутек қысымына тә-уелді. Сутек электроды катионмен салыстырғанда қайтымды.
Газды электродтар анионмен салыстырғанда қайтымды бола алады. Оған оттек электроды мысал. Мұнда да сырты жұқа бор-пылдақ платинамен қапталған платина электроды сілті ерітіндісі-не батырылады да, олар арқылы оттек жібереді. Демек, бұл екі электродтьщ біріншісіндегі қышқыл орнына екіншіде сілті, ал су-тек орнына оттек пайдаланылады.
Редокс-электрод немесе тотығу-тотықсыздану электроды деп, электрод құрамына енетін заттардың өзі реакцияға қатыспайтын, бірақ ерітіндідегі тотығу-тотықсыздану реакцияларында тек элек-трондарды тасымалдауға ғана қатысатын жарты элементтерді ай-тады. Мәселен, Fе5+ + еFе2+ немесе Sп3 + е^з=:S5п2+. Мұндай тотығу-тотықсыздану системасына индиферентті электродты ба-тырған кезде пайда болатын потенциалды редокс-потенциалы деп айтады. Ал (119) жалпы қатынас бойынша мұндай элементтегі редокс-потенциалы (Е) температураға, системаның табиғатына (Е°) және тотыққан-тотықсызданған түрдегі активтілік қатынас-тарына тәуелді болады.
34. Олар электродты процеске тікелей өзі қатыспайтын, бірақ газды өзіне адсорбция-лайтын қабілеті бар мсталдан тұрады. Ондағы электродты процестерге адсорбцияланған газ және оған сәйкес ерітіндідеп ион-
дар қатысады. Олардың арасындағы аса маңыздыларының бірі — сутек электроды. Мұндай электрод алу үшін негізінен жұқа бор-пылдақ платина қабатымен қапталған, платина сымын не пласти-насын күкірт қышқылына батырады. Электродтағы крышқыл арқылы сутек газын жібергенде, электродтың сыртындағы платина-ның жұқа борпылдақ қабаты сутекке қанығып, газды өз бойына адсорбциялайды. Электродта адсорбцияланған сутек молекулала-рыньщ біраз мөлшері жеке атомдарға ыдырап, ионданады: Н2(адс)—2Нч^2Н+ + 2е. Бұл процестегі электродтық потенциалдың айырымы сутек ионының активтілігі мен сутек қысымына тә-уелді. Сутек электроды катионмен салыстырғанда қайтымды.
Газды электродтар анионмен салыстырғанда қайтымды бола алады. Оған оттек электроды мысал. Мұнда да сырты жұқа бор-пылдақ платинамен қапталған платина электроды сілті ерітіндісі-не батырылады да, олар арқылы оттек жібереді. Демек, бұл екі электродтьщ біріншісіндегі қышқыл орнына екіншіде сілті, ал су-тек орнына оттек пайдаланылады.
тотығу-тотықсыздану электроды деп, электрод құрамына енетін заттардың өзі реакцияға қатыспайтын, бірақ ерітіндідегі тотығу-тотықсыздану реакцияларында тек элек-трондарды тасымалдауға ғана қатысатын жарты элементтерді ай-тады. Мәселен, Fе5+ + еFе2+ немесе Sп3 + е^з=:S5п2+. Мұндай тотығу-тотықсыздану системасына индиферентті электродты ба-тырған кезде пайда болатын потенциалды редокс-потенциалы деп айтады. Ал (119) жалпы қатынас бойынша мұндай элементтегі редокс-потенциалы (Е) температураға, системаның табиғатына (Е°) және тотыққан-тотықсызданған түрдегі активтілік қатынас-тарына тәуелді болады.
35. Химиялық элемент. Химиялық процестердің энергиясын бірден және тікелей электр энергиясына түрлендіріп жіберетін электро-химиялық элементтерді химиялық деп атайды. Олар әр түрлі екі элементтен тұратындықтан, оларға әр түрлі табиғи сипаттағы электоодты реакциялар тән. Екі электродтағы ерітінді бірдей болса, яғни екі электрод бір электролит ерітіндісіне батырылса, онда мұндай элементті тасымалсыз элемент деп атайды. Әрине, мұндай электродтарда диффузиялық потенциал айырымы болуы мүмкін емес. Процесс бұған кері болса, айталық, екі электрод не екіге бөлінген, не екі ыдыстағы екі электролит ерітіндісіне баты-рылса, онда осы электролит ерітінділерінің арасын жалғастыру-шысы бар элементті тасымалды дейді.
Тасымалды химиялық элементтер қатарына Якоби-Даниэль элементі жатады:
(-)Zп|ZпSО4||СиSО4|Си( + )
Бұл элементте электрохимиялық механизм бойынша, өздіпнен Zп + СиSО4->-Си + ZпSО4 химиялық процесс жүреді. Бір электродта Zп->-Zп2+ + Zе реакция бойынша мырыш тотықса, ал екінші мыс электродында Си2+ + 2е->-Си реакция бойынша мыс тотықсызда-нады. Ал, егер жалпы элементтегі электрод потенциалын салыс-тырғанда, мырыш электроды теріс, мыс электроды оң зарядта-лады екен. Егер екі электролит ерітіндісіндегі диффузиялық по-тенциалды болдырмаса, онда бұл элементтің электр қозғаушы күші келесі тендеумен анықталады:
пт а 2+ +я
Е = ЕСи -Еzn = E-E+ немесе Г = 298 К, aси =аzп =1 болғандықтан,
Тасымалсыз химиялық элементке Вестон элементі мысал бола-ды. Ол да бұрын қарастырғандай
(-)Сd, Нg|СdSО4 (қаныққан) Hg2SO4Hg(+)
109
тізбегінен тұрады. Ол бірінші текті электрод — 12 процентті кад-мий және сынап амальгамы мен екінші текті электрод — сынап пен сынап сульфатынан тұрады. Бұл элементтің электр қозғаушы күші температураға ғана тәуелді де уақытқа тәуелсіз. Сондықтан да Вестон элементі стандартты электр қозғаушы күш көзі ретінде өте жиі қолданылады.
36-37. Концентрациялық элементтер. Бірдей электродтардан тұра-тын элементті концентрациялық дейді. Бұл элементтердін, екі электродында да әрекеттесетін заттардың тотыққан немесе то-тықсызданған түрлеріндегі активтілікті теңеу үшін тасымалдауға арналған жұмысты электр энергиясына айналдырады. Мүндай элементтер электр қозғаушы күштің көзі ретінде екі электродта-ғы әрекеттесуші заттардың тотыққан не тотықсызданған түрш-дегі активтіліктер теңелгенше жұмыс істейді. Бұл электродтарда-ғы стандартты потенциал өзара тең болғандықтан, олардын, айыр-масы нөл болады (E0 = 0).
Ион тасымалдайтын электродка
(-)Ag!AgNO3(a1)!!AgNO3(a2)!Ag(+)
тізбекті элемент мысал бола алады. Бұл элементтегі екі электрод та бірдей, ондағы электролит ерітінділерінің активтілігі тең емес, яғяи, а1<а2. Сонда, активтілігі а1 болатын сұйық электролитке батырылған күміс электрод онда ериді не теріс зарядталады, ак-тивтілігі а2 болатын электролитке енген күміс электрод, керісін-ше, ерітіндіден өзінің беткі қабатына ерітіндіден бөлінген күміс иоиын жинап, оң зарядталады. Бұл элементтің электр қозғаушы күші, диффузиялық потенциалды есептемегенде
E=E+-E-= (120)
теңдеуімен анықталады.
Ионы тасымалданатын элементтер кейбір теориялық және қолданбалы маңызы бар мәселелерді шешу үшін кеңінен қолда-нылады: ерігіштік көбейтіндісін анықтау, комплекс түзілетін ре-акциялардың константасын анықтау және басқалар.
Ионы тасымалданбай жүретін концентрлі злементке газды электродтар тізбегі мысал болады. Онда екі электрод бірдей электролитке батырылғанымен және бірдей газбен қанықса да ондағы газдардың қысымы өзара тең емес, яғни Р<Р2. Оған екі хлор электродын алсақ, оның элементтік тізбегі:
(-)С12(P1), Рt|НС1 Рt, С12(Р2) ( + ).
Әдетте теріс электродта тотығу реакциясы (2С1~ — 2е->-СІ2 (РІ)), ал оң электродта тотықсыздану реакциясы (СI2(P2) +2е-> ->-2С1) жүреді. Элемент системасындағы екі қысымның теңелуі бағытында жүрген тотығу-тотықсыздану реакцияларынын, қосын-дысы электр қозғаушы күштің пайда болуына әкеледі және оның шамасы:
E=E+-E-= 121
38.
http://stu.alnam.ru/book_els-38
