
- •Сольваттану энергиясы
- •15. Дебай - Хюккельдің күшті электролиттер теориясы
- •18. Эквивалентті электрөткізгіштікке температураның әсері
- •29. Гальваникалыќ элементке арналған Нернст теңдеуін шығару
- •30. Электродтық потенциалға арналған Нернст тењдеуініњ термодинамикалыќ негізделуі
- •39. Ион тасымалдау саны
- •40. Гитторф әдісімен ион тасымалдау санын аныќтау
18. Эквивалентті электрөткізгіштікке температураның әсері
Эквивалентті электрөткізгіштікке температураға тәуелділігі келесі теңдеумен өрнектеледі:
t = 25[1+а(t-25)] ,
мұнда а - температуралық коэффициент.
Эквивалентті электрөткізгіштіктің концентрацияға тәуелділігі
Эквиваленттік электрµткізгіштіктіњ концентрацияѓа тєуелділігі к‰рделі, біраќ бинарлы к‰шті электролиттердіњ төмен концентрациялы ерітінділері ‰шін тµмендегі тењдеулермен µрнектеледі (1-сурет):
С = - А
С = - В,
мұнда А және В – т±раќты шамалар.
Жалпы алѓанда эквиваленттік электрµткізгіштік ерітіндіні с±йылтќан сайын µсіп отырады, оныњ себебі к‰шті электролиттер ‰шін ион-иондыќ єсерлесулердіњ азаюы, сµйтіп иондар ќозѓалѓыштыѓыныњ артуы болады.
Шексіз кµп с±йылтќанда (С0) эквиваленттік электрµткізгіштік µзініњ максимал мєніне тењеседі, ол мєнді максимал электрµткізгіштік () деп атайды,,
19.
 Титрлеуде титрлейтін ерітіндіні қосқан
сайын ерітіндінің электр өткізгіштігін
өлшеп отырады. Ординат өсіне меншікті
электр өткізгіштіктің мәндерін, абсцисса
өсіне титрлейтін реагенттің концентрациясын
салып график тұрғызылады. Графиктегі
АВ және ВС түзулерінің қиылысқан нүктесі
эквиваленттік нүктені береді. АВ сызығы
қышқыл мен оған сілті қосқанда түзілетін
тұздың электр өткізгіштерінің қосындысын
береді. ВС сызығы түзілген тұздың
бейтараптау реакциясынан кейінгі электр
өткізгіштігі мен қосылған сілтінің
артық мөлшерінің электр өткізгіштігінің
қосындысын береді. Әдеттегі титрлеу
мен потенциометрлік титрлеу кейбір
жағдайларда (мысалы, өте әлсіз қышқылдар
мен негіздерді титрлеуде, тұнба түсетін
реакцияларда т.с.с.) қолданылмайтын
болса, кондуктометрлік титрлеу барлық
жағдайларда қолданыла алады.
Титрлеуде титрлейтін ерітіндіні қосқан
сайын ерітіндінің электр өткізгіштігін
өлшеп отырады. Ординат өсіне меншікті
электр өткізгіштіктің мәндерін, абсцисса
өсіне титрлейтін реагенттің концентрациясын
салып график тұрғызылады. Графиктегі
АВ және ВС түзулерінің қиылысқан нүктесі
эквиваленттік нүктені береді. АВ сызығы
қышқыл мен оған сілті қосқанда түзілетін
тұздың электр өткізгіштерінің қосындысын
береді. ВС сызығы түзілген тұздың
бейтараптау реакциясынан кейінгі электр
өткізгіштігі мен қосылған сілтінің
артық мөлшерінің электр өткізгіштігінің
қосындысын береді. Әдеттегі титрлеу
мен потенциометрлік титрлеу кейбір
жағдайларда (мысалы, өте әлсіз қышқылдар
мен негіздерді титрлеуде, тұнба түсетін
реакцияларда т.с.с.) қолданылмайтын
болса, кондуктометрлік титрлеу барлық
жағдайларда қолданыла алады.
20. эквиваленттік нүктеге дейін электр өткізгіштіктің өсуі нашар диссоциацияланатын қышқылдар мен негіздерге тән жағдай, мысалы, бор қышқылының натрий гидроксидімен титрленуін қарастырсақ:
4H3BO3 + 2NaOH = Na2B4O7 + 7H2O.
Мұнда бор қышқылының сұйылтылған ерітіндісінің алғашқы электр өткізгіштігі қышқылдың нашар диссоциацияланатына байланысты өте аз. Оған сілтіні қоса бастағанда жақсы диссоциацияланатын тұз Na2B4O7 түзіледі, соның әсерінен электр өткізгіштік өседі (3-сурет).

3-сурет. Әлсіз қышқылды күшті негізбен титрлеудің кондуктометрлік қисығы
Эквиваленттік нүктеден кейін, әрі қарай қосылатын ОН-- иондарының үлкен қозғалғыштығына байланысты қисық кенет жоғарылайды. 3-суретте тәжірибеден алынған титрлеу қисығы (пунктир қисық) эквиваленттік нүктені, анық көрсетпейді (сыну нүктесі анық байқалмайды), сондықтан эквиваленттік нүктені табу үшін тұздың ОВ қисығын реагенттің СД қисығымен қиылысқанша созады, қиылысу нүктесі эквиваленттік нүктені (Э) береді.
Әлсіз қышқылдардың диссоциациялану константасы 0,1н ерітіндісі үшін 10-10-нен, 0,01н ерітіндісі үшін 10-9-нен, 0,001н ерітіндісі үшін 10-8-нен аспайтын жағдайда оларды кондуктометрлік титрлеуге болатыны тәжірибен белгілі болды, өйткені әлсіз қышқылдардың титрлену қисықтарының формасы олардың концентрациясы мен диссоциациялану константасына күшті тәуелді болады.
21.
 5-сурет.
Күшті және әлсіз қышқылдардың қоспасын
кондуктомерлік титрлеудің қисығы
5-сурет.
Күшті және әлсіз қышқылдардың қоспасын
кондуктомерлік титрлеудің қисығы
Таза заттың ерітіндісін титрлеумен қатар, кондуктометрлік титрлеу әдісі күшті және әлсіз қышқылдардың (немесе негіздердің) қоспаларын титрлеуге де қолданылады. Бұл кезде титрлеу қисығында екі сыну нүктелер пайда болады (5-сурет): бірінші нүкте (В) күштіқышқылдың, екіншісі (С) әлсіз қышқылдың эквиваленттік нүктелерін береді. Бірінші сыну нүктесі әдетте онша анық болмайды, себебі оған жақындағанда әлсіз қышқыл титрлене бастайды да электр өткізгіштік әлсіз қышқылдың тұз қисығы бойымен өсе бастайды. Күшті қышқылдың бейтараптану қисығы (АВ) өте майысқан жағдайда әлсіз қышқылдың диссоциациялануын азайту үшін титрлеуді этил спиртінің қатысында жүргізеді.
Екі әлсіз қышқылдың қоспасын титрлеу, егер олардың диссоциациялану константаларының айырмашылығы көп болса, күшті қышқыл мен әлсіз қышқылдың қоспасын титрлеген жағдайда ұқсас болады.
Электролиттер қоспасын кондуктометрлік титрлеудің тағы бір мысалы күкірт қышқыл мен мыс сульфатының қоспасын сілтімен титрлеу болады. Бұл кезде алдымен қышқыл бейтараптанып, соның себебінен электр өткізгіштік тез азаяды. Содан соң сілті мыс сульфатымен әрекеттесіп мыс гидроксидін Cu(OH)2 түзеді:
Cu2+ + SO42- + 2Na+ + 2OH- = 2Na+ + SO42- + Cu(OH)2.
Бұл
кезде
электр
өткізгіштік
аздап
өзгереді,
өйткені
натрий
ионының
электр
өткізгіштігінің
(l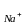 =
50,1) мыс
ионының
электр
өткізгіштігінен
(l
=
50,1) мыс
ионының
электр
өткізгіштігінен
(l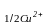 =
56) айырмашылығы
өте
аз.
Мыс
тұнбаға
түсіп
біткен
соң
сілтінің
артық
мөлшері
электр
өткізгіштікті
тез
өсіреді.
=
56) айырмашылығы
өте
аз.
Мыс
тұнбаға
түсіп
біткен
соң
сілтінің
артық
мөлшері
электр
өткізгіштікті
тез
өсіреді.
Кондуктометрлік әдісті орынбасу реакцияларының соңғы нүктесін анықтау үшін де қолдануға болады, мысалы, аммонийды оның тұзының ерітіндісінен, әлсіз қышқылдарды олардың тұздарының ерітіндісінен, аминқышқылдарының немесе полипептидтердің эквиваленттік массаларын анықтауда қолданылады.
22-23.
1.
Металл иондарының біразы ерітіндіден
электродқа өткенде, өткен оң зарядты
иондардың әсерінен электрод та оң
зарядталады, сөйтіп ерітіндіден электрод
бетіне қышқыл қалдығының теріс зарядты
иондары тартылады. Мәселен мыс пластинкасын
мыс сульфатының ерітіндісіне батырғанда
ерітіндіден мыс пластинкасына қарай
өтеді, соның әсерінен пластинка оң
зарядталады да, бетіне ерітіндіден
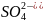 иондарын электростатикалық күшпен
тартады.
иондарын электростатикалық күшпен
тартады.
Оң зарядталған электродтың бетінде теріс зарядталған иондардың қабаты түзелетіндіктен олардың арасында электрлік потенциал секірмесі пайда болады (1және 2-суреттер).
Теріс
зарядты иондардың бір бөлігі электрод
бетіне ионның радиусына тең минималды
қашықта ( )
тартылады. Бұл
-ден
үлкен қашықтықта оң зарядты да және
теріс зарядты да иондар болады, теріс
зарядты иондар артығырақ болады, бірақ
электродтан алыстаған сайын азая бастап,
белгілі бір қашықтықта оң және теріс
зарядты иондардың концентрациясы
теңесіп ерітінді электрбейтарап болады,
яғни зарядсызданады.
)
тартылады. Бұл
-ден
үлкен қашықтықта оң зарядты да және
теріс зарядты да иондар болады, теріс
зарядты иондар артығырақ болады, бірақ
электродтан алыстаған сайын азая бастап,
белгілі бір қашықтықта оң және теріс
зарядты иондардың концентрациясы
теңесіп ерітінді электрбейтарап болады,
яғни зарядсызданады.
Электродтың
зарядталған беті мен оған ерітіндіден
тартылып тұрған қарама-қарсы зарядталған
иондардың қабаты қос электрлік қабат
деп аталады. Электрод бетіне тығыз
 жанасқан иондардың қабатын қос эхлектрлік
қабаттың тығыз бөлігі деп аталады. Бұл
бөлікте электрод пен оған тығыз жанасқан
иондардың центрлері арқылы өтетін
жазықтық арасында потенциал секірмесі
жанасқан иондардың қабатын қос эхлектрлік
қабаттың тығыз бөлігі деп аталады. Бұл
бөлікте электрод пен оған тығыз жанасқан
иондардың центрлері арқылы өтетін
жазықтық арасында потенциал секірмесі
 әріпімен белгіленеді. Қос электрлік
қабаттың тығыз бөлгінен кейін орналасқан
бөлігін диффузиялық бөлік деп атайды.
әріпімен белгіленеді. Қос электрлік
қабаттың тығыз бөлгінен кейін орналасқан
бөлігін диффузиялық бөлік деп атайды.
Қос
электрлік қабаттың тығыз бөлігінен
кейінгі бөлікте потенциал өзгерісі
сызықты емес, оны
 деп белгілейді.
деп белгілейді.
Электрод
пен ерітінді шекарасында потенциалдың
толық өзгерісі (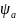 )
қос электрлік қабаттың тығыз және
диффузиялық бөліктеріндегі потенциал
секірмелерінің қосындысына тең:
)
қос электрлік қабаттың тығыз және
диффузиялық бөліктеріндегі потенциал
секірмелерінің қосындысына тең:
=𝝍+ (1)
және ол абсолюттік потенциал секірмесі деп аталады.
2. Металл атомдарының біразы оң зарядты иондар түрінде ерітіндіге көшкен жағдайда электродта электрондардың артық мөлшері қалатындықтан ерітіндіге қарағанда электрод теріс зарядталады, сөйтіп өзінің бетіне ерітіндіден оң иондарды тартады. Тартылған оң иондар электродтың оң зарядталған қабатын түзеді (3 және 4-суреттер). Мұндай құбылыс мырыш электродтын өзінің тұзының ерітіндісіне батырған кезде байқалады.
3.
Ерітіндіде электрод материалының
иондары жоқ жағдайда да электроерітінді
шекарасында потенциал секірмесі пайда
болуы мүмкін, бұл жағдайда электрод
берілген ортада инертті болады. Мысалы,
платиналанған пластинка электродын
тұз қышқылының сұйылтылған ерітіндісіне
батырса және ерітінді арқылы сутек
газын жіберсе, сутек газы пластинка
бетіне адсорбцияланады, адсорбцияланған
сутек пен ерітінді арасында тепе-теңдік
орнайды:
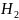 =
= ,
сөйтіп пластинкада электр заряды пайда
болады, электрод бетінде қос электрлік
қабат түзіліп пластинка мен ерітінді
шекарасында электр потенциалының
секірмесі пайда болады. Потенциал
секірмесін тудырудағы платинаның немесе
басқа да инертті материалдардың рөлі
олардың электродтық реакцияға қатысатын
электрондарды өз бойынан өткізу
қабілетінде.
,
сөйтіп пластинкада электр заряды пайда
болады, электрод бетінде қос электрлік
қабат түзіліп пластинка мен ерітінді
шекарасында электр потенциалының
секірмесі пайда болады. Потенциал
секірмесін тудырудағы платинаның немесе
басқа да инертті материалдардың рөлі
олардың электродтық реакцияға қатысатын
электрондарды өз бойынан өткізу
қабілетінде.
24-25. Қос электірлік қабат – кеңістікте қарама-қарсы таңбалы электр зарядтарымен бөлініп тұрған екі фазааралық бөлу шекарасында түзілетін өте жұқа беттік қабат. Фазалардың өзара әрекеттесу нәтижесінде фазааралық беттерде қос электрлік қабат пайда болатындықтан, дисперсті жүйелер фазаларының қозғалысын электрлік өрісте де байқауға болады.
ҚЭҚ пайда болу механизмі:
функциональды топтардың беттік диссоциациясы;
электролит иондарының адсорбциясы;
фазааралық шекте полярлы молекулалардың бағытталуы.
Көрсетілген әрететтердің нәтижесінде бет бір фазаның бер жағынан оң, ал басқа жағынан теріс зарядталады.

Сурет 14.1
ҚЭҚ потенциалы 0 зарядталған беттен және қарама – қарсы ионнан тұратын кері зарядталған қабат бөлігінен тұрады. Қарама – қарсы иондардың бір бөлігі беттке тікелей жабысып, тығыз (адсорбциялық) қабат – Гельмгольц қабатын түзеді. Ал қалған қарама – қарсы ион бөліктері жылу қозғалыстарының әсерінен фазаның бүкіл көлеміне таралып, диффузиялық қабат немесе Гуи қабатын түзеді.
Гельмгольц қабатының қалыңдығы қарама – қарсы иондар диаметріне тең.
Гуи – Чэпмен теориясы б/ша диффузиялық қабаттағы потенциал арақашықтықа байланысты кемиді:
 (14.1)
(14.1)
- диффузиялық қабатың потенциалы, х – ҚЭҚ диффузиялық қабатынан басталған арақашықтық, - диффузиялық қабаттың қалыңдығынан кері шама.
Бір фазаның екіншімен салыстырғанда жылжуы, сырғанау жазықтығында ҚЭҚ – тың бөлінуі жүреді және - электрокинетикалық потенциал пайда болады.
Электрлік өріс әсерінен дисперсті фаза бөлшектерінің жылжуы (электрофорез) немесе дисперсті ортаның жылжуы (электроосмос) мүмкін.
Дисперсті ортамен салыстырғанда дисперсті фаза бөлшектерінің механикалық қозғалуы (седиментация) потенциалдардың электрлік айырымын тудырады(седиментация потенциалы, Дорн эффектісі байқалады).
Дисперсті фазамен салыстырғанда дисперсті ортаның жылжуы электр айырымын тудырса, ағу потенциалы пайда болады (Квинке эффектісі байқалады).
Электрофорез және электроосмос құбылыстары кезінде пайда болатын электрокинетикалық потенциалды Гельмгольц – Сумолуховский теңдеуі б/ша есептейміз:
 немесе
немесе
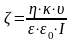 (14.2)
(14.2)
U0-фазалар қозғалысының сызықты жылдамдығы, Е–элект өрісінің кернеулігі, - ортаның меншікті электр өткізгіштігі, - орта қозғалысының көлемдік жылдамдығы, I – ток күші
26.
Гальваникалық элемент деп химиялық реакцияныњ энергиясы электр энергиясына айналатын жүйені айтады. Мысалы: Якоби – Дэниэлдің элементі өз тұздарының ерітіндісіне батырылған мыс және мырыш электродтарынан тұрады. Схема жүзінде элемент былай жазылады:
![]()
![]()
![]()
![]()
Инертті электролитпен толтырылған тұз көпірі көмегімен ерітінділер арасындағы қатынас іске асырылады, мысалы диффузиялық потенциалдыњ мәнін нөлге әкелетін KCl, KNO3 арқылы.
Диффузиялық потенциал деп єртекті электролиттердіњ жанасқан ерітінділерінің шекарасында пайда болатын потенциалды айтады.
Якоби – Дэниэл элементінің жұмысы кезінде электродтарда келесі реакциялар жүреді:
АНОД
![]()
КАТОД
![]()
ќосындысы
![]() (3)
(3)
Егер химиялық реакция элементте қайытымды жүрсе онда тізбек қайтымды болады, ал бұл кезде алынатын жұмыс изобара – изотермиялық потенциалдардың кемуіне яѓни Гиббс энергиясыныњ кемуіне тењ максимальді болады:
![]()
Электродтар
арасындағы потенциалдар айырмасы (
![]() )
гальваникалық элементтің электрќозѓауыш
күшінің өлшемін анықтайды.
)
гальваникалық элементтің электрќозѓауыш
күшінің өлшемін анықтайды.
Электроқозғауыш күш деп бірлік электр зарядының электр өрісініњ бір нүктесінен екіншісіне тасымалдау жұмысын айтады.
![]() (4)
(4)
ЭЌК концентрацияѓа тєуелділігі Нернст тењдеуімен аныќталады:
 мұнда
мұнда
![]() (5)
(5)
Гальваникалық элементтің жұмысы кезінде оның ЭҚҚ-і ерітінді концентрациясының өзгеруі және басқа жағдайларға байланысты тұрақты мәнінде сақталмайды. Сондықтан ЭҚҚ-ның нақты өлшеуі токтың минималды өту кезінде жүру керек. Бұған ЭҚҚ өлшеудің компенсациялық әдісі – Поггендорф әдісі сєйкес береді. Бұл әдіс элементтің ЭҚҚ-ның элементтің қайтымды жұмысы кезінде потенциалдар айырмасын өлшеу жолымен анықтауға мүмкіндік береді.
27.
Электродтар сыртќы тізбекте бір-бірімен жалѓасќан кезде мыс электродында тотыќсыздану, мырыш электродында тотыѓу реакциялары ж‰реді:
Cu2++2e-Cu
ZnZn2++2e
Мырыш электродында ж±псыз ќалѓан электрондар сыртќы тізбекпен мыс электродына ќарай µтіп мысты тотыќсыздандырады. Гальваникалыќ элемент ж±мыс істеп т±рѓан кезде ерітіндіе (ішкі тізбекте) электр тогы мыс жєне мырыш иондарымен мырыш электродына ќарай, ал сульфат иондарымен мыс электродына ќарай тасымалданады.
Мыс жєне мырыш электродыныњ тепе-тењдік потенциалдарыныњ мыс пен мырыш активтіліктеріне тєуелділігі Нернст тењдеуімен µрнектеледі:


28.
Егер металды суға салатын болсақ, оның катиондары сұйықтыққа өте бастайды. Катион бетінде электр зарядының болуына байланысты метал бетінде өлшемі бойынша тең, таңбасы бойынша қарама қарсы болатын заряд артық электрондар түрінде жүреді, яғни металл беті теріс зарядталған болады. Ол өзіне металдың ерітіндіге өткен оң зарядты иондарын біртіндеп тарта бастайды, сол арқылы ктиондар ерітінді көлеміне еркін өте алмайды. Сондықтан, металл мен ерітінді шекарасында теріс жағы металл беті, ал оң жағы еріген иондардың жанасу қабаты болып келетін жазық конденсатор тәрізді жұп электрлік қабат түзіледі. Иондардың аз мөлшері ерігеннен кейіннен ақ жұп қабаттың заряды соншалықты өседі, металдың балқуы тоқталады. Егер металл суға емес, өзінің иондарының ерітіндісне салынған болса, (мвсалы, Zn ті ZnSO4 ке салғанда), онда бұл процесс біршама өзгеше болады. Егер ерітінді концентрациясы аз болса, онда жұп электрлік қабаттың түзілуі металдың судағы ерітіндісіндегідей өтеді. Егер ерітіндіде иондар концентрациясы жоғары болса, онда алдымен металл бетіндегі оң зарядталған катиондардың тұнбаға түсуі байқалады. Енді металл беті өзіне теріс иондарды тарта бастайды және жұп электрлік қабат түзіледі. Катиондар металдың бір таңбалы заттарының және оның иондарының ары қарай тұнбаға түсуі тоқталатынға дейін катиондар тұнбаға түседі. Екі теріс таңбалы зарядталған денелер болғанда олардың арасында потенциалдар айырмасының болатыны белгілі. Бұндай потенциалдар айырмасы мұнда да, жұп электрлі қабатта, металл-ерітінді шекарасында байқалады. Иондардың металдан ерітіндіге және қайта өтуі олардың арасында потенциалдар айырмасын тудырады. Металл-ерітнді жұбын электрод деп айту қабылданған. Бұл жағдайда потенциал электродты деп аталады. Электродты потенциал неге тәуелді болады? Оны өлшеуге бола ма және қалай? Осы сұраққа жауап бере отырып, электрохимиктер бізге Нернст теңдеуін береді:
φ=φο+RT\nF•lg[Men+]
мұндағы φ- электродты потенциал; [Men+]- металл иондарының концентрациясы, моль\л; Т- абсолют температура; n- металл иондарының валенттілігі; φο- стандартты электродты потенциал; F- Фарадей саны (F=96500 Кл). Осы теңдеудегі ең маңызды өлшем- стандартты электродты потенциал φο. Оның физикалық мәні анық болады, [Men+]=1 моль\л. Онда теңдеудің екінші мүшесі нөлге тең болады. Яғни, стандартты электродты потенциал дегеніміз, соңғы 1моль\л концентрациясы үшін металл мен ерітінді иондарының шекарасында өтетін потенциалды айтады. Бұл электродтың ең негізгі сипаты болып табылады. Нернсттің теңдеуі әрбір электродтың электродты потенциалы әр түрлі өзгерістерге ұшырай алады. Оны ерітінді концентрациясына тәуелді болатын теңдеудің екінші мұшесі растайды. Енді мынадай сұрақ туындайды, электродты потенциалды қалай өлшеуге болады? Егер екі электродты қосатын болсақ гальваникалық элемент пайда болатыны бізге мәлім. Бұл элементтің кернеуі оның екі құрамдас электродының потенциалдар айырмасына тең болады. Егер бізге бір электродтың электродты потенциалы белгілі болса, біз екіншісінің электродты потенциалын анықтай аламыз. Қиыншылықтың барлығы мынада жатыр: бір электродты потенциалдың мәнін білу қажет. Сутекті стандартты электродтың потенциалы нөлге теі деп қабылданған. Сутекті электрод платинадан жасалған және күкірт қышқылы ерітіндісіне батырылған (концентрация Н +--1 моль\л). Электрон беті кедір бұдырлы, әрі үлкен. Газ тәрізді сутегінің ағымы электродқа бірқалыпты жабысады. Сутегі платиналық электродтың бетімен жанасады, біртіндеп жиналады, Н2 бір бөлігі сутегу атомдарына ыдырайды. Платинада түзілген сутегі атомдары мен ерітіндідегі сутегу иондары арасында тепе теңдік орнайды. Металл-ерітінді шекарасында электрохимиктер нөл деп алатын потенциалдар айырмасы пайда болады. Әрине, шынында бұл потенциал нөлге тең емес, бірақ оның мәні бізге беймәлім. Сондықтан сутектік стандартты электродтың көмегімен электродты потенциалды анықтау сипаты қатынасты болып келеді; біз оны сутектік стандартты потенциалдың шартты алынған нөл мәні етіп анықтаймыз.
