
- •Сольваттану энергиясы
- •15. Дебай - Хюккельдің күшті электролиттер теориясы
- •18. Эквивалентті электрөткізгіштікке температураның әсері
- •29. Гальваникалыќ элементке арналған Нернст теңдеуін шығару
- •30. Электродтық потенциалға арналған Нернст тењдеуініњ термодинамикалыќ негізделуі
- •39. Ион тасымалдау саны
- •40. Гитторф әдісімен ион тасымалдау санын аныќтау
Гротгус, Фарадей және Аррениустің элетролит ерітінділерінің иондық өткізгіштік табиғатына көз қарасын салыстыр және сипаттама бер
Аррениус теориясының оң және теріс жақтарына баға бер, жауаптарыңызды электролит ерітінділерінің электр өткізгіштігі көз қарасы тұрғысынан негіздеңіз.
Курнаков теориясының көз қарасы тұрғысынан электролит ерітінділерінің түзілу механизіміне сипаттама беріңіз, жауаптарыңызды негіздеңіз.
Элетролит ерітінділеріндегі иондық өткізгіштіктің табиғатын қалай түсінесіз және олардың электр өткізгіштігін қалай түсіндіресіз.
Электролит ерітінділерінде Кулон заңы орындаладыма және электролит ерітінділеріндегі ион зарядының болмауын қалай түсіндіруге болады.
Кристаллдық тор энергиясын есептеу үшін қолданылатын Борн моделіне сипаттама беріңіз.
Кристаллдық тор энергиясына сипаттама беріңіз және оны есептеу үшін Борн әдісін түсіндіріңіз.
Сольваттану энергиясының энергиясын есептеу үшін ұсынылған Борн моделіне сипаттама беріңіз.
Сольваттану энергиясына сипаттама беріңіз және оны есептеу үшін Борн әдісін түсіндіріңіз.
Кристаллдық тор энергиясын есептеу үшін Борн теңдеуін шығарыңыз және талдау жасаңыз.
Сольваттану энергиясын және сольваттану жылуын есептеу үшін Борн теңдеуін шығарыңыз және талдау жасаңыз.
Сольваттану энергиясын және сольватттанудың жылу эффектісін Борна-Бьеррум теңдеуіне сәйкес салыстырыңыз және сипаттама беріңіз.
Күшті электролиттерді түсіндіру үшін неге Аррениус теориясын қолдануға болмайды, жауабын негіздеңіз.
Аррениус теориясымен салыстырғанда Льюистің термодинамикалық теориясының артықшылығын түсіндіріңіз.
Күшті электролит ерітініділері үшін Дебая-Хюккель теориясының қолданбалы бағытына сипаттама беріңіз.
Льюистің термодинамикалық теориясының активтену коэффициентін, активтену ұғымын енгізу мағынасын түсінді, жауабын негізде.
Салыстырмалы электр өткізгіштікке сипаттама беріңіз және оның әлсіз және күшті элетролиттер үшін концентрацияға тәуелділігін түсіндіріңіз.
Эквивалентті электр өткізгіштікке сипаттама беріңіз және оның әлсіз және күшті элетролиттер үшін концентрацияға тәуелділігін түсіндіріңіз.
Күшті қышқылды күшті негізбен титрлеудің кондуктометрлік титрлеу қисығына сипаттама бер, жауабын негізде.
Әлсіз қышқылды күшті негізбен титрлеудің кондуктометрлік титрлеу қисығына сипаттама бер, жауабыңызды негіздеңіз.
Күшті қышқылдың әлсіз негізбен титрлеудің кондуктометрлік титрлеу қисығына сипаттама бер, жауабын негіздеңіз.
Металл-электролит ерітіндісі шекарасында жүретін процесстерді сипаттаңыз, металл пластинкасы бетінде зарядтың пайда болу себебін түсіндіріңіз.
Металл-электролит шекарасында гальвани-потенциалының пайда болу себебін түсіндіріңіз. Неліктен беттік қабат теріс немесе оң зарядқа ие болады. Бұл құбылыс немен байланысты.
Қосэлектірлік қабат құрылысын сипаттаңыз. Қосэлектірлік қабат құрылысы жөнінде қандай ұсыныстарды білесіз, оларды бір-бірімен салыстырыңыз.
Қосэлектірлік қабат құрылысы жөніндегі Гельмгольц моделі мен Гуи-Чапмен моделін салыстырыңыз. Бірінші екі модельден Штерн моделі қандай айырмашылық жасайды.
Даниэль-Якоби элементі негізінде гальваникалық элементтің құрылысын жазыңыз, Электр тоғының пайда болу себебін түсіндіріңіз.
Тоқ көзі ретінде гальваникалық элементтің физикалық мағынасын түсіндіріңіз. Белгілі бір мысал үшін электродта жүретін жартылай реакциясы мен гальваникалық элементте жүретін толық реакцияны көрсетіңіз.
Нақты бір мысал негізінде элетродтық потенциалдың таңбасы неге тәуелді екенін түсіндіріңіз, электродтың теріс және оң мәнге ие болуын дәлелдеңіз, схема келтіріңіз.
Гальваникалық тізбектерге қолданатын Нернст теңдеуін талдаңыз. Элементтің стандартты электрқозғаушы күші мен гальваникалық элементтің электрқозғаушы күшінің физикалық мағынасын түсіндіріңіз. Мысал келтіріңіз.
Электродтарға қолданылатын Нернст теңдеуін талдаңыз. Стандартты электродты потенциал мен тепе-теңдік электродты потенциалының физикалық мағынасын түсіндіріңіз. Мысал келтіріңіз.
Гальваникалық элементтің схемасын қалай жазу керектігін сипаттаңыз. Катодта және анодта қандай реакциялар жүретіндігіне мысал келтіріңіз. Тізбекте электр тоғының пайда болу себебін түсіндіріңіз.
Электролиздің бірінші және екінші заңына сипаттама беріңіз. Ток бойынша шығым дегеніміз не, неліктен электролиз заңдарынан ауытқу процесі байқалады.
Бірінші текті элекродтар екінші текті электродтар бір-бірімен қандай айырмашылық жасайды. Мысал келтіріңіз, реакцияның схемасын жазыңыз.
Газды және тотығу-тотықсыздану электродтарының ерекшеліктерін көрсетіңіз, Мысал келтіріңіз, реакцияның схемасын жазыңыз.
Химиялық тізбектердің ерекшеліктерін сипаттаңыз, Мысал келтіріңіз, реакцияның схемасын жазыңыз.
Концентрациялық тізбекті сипаттаңыз (тасымалдану жоқ), реакцияның схемасын жазыңыз.
Концентрациялық тізбекті сипаттаңыз (тасымалдану бар), реакцияның схемасын жазыңыз.
Диффузионды потенциалдың пайда болу себебін түсіндіріңіз, Мысал келтіріңіз, реакцияның схемасын жазыңыз.
Ионның қозғалғыштығын, абсолютті жылдамдығын, тасымалдану санын сипаттаңыз, Тасымалдану санын анықтау әдістері.
Тасымалдану санын анықтайтын Гитторф әдісі мен қозғалмалы шекара әдісін сипаттаңыз.
1-2.Гротгус, Фарадей және Аррениустің элетролит ерітінділерінің иондық өткізгіштік табиғатына көз қарасын салыстыр және сипаттама бер
Электролиттік диссоциация теориясын 1887 ж. швед ѓалымы, 25 жасар Сванте Аррениус ±сынѓан, теорияда электролит ерітінділерініњ электр µткізгіштігі туралы жања кµзќарастар айтылды. Аррениус теориясыныњ негізгі ќаѓидалары мынадай:
Бейорганикалыќ жєне органикалыќ ќышќылдар, негіздер жєне т±здар ерітіндіде зарядталѓан бµлшектер - иондарѓа ыдырайды.
Иондар идеал газ молекулаларындай бір-бірімен єрекеттеспейді.
Электролиттер к‰шті жєне єлсіз электролит болып екіге бµлінеді. Сол себепті электролиттік диссоциация дєрежесі () деген ±ѓым енгізілді:
= ионѓа ыдыраѓан молекулалар саны
ерітіндідегі жалпы молекулалар саны
Электролиттіњ
(МА) бір молекуласы (
ионѓа ыдырайды дейік, сонда ерітіндініњ
кµлем бірлігінде т‰зілген иондардыњ
саны ( ),
ионѓа ыдырамай ќалѓан молекулалардыњ
саны
),
ионѓа ыдырамай ќалѓан молекулалардыњ
саны
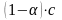 болады, с - электролит ерітіндісініњ
концентрациясы.
болады, с - электролит ерітіндісініњ
концентрациясы.
Сонда ерітіндідегі бµлшектердіњ жалпы саны

і= ,
м±ндаѓы і - Вант-Гоффтыњ изотондыќ
коэффициенті, ол диссоциация нєтижесінде
бµлшектердіњ саны ќанша есе µсетінін
кµрсетеді.
,
м±ндаѓы і - Вант-Гоффтыњ изотондыќ
коэффициенті, ол диссоциация нєтижесінде
бµлшектердіњ саны ќанша есе µсетінін
кµрсетеді.
Егер =
1 болса к‰шті
электролит, =0
болса электролит
емес, ал
 болса єлсіз
электролит болады.
болса єлсіз
электролит болады.
4. Әлсіз электролиттердіњ диссоциациясы ќайтымды процесс болатындыќтан, процестіњ тепе - тењдік константасын диссоциация константасы деп атайды (Kдис).
Егер MA электролитініњ диссоциациясын келесі т‰рде беретін болсаќ: МАMn++An-, онда массалар єрекеттесу зањын ќолданып диссоциациялану константасын былай жазуѓа болады:

Аррениус теориясыныњ кемшіліктері
Аррениус еріткіш пен еріген зат арасындаѓы ион-диполдыќ єрекеттесуді ескермеді. Электролиттердіњ диссоциалануына ќажетті жылу ќайдан алынатыны Аррениус теориясында т‰сіндірілмейді.
Аррениус теориясында ион-иондыќ єрекеттесу де (иондар арасындаѓы тартылыс не тебіліс к‰штері) ескерілмейді.
4. Электролит ерітінділері. Еріген кезде еріткішпен әрекеттесш, ионд арға диссоциацияланып, ерітіндіге ток өткізгіштік кабілет беретін заттарды электролиттер дейді. Кейде электролиттер ионо-генді және ионоферлі болып екіге бөлінеді. Ионогенді электролит-тер таза күйінде диссоциацияланбаған молекулалардан тұрады. Бүл тектес электролиттерге сірке қышқылы, тұз қышқылы және тағы басқалар мысал болады. Ал, ионоферлі электролиттерге еш-бір еріткіште ерімесе де, таза қалпында-ақ өз құрамында диссо-циацияланған иондары бар қосылыстар жатады. Бұл топқа көпте-ген тұздар мысал болады. Егер электролит толық диссоциациялан-са және осы кездегі әрбір молекула v иондарға ыдыраса, онда ерітіндідегі иондар саны Nv болады, мұндағы N — электролит молекуласының саны. Егер де барлық молекула диссоциациялан-бастан, оның а бөлігі ғана ыдыраса, онда ерітіндідегі бөлшектер саны N электролитіндегіден і есе аз болады, мұндағы і — изото-никалық коэффициент, кейде оны Вант-Гофф коэффициенті де дейді.
і=1 + а(v-1) (95)
Мұндағы а — диссоциациялану дәрежесі, кейде оны иондану дә-режесі десе, енді бірде диссоциациялану коэффициенті дейді. Дис-социациялану дәрежесі иондарға ыдыраған молекулалардың электролиттегі барлық молекулаларға қатынасымен анықталады. Бұдан электролиттердің аномальдік, коллигативтік қасиеттерге бейім екендігі байқалады. Егер электролит емес ерітінділердің коллигативті қасиеттерін өрнектейтін теңдеуге изотоникалық коэффициентті енгізсе, онда тәжірибе кезінде және есептеу арқы-лы алынған шамаларды теңеуге болады.
Электролиттер диссоциациялану қабілетіне орай шартты екі топқа бөлінеді: әлсіз және күшті электролиттер.
Әлсіз электролиттер. Көптеген косылыстарды еріткенде олар-дың молекулалары түгелдей диссоциацияланбайды, яғни иондарға ыдырамайды. Оларға органикалык қышқылдардың басым көпші-лігін, фенолды, аммиакты және аминдерді, көмір қышқылын, сынап тузы сияқты кейбір тұздарды, тағы басқаларды жаткызуға болады. Әдетте электролиттердің күшін диссоциациялану дәреже-сі (а) арқылы сипаттайды. Берілген электролиттің диссоциация-лану дәрежесі а<0,3 болса, ол әлсіз, ал а>0,3 болса күшті элект-ролит делінеді. Диссоциациялану дәрежесі концентрация сияқты
90
көптеген өлшемдерге тәуелді болады. Демек, оны диссоциация константасы арқылы өрнектеу ыңғайлы.
Әлсіз электролиттің диссоциация теңдігін қарастырайық. Ол үшін бинарлы, яғни диссоциация кезінде бір катион және бір ани-он беретін шартты таңбамен өрнектелген электролитті мысал ретінде алайық: КА+К+А-
Егер берілген қышқылдың бір молі V литр еріткіште ерітілсе, оны У= 1 : С ерітіндіні сұйылту дейді және Сқ+ =СA- =а,/V, ал
САК=(1-а) :V.
Онда диссоциация константасы К=
Бұл өрнекті Оствальдтьщ суйылту заңы (1888) дейді.
Бұдан берілген концентрациядағы диссоциациялану дәрежесі жоғарылаған сайын, диссоциация константасынын, артатыны анық көрінеді. Демек, электролиттің күшін диссоциация константасы арқылы оңтайлы өлшеуге болады. Кез келген теңдік константасы сияқты диссоциация константасы да температураға тәуелді шама. Олай болса, электролит күші температураға сәйкес өзгереді. Осы жоғарыда алынған өрнек бойынша, берілген концентрациядағы электролиттің диссоциациялану дәрежесінің шамасын пайдала-нып, диссоциация константасын анықтайды. Сол сияқты берілген концентрациядағы диссоциация константасын пайдаланып, кез келген концентрациядағы диссоциациялану дәрежесін есептеп шы-ғарады. (96) өрнек тек бинарлы электролиттер үшін екенін еске-ріп, басқа күрделі электролиттер үшш біршама түрлендіріп, өр-некті концентрация мен диссоциациялану дәрежесі сияқты айны-малы шамалар арқылы сипаттау керек екенін айтқан жөн.
Күшті электролиттер. Қөптеген заттар ерігенде молекуласының басым көпшілігі иондарға ыдырайды, яғни диссоциацияланады. Олардың қатарына күшті қышкылдар мен күшті негіздер және біраз тұздар жатады. Күшті электролиттердің ерітінділерінде Оствальдтың сұйылту заңынан едәуір ауытқушылық байқалады. Әуелде бүл құбылыс аномальді деп есептелді. Әйтсе де, мұны нақ-тылы тәжірибелер арқылы зерттеу, күшті электролиттердің толық диссоциацияланатынын көрсетті. Аса жоғары емес, шамамен орташа не одан да төменгі концентрациядағы электролит ерітінді-лерде тек ион түрінде болады. Демек, күшті электролит ерітіндіде-гі иондар концентрациясы осындай әлсіз электролитпен салыстыр-ғанда біраз жоғары болады және дәл осының салдарынан ион-дардың ара қашықтығы жақындай түседі де иондардың өзара әрекеттесуі, әсерлесуі күшейеді. Мұндағы көптеген жайларға электролиттердің ток өткізгіштігін талдау кезінде қайта ора-ламыз.
5. Ерітінді аркылы бір Кулон электр тогы өткенде ауысқан зат-тың граммен өлшенетін шамасын электрохимиялык, эквивалент дейді. Бір грамм-эквиваленттің электрохимиялык эквивалентке қатынасын Фарадей саны (Р) дейді және ол заттардың табиғаты-на тәуелсіз. Дәл өлшенген Фарадей саны Ғ = 96 484, 56 -+0,27 Қу-лон/моль. Бұл сан бір зарядты ионы бар заттың бір молінде бола-тын заряд санына тең. Оны элементар ион зарядтарыныд санына (г) көбейткенде, бір мольдегі иондар алып жүретін электр шамасы шығады. Ал, Фарадей санын Авогадро санына бөлгенде, электрон немесе протон зарядына теңелетін бір зарядты жалғыз ионның, заряды шығады:
Е= 1,6 022-10-19 Кулон = 4,8030-10-эл. ст. бірлік.
Электролиттердің электр тогын өткізгіштік қабілеті иондардың қозғалгыштығына да байланысты. Бұл құбылысты зерттеу элект-ролит ерітінділердің қасиеті жайлы көптеген мәліметтерді анық-тауға мүмкіндік береді/Мысалы, оның көмегімен әлсіз электро-литтердің диссоциациялану дәрежесі мен диссоциация константа-сының шамасы және күшті электролиттердід активтілігі мен активтілік коэффициенті жайлы деректерді анықтап, изотоника-лық коэффициентті есептеуге болады. Әр түрлі процестердің жү-руін бақылау үшін иондар қозғалысындағы айырмашылық пайда-ланылады.
Ерітіндіде тасымалданатын электр саны иондардың саны және оның жылдамдығы мен заряды сияқты шамаларға күрделі функ-ционалды тәуелділікте болады Ал, жылдамдық ион табиғатына, ерітіндінің тұтқырлығына, температура мен потенциал градиенті-не байланысты
Сонымен электролит ерітіндінін, электр өткізгіштік қабілеіі электр өткізгіштікпен немесе оған кері шама — кедергімен сипат-талады. Электр өткізгіштікті (L)мына формула бойынша есеп-тейді:
L== мұндағы S — өткізгіштің көлденең қима ауданы, I — өткізгіштің ұзындығы (екі электрод аралығы), R — өткізгіштің кедергісі, — меншікті этектр өткізгіштік, яғни ауданы бір шаршы сантиметр болатын және бірі-бірінен бір сантиметр қашықтықтағы екі электрод арасындағы ерітіндінің электр өткізгіштігі. Егер электр өткізгіштік Ом~’-мен өлшенсе, меншікті электр өткізгіштік өлшемі Ом-^-см-1 болады.
Ом заңы бойынша кедергі (R) кернеуге (U) тура, ток күшіне
(I) кері пропорционалды, яғни R= . Бұдан
мұндағы і — ток тығыздығы (А/см2), х — потенциал градиенті (В/см).
Олай болса, потенциал градиенті 1 В/см болғанда 1 см2 ері-тінді арқылы 1 секундта өтетін электрдің мөлшерін сипаттайды екер.
Ерітіндідегі иондардың қасиеттерін нақты зерттеу үшін мен-шікті электр өткізгіштіктен гөрі, эквивалентті электр өткізгіштікті
() пайдаланған әлдеқайда тиімді Ол 1 см қашықтықта орна-ласқан, бет ауданы бірдей екі электрод арасында берілген кон-центрациядағы электролит ертіндісінід бір грамм-эквивалентінен пайда болатын барлық иондардың электр өткізгіштігін сипаттай-ды. Егер осы екі электрод аралығында V см3 көлемдегі ерітінді болса, онда осы ерітіндімен шектесетін электродтың беті 5 см2-не сәйкес келеді. Демек,
_.
(99)
мұндағы V — көлем, — эквивалентті электр өткізгіштік, С — ерітінді концентрациясы.
Ендеше электролит ерітіндісінің меншікті электр өткізгіштігі мен концентрациясы белгілі болса, онда оның эквивалентті электр өткізгіштігін оңай есептеуге болады екен. Эквивалентті электр өткізгіштік Ом-см^-г-экв1 өлшеммен өлшенеді
Ерітіндідегі иондар арасында ешқандай өзара әрекеттесу бол-маған жағдайда, меншікті электр өткізгіштік электролиттің кон-центрациясы өскен сайын өседі, яғни олар түзу сызықты байла-ныста болады екен. Ал, эквивалентті өткізгіштік электролит кон-центрациясына тәуелсіз^) Алайда, бұл айтылған пікір электролит ерітінділері барынша сұйытылған кезде ғана өз күшінде қалады. Өйткені ерітінді шексіз сұйытылғанда ондағы иондар бір-бірінен едәуір алыс орналасады да, олардың арасындағы кулондық әсер әлсірейді. Мұны көптеген тәжірибелер көрсетіп отыр және осы тұста ерітінді табиғатына байланысты тура тәуелділік концентра-цияның белгілі бір мәнінен бастап ауытқиды.
6-7-8-9-10-11-12.Кристалдық тор және Сольваттану энергиясындағы Борнның теңдеуі.
Кристалдыќ тор энергиясы кристалл ќ±рамындаѓы иондарды бір-бірінен шексіз ‰лкен ќашыќтыќќа ажыратуѓа ж±мсалатын ж±мыс.
Кристалдық тор энергиясын есептеу үшін Борн келесі теңдеулерді ұсынды:
 (Борнныњ
1 - тењдеуі),
(Борнныњ
1 - тењдеуі),
 (Борнныњ
2 - тењдеуі),
(Борнныњ
2 - тењдеуі),
м±нда Z1, Z2 – иондардың зарядтары; r - иондар арасындағы қашықтық; - ортаныњ диэлектрлік т±раќтысы; NА - Авагадро саны; А - Моделунг т±раќтысы, ол кристалдыњ энергиясы мен иондардыњ µзара єсерлерін ескеретін шама; n - заттыњ табиѓатына жєне сыѓылу коэффициентіне тєуелді шама; А жєне r0 - ді рентгенструктуралыќ анализден, ал n-ді кристалл сыѓылуы туралы мєліметтерден аныќтайды; U - екі бµлшектіњ єрекеттесуініњ потенциалдыќ энергиясы, ал 1 моль үшін Борнның ІІ теңдеуі орындалады.
Габер-Борн термодинамикалық циклі
Г абер-Борн
термодинамикалық циклі кµмегімен
электролиттердіњ кристалдыќ тор
энергиясын есептеуге болады және оны
мына сызба-нұсқа арқылы көрсетуге
болады:
абер-Борн
термодинамикалық циклі кµмегімен
электролиттердіњ кристалдыќ тор
энергиясын есептеуге болады және оны
мына сызба-нұсқа арқылы көрсетуге
болады:
м±нда NaCl - NaCl кристалл торыныњ ыдырау жылу эффектісі;
1 - натрийдіњ иондану ж±мысы;
2 - электронныњ хлор атомымына ынтыќтылыќ энергиясы;
3 - натрий буыныњ конденсация кезіндегі жылу эффектісі;
4 - хлор атомыныњ рекомбинация (ќайта ќосылу) реакциясыныњ жылу эффектісі;
5 - натрийдыњ хлорда жану реакциясыныњ жылу эффектісі.
Гесс
зањын ќолданып жазсаќ: NaCl
= -│1+2+3+4+5│.Содан
соњ кристалдыќ тор энергиясын мына
тењдеуден аныќтаймыз:
 .
.
Сольваттану энергиясы
Сольваттану энергиясы - 1 моль ионныњ вакуумнан еріткішке кµшу процесініњ энергиясы немесе басќа сµзбен айтќанда, 1 моль ионды бір ортадан екінші бір ортаѓа кµшіру ж±мысы. Сольваттану энергиясын аныќтау ‰шін Борн єдісі ќолданылады, онда мына тењдеу пайдаланылады:
 ,
,
м±нда 0 - бірінші ортаныњ диэлектрлік т±раќтысы; - екінші ортаныњ диэлектрлік т±раќтысы; Zіe - ион заряды; rі- ион радиусы.
13. Аррениус теориясы бейтараптану реакциясыныњ маѓынасын т‰сіндіреді, бейтараптану реакциясы тек су молекуласыныњ т‰зілу жылулыѓымен (Е) сипатталады: Е=57-58 кДж/моль.
Теория ќышќылдарды, негіздерді, т±здарды классификациялауѓа м‰мкіндік берді, ерітінділердіњ буферлік ќасиетін т‰сіндірді.
Аррениустың бұл теориясы тек єлсіз электролиттердң сұйылтылған ерітінділеріне қолданылады.
Теория рН ±ѓымын енгізді, б±л ±ѓым ортаны ќышќылдыќ, сілтілік жєне бейтарап орта деп бµлуге м‰мкіндік берді.
Аррениус теориясыныњ кемшіліктері
Аррениус еріткіш пен еріген зат арасындаѓы ион-диполдыќ єрекеттесуді ескермеді. Электролиттердіњ диссоциалануына ќажетті жылу ќайдан алынатыны Аррениус теориясында т‰сіндірілмейді.
Аррениус теориясында ион-иондыќ єрекеттесу де (иондар арасындаѓы тартылыс не тебіліс к‰штері) ескерілмейді.
14. 1905 ж. Льюис электролит ерітінділерініњ термодинамикалыќ тењдеулеріндегі концентрацияны олардыњ активтілігіне алмастыру туралы ±сыныс жасады (Льюистіњ активтілік теориясы); активтілік дейтін шама (а) ерітіндідегі бµлшектердіњ арасындаѓы єрекеттесу к‰штерін сипаттайды. Активтену әдісін қолдана отырып күшті электролиттер ерітінділері үшін электролиттердің жалпы активтілігі туралы түсінік енгізілді:

мұнда аs - электролиттің жалпы активтілігі; а+, а- - катионның және анионның активтілігі сәйкесінше; +, - - электролиттің 1 молекуласы ыдырағандағы катиондар мен аниондардың саны.
Практикада жеке ионныњ активілігін аныќтауѓа болмайды, сондыќтан орташа иондыќ активтілікті а, пайдаланады. Орташа иондыќ активтілік катион мен анионныњ активтіліктерініњ геометриялыќ орта мєні:

мұнда =++-. Сонда аs = ( a), мысалы, Cr2(SO4)3 электролиті ‰шін мынадай түрде көрсетуге болады:
 .
.
Сонымен қатар, катион мен анионныњ активтілік коэффициенттерініњ геометриялыќ орта мєні ретінде электролиттіњ орташа иондыќ активтілік коэффициенті () түсінігі, ал катион мен анионныњ молялдыќтарыныњ геометриялыќ орта мєні ретінде орташа иондыќ молялдыќ концентрация (m)түсінігі енгізіледі. Олай болса,
 және
және

1905 ж. Льюис электролит ерітінділерініњ термодинамикалыќ тењдеулеріндегі концентрацияны олардыњ активтілігіне алмастыру туралы ±сыныс жасады (Льюистіњ активтілік теориясы); активтілік дейтін шама (а) ерітіндідегі бµлшектердіњ арасындаѓы єрекеттесу к‰штерін сипаттайды. Активтену әдісін қолдана отырып күшті электролиттер ерітінділері үшін электролиттердің жалпы активтілігі туралы түсінік енгізілді:
мұнда аs - электролиттің жалпы активтілігі; а+, а- - катионның және анионның активтілігі сәйкесінше; +, - - электролиттің 1 молекуласы ыдырағандағы катиондар мен аниондардың саны.
Практикада жеке ионныњ активілігін аныќтауѓа болмайды, сондыќтан орташа иондыќ активтілікті а, пайдаланады. Орташа иондыќ активтілік катион мен анионныњ активтіліктерініњ геометриялыќ орта мєні:
мұнда =++-. Сонда аs = ( a), мысалы, Cr2(SO4)3 электролиті ‰шін мынадай түрде көрсетуге болады:
.
Сонымен қатар, катион мен анионныњ активтілік коэффициенттерініњ геометриялыќ орта мєні ретінде электролиттіњ орташа иондыќ активтілік коэффициенті () түсінігі, ал катион мен анионныњ молялдыќтарыныњ геометриялыќ орта мєні ретінде орташа иондыќ молялдыќ концентрация (m)түсінігі енгізіледі. Олай болса,
және
